黄颡鱼溶血性腹水病初探
2019-08-29杨移斌艾晓辉
杨移斌,艾晓辉,宋 怿,董 靖,胥 宁,姜 兰
(1.中国水产科学研究院 珠江水产研究所,广东 广州 510380; 2.中国水产科学研究院 长江水产研究所,湖北 武汉 430223; 3.农业农村部水产品质量安全控制重点实验室,北京 100141)
黄颡鱼(Pelteobagrusfulvidraco),俗称黄腊丁、嘎牙子等,隶属于鲇形目(Siluriformes)、鲿科(Bagridae)、黄颡鱼属(Pelteobagrus)[1],是一种经济价值较高的特色淡水经济养殖品种[2]。目前黄颡鱼主要细菌性病原包括:迟钝爱德华氏菌(Edwardsiellatarda)[3-4]、鮰爱德华氏菌(Edwardsiellaictaluri)[5]、蜡状芽孢杆菌(Bacilluscereus)[6]、维氏气单胞菌(Aeromonasveronii)[7]、温和气单胞菌(Aeromonassobria)[8]、柱状黄杆菌(Flavobacteriumcolumnare)[9]、类志贺邻单胞菌(Plesimonasshigelloides)[10]、海豚链球菌(Streptococcusiniae)[11]、拟态弧菌(Vibriomimicus)[12]等。随着病原呈现多元性发展,种类不断增多,而防控手段发展较慢,导致疾病暴发时难以及时有效控制,给养殖户带来经济损失的同时也成为黄颡鱼产业发展的一大瓶颈。
2017年6—7月,湖北省荆州某养殖场暴发黄颡鱼大规模腹水病,发病率50%左右,死亡率高,导致了重大经济损失。笔者经现场调查、取样,病样经液氮保存后带回实验室分析,根据试验结果,确定此次黄颡鱼发病是由细菌引起的,并进行病原相关研究及药敏特性分析,为黄颡鱼腹水病的防控提供了理论支撑。
1 材料与方法
1.1 材料
1.1.1 供试鱼
6尾有典型腹水症状的黄颡鱼取自湖北荆州某养殖场,鱼腹部膨大,肛门有出血溃烂状,鳃部正常,体表无明显伤痕。感染用黄颡鱼(10±0.5)g购于武汉江夏某苗种场,无明显外伤,健壮活力强,在实验室饲养7 d后无异常,用于试验。
1.1.2 主要试剂
营养肉汤、营养琼脂、MH琼脂、革兰氏染色液、药敏纸片及细菌生化微量鉴定管均购自杭州微生物试剂有限公司;谷氨酸盐淀粉酚红琼脂(GSP琼脂)购自国药集团;2×Taq PCR Mix、引物由上海生工提供。
1.2 方法
1.2.1 临床调查
对荆州某黄颡鱼养殖场及周边环境、黄颡鱼腹的病发病史及用药情况进行调查。
1.2.2 病原菌多样性分析
在无菌条件下,取6条典型患病黄颡鱼置于操作台上,使用已灭菌剪刀在黄颡鱼肚皮上轻轻戳破,分别将腹水装入10 mL离心管中。取5 mL腹水样品,加入20%甘油,混匀后置于-80 ℃冰箱保存待用;另取5 mL样品,送至上海美吉生物医药科技有限公司抽提DNA,并在Illumina Mi-Seq平台上进行高通量测序。
1.2.3 病原菌分离
基于病原菌多样性测序结果,可知此次暴发腹水病黄颡鱼的腹水中气单胞菌属种类占据极大优势。用接种环蘸取保存的腹水划线于平板上,置于28 ℃培养24 h后,挑取单菌落进一步纯化,纯化后的细菌加入20%甘油保存于-20 ℃备用。分离菌株暂命名HS01。
1.2.4 人工感染及LD50测定
将HS01接种于营养琼脂上,置于28 ℃恒温培养24 h,用枪头吸取PBS洗下菌苔至无菌离心管中,参照麦氏比浊法调整菌液浓度分别为5.0×108、5.0×107、5.0×106、5.0×105、5.0×104CFU·mL-1。
将健康黄颡鱼分为6组(A—F),每组30尾。其中A—E组黄颡鱼分别腹腔注射5.0×109、5.0×108、5.0×107、5.0×106与5.0×105CFU·mL-1菌液,每尾0.1 mL,对照组(F)注射等量PBS。试验期间不投喂,溶氧保持在7.5~8.5,水温24~26 ℃,使用充分曝气的自来水进行养殖。每5 h观察黄颡鱼动态,尤其注意其游泳姿态、速度及体表可能出现的症状,及时对发病临死黄颡鱼进行解剖观察,并进行细菌再分离。记录发病死亡数,并用概率单位图解法[13]计算半致死剂量(LD50)。
1.2.5 分离株HS01的理化特性测定
将分离株HS01接种于营养琼脂平板上,置于28 ℃恒温培养24 h后,并进行革兰氏染色,采用细菌微量生化鉴定管参照《常见细菌系统鉴定手册》[14]测定分离株的理化指标。
1.2.6 分离株的16S rRNA和gyrB基因序列分析及系统发育树的构建
将分离株HS01接种于营养琼脂平板上,置于恒温28 ℃培养24 h,挑取单菌落溶于10 μL无菌水中,即可作为菌液PCR的模板。扩增通用引物为27F: 5′-AGAGTTTGATC(C/A)TGGCTCAG-3′;1492R: 5′-GGTTACCTTGTTACGACTT-3′。反应体系:2×Taq PCR Mix 50 μL,双蒸水47 μL、上下游引物各1 μL,DNA模板1 μL,共100 μL。反应条件:98 ℃ 1 min;98 ℃ 15 s,55 ℃ 30 s,72 ℃ 1 min,共35个循环;72 ℃ 10 min。gyrB基因引物参照Yamamoto等[15]为UP1: 5′-GAAGTCATCATGACCGTTCTGCAYGCNGGNGGNAARTTYGA-3′;UP2: 5′-AGCAGGGTACGGATGTGCGAGCCRTCNACRTCNGCRTCNGTCAT-3′。PCR反应体系:2×Taq PCR Mix 50 μL,双蒸水 47 μL,上下游引物各1 μL,DNA模板1 μL,共100 μL。PCR 反应条件:98 ℃ 1 min;98 ℃ 15 s,55 ℃ 30 s,72 ℃ 1 min,共35个循环;72 ℃ 10 min。16S rDNA和gryB基因扩增产物经1%琼脂糖凝胶电泳验证为目的片段后送生工生物工程(上海)股份有限公司纯化及序列测定。
将分离株HS01的16S rRNA及gryB基因序列放到NCBI里面进行比对,根据比对结果选取同源性较高的病原菌序列,以及水产重要病原菌序列,采用Clustal X软件进行多序列匹配分析,通过MEGA6.0软件Neighbor-Joining法构建系统进化树,1 000次Bootstrap检验置信度。
1.2.7 分离株细菌毒力与耐药基因分析
以分离菌株的DNA为模板,对毒力基因溶血素基因(hlyA)[16]、气溶素基因(aerA)[17]、热不稳定性肠毒素(Alt)[18],以及丝氨酸蛋白酶(aphA)[19]进行PCR扩增;同时对耐药基因Sul1[20]、qnrA[21]、ant(3’)-Ia[21]及tetA[21]进行PCR扩增。引物序列、退火温度和片段大小见表1,扩增产物经1%琼脂糖凝胶电泳检测验证为目的片段后送生工生物工程(上海)股份有限公司进行纯化与测序。
1.2.8 药敏特性分析
参照美国临床和实验室标准协会(clinic and laboratory standards institute, NCCLS)抗微生物药物敏感性实验执行标准,采用纸片扩散法进行分离株HS01的药敏特性分析[22]。
1.2.9 病理学分析
取带有典型腹水症状的黄颡鱼鳃、肝脏、肾脏、脾脏、肌肉及肠道,用10%的中性福尔马林固定液固定,酒精梯度脱水,二甲苯透明,石蜡包埋、切片(厚度4 μm),苏木精-伊红(HE)染色,中性树脂胶封片后,显微镜观察并拍照。
2 结果与分析
2.1 临床调查
此次发病黄颡鱼养殖场位于湖北荆州,养殖水面约13.33 hm2,发病率约50%,死亡率近70%。黄颡鱼腹水病发病期较长,但死亡时间集中,死亡量大,病死鱼规格都在50 g上下,经济损失较大。经调查发现,养殖户曾经使用调水产品及杀虫药物,但未进行淤泥清除及底泥改良,养殖水质符合渔业水质指标要求水平,但有机物浓度较高,有富营养化倾向,水温24~28 ℃。
表1 基因引物序列
Table 1 Sequence information of primers

引物名称Primer name序列Sequences(5’-3’)退火温度Annealing temperature/℃扩增长度Length/bphlyA-FGGCCGGTGGCCCGAAGATACGGG66592hlyA-RGGCGGCGCCGGACGAGACGGGGaerA-FCAAGAACAAGTTCAAGTGGCCA55309aerA-RACGAAGGTGTGGTTCCAGTAlt-FTGACCCAGTCCTGGCACGGC55442Alt-RGGTGATCGATCACCACCAGCaphA-FATTGGATCCCTGCCTATCGCTTCAGTTCA55911aphA-RGCTAAGCTTGCATCCGTGCCGTATTCCSul1-FFCATTGCCTGGTTGCTTCAT62433Sul1-RATCCGACTCGCAGCATTTqnrA-FATTTCTCACGCCAGGATTTG55516qnrA-RGATCGGCAAAGGTCAGGTCAant(3’)-Ia-FATCTGGCTATCTTGCTGACA55284ant(3’)-Ia-RTATGACGGGCTGATACTGGtetA-FGCTACATCCTGCTTGCCTTC55915tetA-RGCATAGATCGCCGTGAAGAG
2.2 细菌分离与致病性分析
根据黄颡鱼腹水中细菌16S rRNA高通量测序结果,在属水平上对腹水中细菌优势属进行统计分析,气单胞菌占明显优势。采用气单胞菌选择培养基谷氨酸盐淀粉酚红琼脂从黄颡鱼腹水中选择性分离气单胞菌,从而分离纯化HS01菌株。经人工感染试验,黄颡鱼注射不同浓度的HS01菌悬液后,出现不同程度的死亡(表2)。
感染发病死亡黄颡鱼出现腹部膨大、满腔腹水及肛门红肿溃烂的症状,与自然发病症状相似(图1),并且分离到形态及理化特性与HS01一致的菌株,由此表明分离株HS01是本次黄颡鱼腹水病的病原。参照表2建立死亡率(%)与细菌剂量对数[lg(CFU)]的关系曲线:y=25.33x-112.14(R2=0.95),分离株HS01对黄颡鱼半数致死剂量为2.51×105CFU·g-1。
2.3 细菌鉴定
分离株HS01革兰氏染色为红色,表明其为阴性菌。生理生化指标见表3,初步判断HS01为嗜水气单胞菌(Aeromonashydrophila)。HS01的16S rRNA及gyrB基因的片段大小分别在1 500、1 000左右(图2),符合预期。将分离菌株HS01 16S rRNA及gyrB基因序列与NCBI中已有序列进行比对,结果显示,HS01与嗜水气单胞菌(Aeromonashydrophila)同源性最高。选取同源性较高气单胞菌种类及水产重要病原菌种类的16S rRNA及gyrB基因序列,分别构建基于16S rRNA及gyrB基因序列发育树(图3、4),结果显示,分离株均跟嗜水气单胞菌(Aeromonashydrophila)聚为一支。因此综合分离株HS01的理化特性与基因分析结果,判定分离株HS01是嗜水气单胞菌(Aeromonashydrophila)。
表2 分离株对黄颡鱼LD50试验结果
Table 2 Results of LD50of isolation strain inPelteobagrusfulvidraco

组别Group注射剂量Injected dose/CFU·g-1实验鱼数量Fish number死亡数量Amount ofdeath死亡率Mortality/%A5.0×1073030100.00B5.0×106302790.00C5.0×105302066.67D5.0×10430723.33E5.0×1033026.67F03000
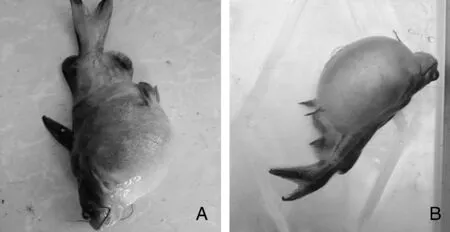
图1 自然发病(A)和人工感染(B)黄颡鱼Fig.1 Image for natural infected (A) and artificial infected (B) Pelteobagrus fulvidraco
2.4 药敏特性
药敏试验结果表明,分离株HS01对β-内酰胺类药物全部耐药,对氨基糖疳类及大环内酯类部分耐药,对酰胺醇类、四环素类及喹诺酮类全部高度敏感,对头孢类及磺胺类中度或高度敏感(表4)。
参照嗜水气单胞菌毒力基因Alt、hlyA、aphA及aerA扩增的特异性引物进行合成,PCR特异性扩增只获得Alt及hly目的片段,大小分别为592、309 bp(图5);参照文献合成耐药基因引物,对耐药基因进行特异PCR扩增,未获得目的条带(图6)。

M,DL 2 000 maker;a,16S rRNA基因扩增产物;b,gyrB基因扩增产物。M, DL 2 000 maker; a, PCR product of 16S rRNA;b,PCR product of gyrB.图2 16S rRNA及gyrB基因的PCR扩增结果Fig.2 The PCR amplification results of 16S rRNA and gyrB gene
表3 HS01菌株生理生化特征
Table 3 Physiological and biochemical characteristics of HS01
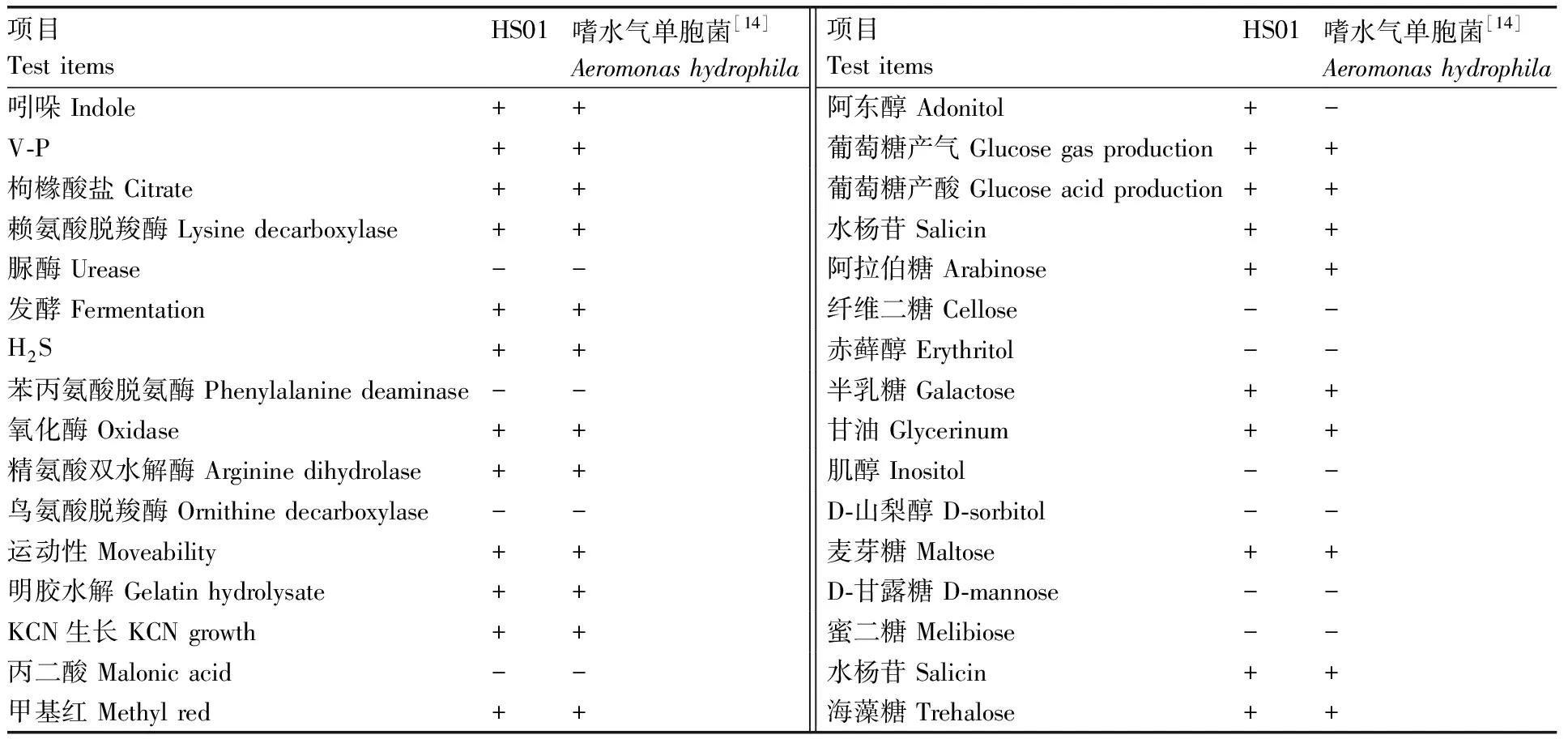
项目Test itemsHS01嗜水气单胞菌[14]Aeromonas hydrophila项目Test itemsHS01嗜水气单胞菌[14]Aeromonas hydrophila吲哚 Indole++阿东醇 Adonitol+-V-P++葡萄糖产气 Glucose gas production++枸橼酸盐 Citrate++葡萄糖产酸 Glucose acid production++赖氨酸脱羧酶 Lysine decarboxylase++水杨苷 Salicin++脲酶 Urease--阿拉伯糖 Arabinose++发酵 Fermentation++纤维二糖 Cellose--H2S++赤藓醇 Erythritol--苯丙氨酸脱氨酶 Phenylalanine deaminase--半乳糖 Galactose++氧化酶 Oxidase++甘油 Glycerinum++精氨酸双水解酶 Arginine dihydrolase++肌醇 Inositol--鸟氨酸脱羧酶 Ornithine decarboxylase--D-山梨醇 D-sorbitol--运动性 Moveability++麦芽糖 Maltose++明胶水解 Gelatin hydrolysate++D-甘露糖 D-mannose--KCN生长 KCN growth++蜜二糖 Melibiose--丙二酸 Malonic acid--水杨苷 Salicin++甲基红 Methyl red++海藻糖 Trehalose++
“+”,阳性;“-”,阴性。
“+”, positive; “-”, negative.

图3 HS01 16S rRNA 基因序列与相关菌株的系统发育树Fig.3 Phylogenetic tree based on 16S rRNA gene sequence of HS01 strain and its relatives
2.5 病理学变化
如图7所示,患病黄颡鱼大量肠上皮细胞脱落,肠上皮细胞中可见大小不一的圆形脂滴,肠黏膜中可见多量淋巴细胞浸润(图7-A);部分肝细胞发生脂肪变性,细胞内可见大小不一的圆形空泡,少量肝窦轻度淤血(图7-B);肌肉中多量肌纤维损伤,肌原纤维数量减少,排列杂乱(图7-C);脾组织中红细胞和淋巴细胞数量较少,脾窦扩张(图7-D);鳃丝局部失血,鳃小片中红细胞数量减少,组织中可见淋巴细胞浸润(图7-E);肾脏肾小球毛细血管边可见均匀红染物质,肾小球外可见结缔组织包囊,肾小管上皮细胞水泡变性,胞体肿胀,胞浆淡染,可见局灶性黑色素沉积(图7-F)。
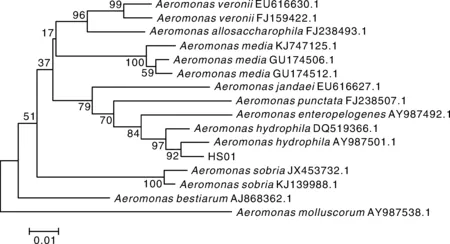
图4 HS01 gyrB基因序列系统进化树Fig.4 Phylogenetic tree based on gyrB gene sequence of strain HS01
表4 HS01药敏试验结果
Table 4 Antibiotic sensitivity test of strain HS01

药物Drugs抑菌圈直径判断标准Standard of inhibition zone diameter/mm不敏感Resistant中度敏感Medium sensitivity高度敏感Highly sensitive药物含量Dose/(g·disc-1)抑菌圈直径Zonediameter/mm敏感性Sensitivityβ-内酰胺类青霉素 Penicillin≤1718~20≥2110 U0Rβ-lactam阿莫西林 Amoxicillin≤1314~17≥18200R头孢类Cephalosporin头孢唑肟 Cefazolin oxime≤1415~19≥203035S头孢拉定 Cefradine≤1415~17≥183016I头孢噻肟 Cefotaxime≤1415~22≥233024S氨基糖疳类庆大霉素 Gentamicin≤1213~14≥151013IAminoglycosides链霉素 Streptomycin≤1112~14≥151014I奈替米星 Netilmicin≤1213~14≥153020S卡那霉素 Kanamycin≤1314~17≥183016I妥布霉素 Tobramycin≤1213~14≥151010R新霉素 Neomycin≤1213~16≥173014I大环内酯类Macrolides阿奇霉素 Azithromycin≤1314~17≥181520S红霉素 Erythromycin≤1314~22≥231510R四环素类Tetracyclines四环素 Tetracycline≤1819~22≥233030S强力霉素 Doxycycline≤1213~15≥163025S喹诺酮类Quinolones依诺沙星 Enoxacin≤1415~17≥181030S诺氟沙星 Norfloxacin≤1213~16≥171028S酰胺醇类Amphenicols氯霉素 Chloramphenicol≤1213~17≥1830035S氟苯尼考 Florfenicol≤1213~17≥187522S磺胺类Sulfonamides磺胺异噁唑 Sulfamisoxazole≤1213~16≥1730013I
S,高度敏感;R,耐药;U,青霉素的含量以单位计。
S, highly sensitive; R, resistant; U, penicillin content measured in unit.
3 讨论
16S rRNA高通量测序技术是基于细菌16S rRNA基因在功能上的高度保守性及一定程度的高变性来检测细菌种类[23-24]。本试验根据16S rRNA高通量测序结果,利用选择性培养基培养气单胞菌,在患腹水病濒死黄颡鱼腹水内分离到一株致病菌HS01,经人工感染试验,确定为本次黄颡鱼腹水病病原,通过理化特性测定及保守基因分型,确定分离株HS01为嗜水气单胞菌,从而确定本次黄颡鱼暴发溶血性腹水病的病原是嗜水气单胞菌。16S rRNA高通量测序技术的引入使得本结果更加可信,也解决传统水生动物细菌性病原确定缺点,是对传统方法的补充与完善。

M,DL 2 000 maker;a、b、c、d分别为Alt、hlyA、aphA、aerA基因扩增产物。M, DL 2 000 maker; a, b, c, d represented PCR product of Alt, hlyA, aphA, aerA genes.图5 分离株HS01的毒力基因PCR扩增结果Fig.5 Results of PCR amplification of virulence gene of HS01 strain

M,DL 2 000 maker;a、b、c、d分别为Sul1、qnrA、ant (3’)-Ia、tet A基因扩增产物。M, DL 2 000 maker; a, b, c, d represented PCR product of Sul1, qnrA, ant (3’)-Ia, tet A genes.图6 分离株HS01的耐药基因PCR扩增结果Fig.6 Results of PCR amplification of drug-resistant of HS01 strain

A,肠;B,肝;C,肌肉;D,脾;E,鳃;F,肾。A, Intestines; B, Liver; C, Muscle; D, Spleen; E, Gill; F, Kidney.图7 病理学观察Fig.7 Pathological observation
腹水病是水生动物养殖过程中常见及危害较大的一种疾病,可分为溶血性与非溶血性腹水,溶血性腹水病是由细菌性病原引起,而非溶血性腹水病多是由营养代谢障碍引起的。目前已报道的可发生腹水病的种类有异育银鲫[25]、中华鳖[26]、鲢鳙[27]、乌鳢[28]、日本鳗鲡[29]与牛蛙[30]等,大多数是溶血性腹水病。本研究中,患病黄颡鱼主要症状表现为腹部膨大,肛门红肿溃烂,腹腔有大量腹水,而腹水离体几分钟后即形成胶体状,肝肾脾有充血肿大,肝发黄,肠道无食物,与孙其焕等[25]研究比对可知,本次黄颡鱼疾病是典型的溶血性腹水病。
嗜水气单胞菌是典型的人-畜-鱼共患病病原菌,可导致水生动物发生溶血性腹水病[25-30]。本试验从患病濒死黄颡鱼腹水中分离到的HS01株具有强毒力,含有溶血素及气溶素基因,气溶素可以使全身脏器广泛出血,并破坏宿主细胞膜,导致细胞死亡[31],溶血素是基因组DNA编码的毒力因子,形成共聚后插入细胞膜上,形成管道,导致溶血[32]。对黄颡鱼腹水病病理学研究,进一步佐证了嗜水气单胞菌对黄颡鱼可以产生较大危害,影响其健康生长,并能导致大规模死亡。
虽然现代水生动物防控技术发展日新月异,但药物仍是治疗患病动物的主要手段。本研究中,分离株HS01对β-内酰胺类全部耐药,对氨基糖疳类及大环内酯类部分耐药,对酰胺醇类、四环素类及喹诺酮类高度敏感,对头孢类及磺胺类中度或高度敏感。经特异性PCR扩增细菌磺胺类、喹诺酮类、氨基糖苷类及四环素类耐药基因,并未获得相应片段,表明耐药的表型与基因型存在一定差异。根据试验测得的分离株药敏特性,在实际生产中可选择水产上允许使用的而病原菌对其又高度敏感的药物进行治疗。值得一提的是,我国幅员辽阔,水产养殖区域跨度大,因而养殖环境、品种及方式差异较大,病原的药敏特性可能会存在一定的差距。在水生动物疾病防控时,一定要开展药物敏感性试验,从而确保治疗效果,避免药物滥用。
