氯胺酮体外对星形胶质细胞表面脑保护相关受体表达的影响
2019-08-22刘邱阿雪凌晓敏
刘邱阿雪, 凌晓敏, 方 芳, 仓 静
复旦大学附属中山医院麻醉科,上海 200032
近年来,缺血缺氧造成的脑组织损伤由于发生率高、预后差而备受关注。以脑卒中为例,美国2007年流行病学资料显示,脑卒中发病率仅次于心脏疾病及癌症;每年约有100万例卒中相关病例,其中50万例为新发病例,20万例为复发病例,24万例为短暂性脑缺血发作[1]。除脑卒中外,脑缺血缺氧亦是先兆性偏头痛、癫痫、脑外伤及脑出血等疾病的病理生理基础,与这些疾病的预后密切相关[2-3]。
皮质扩散性抑制(cortical spreading depression,CSD)是缺血性脑病中神经损伤发生和发展的关键环节;临床和离体实验证据均提示,氯胺酮可通过抑制CSD的发生而降低症状的严重程度及发生频率,从而改善缺血缺氧性脑病的预后[4-7]。而氯胺酮作为一种在临床麻醉中被广泛应用的静脉麻醉药物,具有非竞争性阻断N-甲基-D-天冬氨酸(N-methyl-D-aspartic acid receptor,NMDA)受体的作用。此外,氯胺酮还对谷氨酸受体、Na+-K+泵、钙离子通道及乙酰胆碱受体有阻断作用,对阿片类受体有激动作用,亦可以阻断5-羟色胺、多巴胺和去甲肾上腺素的重吸收[8]。近年来,研究还发现,在Na+-K+泵等[9]表面受体、生长相关蛋白43(growth associated protein-43,GAP-43)[10]及以谷氨酸转运体1(glial glutamate transporter 1,GLT-1)[11]为主要代表的兴奋性氨基酸转运体(excitatory amino acid transporters,EAAT)的参与下,星形胶质细胞对CSD发挥促进和抑制的双重作用[12-13]。然而,氯胺酮对CSD是否通过星形胶质细胞及其表面的受体等发挥作用,尚不确切。
星形胶质细胞可在脑损伤的急性缺血期及延迟性神经溃变中保护神经元[14],减轻CSD的扩散波强度[9],帮助CSD造成的受损神经元及神经组织重建[15]。在生理情况下以及脑损伤发生早期细胞外钾离子浓度升高时,星形胶质细胞通过Na+-K+泵等表面受体将细胞外积聚的钾离子运送至细胞内中和[9];同时,由GAP-43蛋白形成的星形胶质细胞间隙亦可以通过细胞间联系,发挥中和过多钾离子的作用[10]。过量谷氨酸在细胞外堆积的快速消除主要依赖于EAAT。目前已发现的5种EAAT中,主要表达于星形胶质细胞表面的EAAT2(即GLT-1)承担脑内约90%的谷氨酸摄取功能[11]。
本研究以离体培养原代星形胶质细胞为研究对象,采用蛋白质印迹技术探究消旋体氯胺酮对星形胶质细胞表面3种脑保护相关蛋白Na+-K+泵、GAP-43和GLT-1的调节作用。同时,本研究选取非竞争性NMDA受体阻滞剂MK-801和选择性竞争性NMDA受体阻滞剂AP-5作为对照组,以探讨氯胺酮在离体培养原代星形胶质细胞中的作用是否与NMDA受体有关及其作用途径。
1 材料与方法
1.1 星形胶质细胞的培养与纯度检验 将新生SD大鼠(复旦大学上海医学院动物实验中心提供)进行全身消毒后,在无菌条件下断头取脑,并在显微镜下分离脑皮质。将脑组织剪成体积约0.1 mm3的碎组织块,用胰蛋白酶消化15 min。用10% DMEM培养液反复重悬组织悬液,并收集过滤上清液。以850 r/min离心5 min,弃上清液,并重悬后铺板。24 h后观察细胞生长情况,并全量换液,此后每3 d全量换液1次。细胞培养至第7天,置于温度37℃、转速300 r/min的条件下,振摇培养板6 h。吹打后全量换液,细胞培养至第12天,弃去培养液,洗涤、固定及打孔后,用PBS按1∶200稀释偶联有FITC的细胞GFAP抗体(anti-GFAP,美国Santa Cruz公司),每孔加入200 μL,避光4℃条件下孵育过夜。用PBS按1∶10 000稀释荧光染料DAPI(用于染色细胞核),每孔加入200 μL,避光室温下孵育30 min。应用Nikon Ti-s 倒置荧光显微镜观察免疫荧光显色结果。
1.2 实验分组 取培养至第12天、生长状态良好的原代培养星形胶质细胞,分组如下:(1)空白对照组,即细胞未经任何药物处理;(2)氯胺酮组,即用100 μmol/L消旋体氯胺酮处理细胞15 min、30 min、2 h、6 h和24 h;(3)MK-801对照组,即用1 μmol/L MK-801处理细胞15 min、30 min、2 h、6 h和24 h;(4)AP-5对照组,即用50 μmol/L AP-5处理细胞15 min、30 min、2 h、6 h和24 h。各组细胞处理后,分别采用蛋白质印迹法检测细胞表面Na+-K+泵、GAP-43和GLT-1蛋白的表达情况,并用比色法检测乳酸脱氢酶(lactate dehydrogenase,LDH)漏出率。
1.3 蛋白质印迹法检测目的蛋白表达 收集各组细胞,提取细胞中总蛋白并使用BCA蛋白含量检测试剂盒(中国凯基生物公司)进行蛋白定量,应用SDS-PAGE凝胶快速配制试剂盒(中国碧云天生物技术公司)制备SDS-PAGE凝胶,根据所测得蛋白浓度在每一泳道中加入合适体积的目标蛋白样品(使目标蛋白含量为120 μg)进行电泳、转膜及封闭,将所得NC膜根据目标条带位置剪裁为合适大小后,分别置入配制好的Rabbit anti-EAAT2(英国Abcam公司)、Rabbit anti-Na+-K+ATPase(美国Millipore公司)、Mouse anti-Connexin-43(美国BD Bioscience公司)一抗溶液中孵育过夜后,慢摇床孵育相应二抗(抗兔二抗和抗鼠二抗均购自中国碧云天生物技术公司)45 min,洗膜后使用Odyssey双色红外激光成像系统(美国LI-COR公司)进行信号显影。
1.4 药物的细胞毒性作用检测 取培养至第12天、生长状态良好的原代星形胶质细胞,将细胞培养液换为不含FBS的DMEM培养液。加药时间以换液后24 h作为药物处理终点时间逆推。实验开始前15 min,向各处理时间所设的对照组中加入裂解液以裂解细胞。收集各孔细胞上清液, 300×g离心3 min后,取洁净96孔板,每孔中加入80 μL上清液,每种上清液复测3个孔,并取6个空白孔各加入80 μL未使用过的、不含FBS的DMEM液作为背景对照。按照乳酸脱氢酶(LDH)测试盒(德国Roche公司)说明书进行反应液和终止液处理,测定光密度(OD)值,重复实验6次。计算各给药组相对于空白对照组的LDH漏出量的相对百分率,以此反映各药物的细胞毒性。
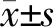
2 结 果
2.1 原代星形胶质细胞生长状态及纯度 光学显微镜下观察结果显示:大鼠脑组织细胞培养至第12天,生长状态良好(图1A)。以绿色荧光二抗标记细胞中的胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP;图1B),以DAPI复染细胞核(图1C),荧光显微镜下可见体外培养体系中95%以上为星形胶质细胞(图1D),胞体较大、形状不规则,细胞核明显、折光性良好、以“铺路石”样外观均匀分布。
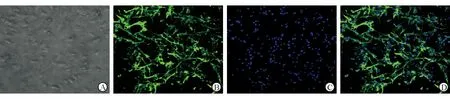
图1 原代星形胶质细胞的生长状态及纯度检测
A:培养12 d后光镜下细胞形态;B:免疫荧光技术检测细胞体分布;C:免疫荧光技术检测细胞核分布;D:免疫荧光技术检测细胞形态及纯度. Original magnification: ×200
2.2 氯胺酮对星形胶质细胞表面脑保护相关受体表达的影响
2.2.1 GLT-1 蛋白质印迹法检测结果(图2)表明:氯胺酮处理30 min和2 h后,星形胶质细胞表面GLT-1的表达较空白对照组增加(P<0.05)。对照药物AP-5处理24 h后,GLT-1蛋白表达减少(P<0.05);对照药物MK-801对GLT-1表达无明显影响。
2.2.2 Na+-K+泵 蛋白质印迹法检测结果(图3)显示:氯胺酮处理15 min和30 min后,星形胶质细胞表面Na+-K+泵表达较空白对照组增加(P<0.05)。对照药物MK-801处理6 h后,星形胶质细胞表面Na+-K+泵的表达上调(P<0.05);对照药物AP-5对Na+-K+泵无明显影响。
2.2.3 GAP-43 蛋白质印迹法检测结果(图4)显示:氯胺酮和对照药物MK-801处理6 h和24 h后,星形胶质细胞表面GAP-43的表达较空白对照组减少(P<0.05);对照药物AP-5对Na+-K+泵无明显影响。
2.3 氯胺酮处理对星形胶质细胞的毒性作用 LDH漏出率检测结果(图5)表明:持续作用15 min至24 h情况下,终浓度为100 μmol/L的氯胺酮、1 μmol/L的MK-801和50 μmol/L的AP-5均对离体培养的原代星形胶质细胞无损伤作用。

图2 各药物处理不同时间后原代培养星形胶质细胞表面GLT-1的表达情况

图3 各药物处理不同时间后原代培养星形胶质细胞表面Na+-K+泵的表达情况
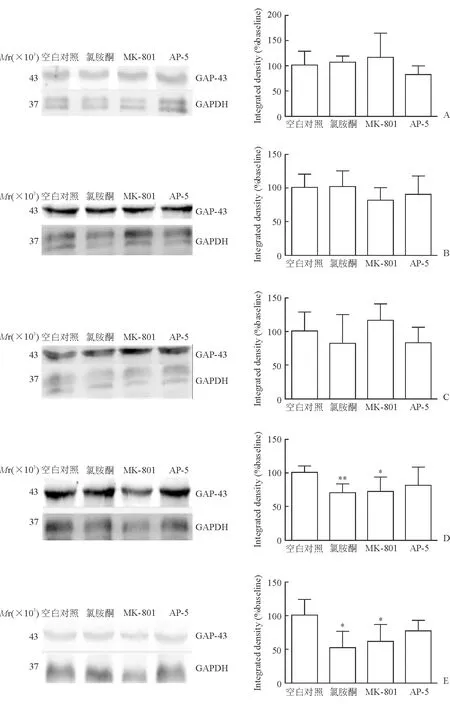
图4 各药物处理不同时间后原代培养星形胶质细胞表面GAP-43表达情况
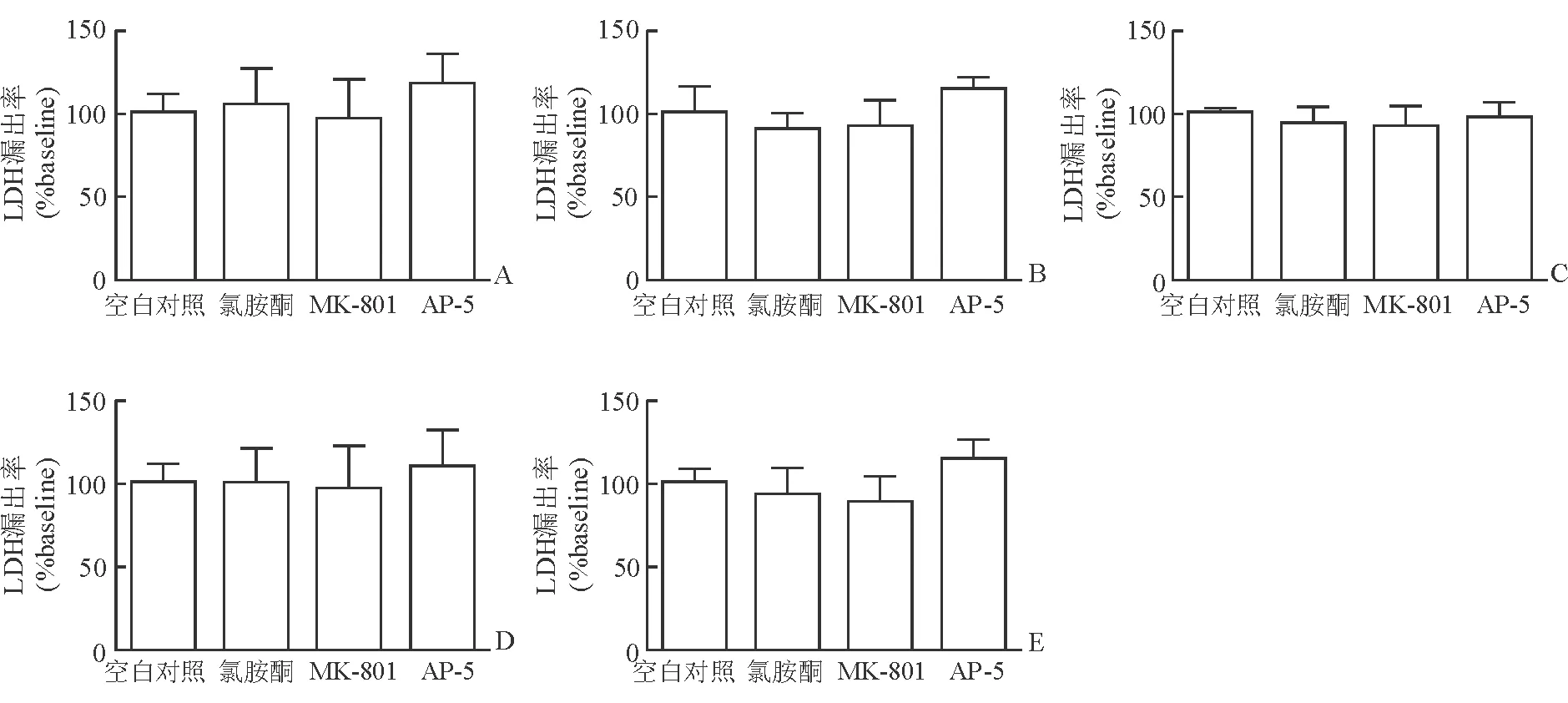
图5 各药物处理不同时间后原代培养星形胶质细胞LDH漏出率检测结果
3 讨 论
离体培养星形胶质细胞在基因表达、信号转导、代谢和钾离子摄取等方面均与在体星形胶质细胞相似[16]。因此,本研究选择原代培养的星形胶质细胞作为研究对象。在经氯胺酮持续处理30 min和2 h后,离体培养原代星形胶质细胞表面膜蛋白GLT-1的表达量相比于空白对照组明显增加。结果表明,氯胺酮可以通过调节星形胶质细胞表面的GLT-1受体发挥脑保护作用,但该保护作用较短,且为一过性,仅出现在氯胺酮持续作用时间为30 min~2 h的情况下。
为明确氯胺酮在离体培养原代星形胶质细胞中的作用及其作用受体,本研究选取了两种常见的NMDA受体阻滞剂(MK-801和AP-5)作为对照。作为最常见的非竞争性NMDA受体阻滞剂,MK-801具有与氯胺酮类似的多受体作用,其不仅可以阻断NMDA受体,还对烟碱型乙酰胆碱受体(N型乙酰胆碱受体)、5-羟色胺受体以及多巴胺受体有阻断作用[8]。而AP-5是一种快速起效的选择性、竞争性NMDA受体阻滞剂。因此,本研究使用氯胺酮、MK-801和AP-5分别处理星形胶质细胞,检测细胞表面GLT-1、Na+-K+泵以及GAP-43的表达。结果显示, MK801及AP-5在持续作用24 h内均未对GLT-1有保护性上调作用,提示氯胺酮可能一过性地通过非NMDA受体途径上调星形胶质细胞GLT-1的表达。此外,有研究[17]表明,慢性长期使用氯胺酮对GLT-1表达有永久性的下调性损伤作用。本研究结果发现,AP-5在持续作用24 h后,GLT-1表达明显下调。因此,以上结果提示,氯胺酮作用24 h并未发生下调GLT-1的作用,可能与多途径作用有关。本实验还显示,氯胺酮持续作用15 min和30 min后,星形胶质细胞表面的Na+-K+泵表达量较空白对照组明显增加; MK-801持续作用6 h后, Na+-K+泵表达也明显增加;AP-5处理组各时间点, Na+-K+泵表达均未改变。这些结果提示,氯胺酮对Na+-K+泵的作用可能不依赖于NMDA受体。
研究[18]表明,细胞间连接蛋白的表达是星形胶质细胞功能正常的充分必要条件,而GAP-43是星形胶质细胞中最主要的一种细胞间连接蛋白。本研究显示,氯胺酮持续处理时间≥6 h时,GAP-43的表达较空白对照组明显减少。Himmelseher等[6]用神经元和星形胶质细胞的混合培养模型发现,终浓度为100 μmol/L的S(+)氯胺酮可以上调谷氨酸预处理星形胶质细胞表面GAP-43的表达,且这种上调作用可以从给药后1 h持续至给药后7 d,但消旋体氯胺酮在相同的处理方法下并未表现对星形胶质细胞的保护或伤害作用,本研究所使用的氯胺酮为消旋体,结果与之相仿。 Viberg等[19]的动物实验结果也表明,氯胺酮处理24 h后,皮质中GAP-43蛋白表达水平下降。此外,本实验亦发现,氯胺酮处理6 h后星形胶质细胞表面GAP-43蛋白表达量减少;与氯胺酮的作用相似,MK-801的持续作用并未使离体培养原代星形胶质细胞表面GAP-43的表达量增加;无论处理时间长短,AP-5的处理并未对离体培养原代星形胶质细胞表面GAP-43表达有明显的作用。
此外,本研究药物在所选浓度和作用时间下均未表现出明显的细胞毒性作用。鉴于MK-801除阻断NMDA受体以外还可作用于多种其他受体,而AP-5是一种选择性NMDA受体阻滞剂,提示氯胺酮可能是通过与MK-801相似或相同的途径抑制GAP-43蛋白的表达,但具体机制有待进一步研究。而且S(+)氯胺酮对离体培养原代星形胶质细胞表面GAP-43蛋白表达的调节作用也须进一步研究证实。
如何预防脑损伤的发生,通过干预脑组织受损程度改善脑损伤相关疾病的预后,探究脑损伤的发生机制,明确已发现有脑保护作用的药物的作用机制和靶点途径,均是临床和科研工作者的关注重点。目前,氯胺酮的脑保护作用已在临床层面、离体脑片层面以及细胞层面(神经元与星形胶质细胞共培养模型及神经元培养模型)被证实,但是其具体作用途径和机制尚不明确。本研究通过探究氯胺酮对原代培养星形胶质细胞中与脑保护密切相关的3种蛋白的调节作用及时效性,初步分析氯胺酮作用的可能机制。本研究结果表明,消旋体氯胺酮可以一过性地通过非NMDA受体途径,上调星形胶质细胞表面GLT-1和Na+-K+泵的表达,这为进一步阐明氯胺酮潜在的脑保护作用提供了更多证据和新的思路。
