基于LC-MS联用的杜仲主要化学成分定性及定量分析△
2019-08-21雒晓梅宿美凤常晓燕王小明李壮壮王卫华孙桂波石钺
雒晓梅,宿美凤,2,常晓燕,王小明,李壮壮,王卫华,孙桂波,石钺*
1.北京协和医学院 中国医学科学院 药用植物研究所,北京 100193;2.北京中医药大学,北京 100029;3.清华大学 药学技术中心,北京 100084
杜仲EucommiaulmoidesOliv.为杜仲科杜仲属落叶乔木,是我国特有的第三世纪孑遗植物。杜仲干燥树皮自古以来以名贵滋补中药材而著称,用药历史悠久,《神农本草经》将其列为上品,杜仲味辛性平,主治腰膝痛、补中、益精气、坚筋骨、强志,除阴下痒湿,小便馀沥[1]。历版《中华人民共和国药典》均有将杜仲收录在册[2],现代研究表明杜仲树皮主要化学成分包括木脂素、环烯醚萜、黄酮、苯丙素、酚酸、甾醇及三萜、多糖、抗菌蛋白等,具有降压、降血脂、降血糖、抗肿瘤、抗菌抗病毒、保肝护肾等药理活性[3-6]。目前国内外学者对杜仲的研究集中在药理活性[7]、成分分析[8]、质量评价等[9-11]方面。本实验在前期的研究基础上,首次采用四级杆-静电轨道阱高分辨质谱(UPLC-QE)对杜仲70%乙醇水提取物的化学成分进行定性分析,采用超高效液相串联质谱(UPLC-MS/MS)三重四级杆质谱仪对其中7个主要成分(松脂醇二葡萄糖苷、松脂醇单葡萄糖苷、丁香脂素二葡萄糖苷、桃叶珊瑚苷、京尼平苷、京尼平苷酸、车叶草苷)进行定量分析,以期完善杜仲临床药效的物质基础,对其进一步合理开发用药及质量控制提供科学依据。
1 仪器与材料
1.1 仪器
Ultimate 3000超高效液相(美国戴安公司)串联Thermo Q ExactiveTMPlus OrbitrapTM高分辨质谱仪(美国赛默飞世尔科技公司),Agilent1290-QQQ6460液相色谱串联三重四级杆质谱仪(美国Agilent公司),Waters ACQUITY UPLC BEH C18色谱柱(100 mm×2.1 mm,1.7 μm),Waters ACQUITY UPLC HSS T3色谱柱(100 mm×2.1 mm,1.8 μm),Mettler Toledo AB135-S型分析天平(十万分之一,瑞士),KQ-250DE超声波清洗仪(昆山市超声仪器有限公司)。
1.2 药材与试剂
杜仲(批号:DC1211)购于北京华邈药业有限公司,经北京师范大学资源学院杜树山教授鉴定为杜仲科植物杜仲EucommiaulmoidesOliv.的干燥树皮,药品标本现保存于中国医学科学院药用植物研究所植物化学研究室。对照品均购于成都克洛玛生物科技有限公司,包括松脂醇二葡萄糖苷(批号:CHB170307)、松脂醇单葡萄糖苷(批号:CHB161227)、丁香脂素二葡萄糖苷(批号:CHB170706)、桃叶珊瑚苷(批号:CHB161103)、京尼平苷(批号:CHB171130)、京尼平苷酸(批号:CHB161101)、车叶草苷(批号:CHB161228)、山柰酚(批号:CHB170224)、黄芩苷(批号:CHB170720)、芦丁(批号:CHB170303)、槲皮素(批号:CHB171229)、绿原酸(批号:CHB170713)、原儿茶酸(批号:CHB170822)、阿魏酸(批号:CHB160913)、咖啡酸(批号:CHB160907),上述对照品HPLC法测定质量分数≥98%。乙腈(色谱级)、甲醇(色谱级)购于Honeywell Burdick&Jackson公司。甲酸(色谱级)、氨水(色谱级)购于赛默飞世尔科技(中国)有限公司,去离子水由Milli-Q纯水系统制备。
2 定性分析方法与结果
2.1 溶液配制
2.1.1 供试品溶液制备 将干燥的杜仲树皮剪碎称取适量,加入8倍量70%乙醇水热回流提取3次,每次1.5 h,滤过得提取药液,合并3次滤液,减压浓缩得流浸膏(得膏率为25%)。称取上述浸膏1.202 0 g溶于50%甲醇中配成终质量浓度0.5 mg·mL-1(生药质量浓度2 mg·mL-1)的供试品溶液。
2.1.2 对照品溶液配制 分别精密称取松脂醇二葡萄糖苷、松脂醇单葡萄糖苷、丁香脂素二葡萄糖苷、桃叶珊瑚苷、京尼平苷、京尼平苷酸、车叶草苷、山柰酚、黄芩苷、芦丁、绿原酸、原儿茶酸、阿魏酸,配制成质量浓度为1 mg·mL-1的对照品贮备液,取适量对照品贮备液混合后,得对照品混合液。
2.2 液质条件
2.2.1 色谱条件 Waters ACQUITY UPLC BEH C18色谱柱(100 mm×2.1 mm,1.7 μm);流动相A:乙腈,流动相B:0.1%甲酸-水;流速:0.2 mL·min-1;进样量:5 μL;自动进样器温度:10 ℃。梯度洗脱条件:0~2.0 min,5%~5%A;2.0~42.0 min,5%~50% A;42.0~55.0 min,50%~50%A;55.0~55.1 min,50%~5%A;55.1~60.0 min,5%~5%A。
2.2.2 质谱条件 ESI离子源,负离子检测模式,喷雾电压:-2800 V;毛细管温度:320 ℃;保护气体流速:35 L·min-1;辅助气体流速:10 L·min-1;扫描模式:Full MS/dd-MS2,Full MS分辨率70 000,dd-MS2分辨率17 500,扫描范围:m/z100~1500,阶梯碰撞能量:20、40、60 V。
2.3 杜仲化学成分数据库的建立
根据Dictionary of Natural Product数据库(http://www.chemnetbase.com)、TCMSP数据库(http://lsp.nwu.edu.cn/tcmsp.php)以及文献检索所提供的杜仲树皮的化学成分,结合Chemspider、Pubchem、Chembook数据库的化合物信息,构建杜仲的化学成分信息库,包括化合物的名称、分子式、分子量和CAS号等。
2.4 数据处理
将UPLC-QE所采集的原始数据导入Thermo Compound Discover2.0(CD)分析软件进行初步计算,CD软件可充分利用高保真的Orbitrap数据来准确鉴定复杂基质中的化合物,通过定制相应的工作流程,结合了多种识别技术,包括与mzCloud库、mzVault库、Chemspider库进行碎片及分子量匹配,从而初步筛选得出杜仲提取物中可能存在的化合物。此外,借助Thermo Xcalibur 2.2分析软件对质谱数据进行进一步分析和处理,根据高分辨质谱信息对其分子式进行推导,偏差不得大于5×10-6,对照参考文献[12-13]、各种在线数据库,推导可能的裂解碎片,
最终确定杜仲提取物中存在的化合物。
2.5 定性分析结果
按2.2项下条件对杜仲提取物进行分析,负离子模式下的总离子流色谱图见图1。通过与对照品比对及数据解析共确定98个化合物结构,包括木脂素类38个,环烯醚萜类13个,黄酮类9个,苯丙素类15个,酚类7个,三萜类、甾醇、小分子酸及其他化合物共16个。定性的结果如表1所示。

图1 杜仲70%乙醇水提取物的总离子流图

表1 杜仲70%乙醇水提取物中主要化合物

续表1

续表1

续表1
注:*表示化合物已与对照品比对确定。
2.5.1 木脂素类成分裂解特征 从杜仲提取液中共鉴定出38个木脂素类化合物[14-20]。该类化合物结构母核有5种:木脂素烃基上不同位置氧取代基缩合形成四氢呋喃型单环氧木脂素(化合物23、39、40、55);单环氧木脂素中脂肪烃链上羟基缩合形成双骈四氢呋喃环的双环氧木脂素(化合物38、44、47、50、51、52、61、62、63、68、69、70、71、78)及倍半木脂素(化合物64、76、77、79、81、82、84、85、86、87、89、93、94)。由1分子苯丙烯的侧链与另一分子苯丙烯的苯核聚合或通过氧键而聚合形成新木脂素(化合物36、41、46、57、65、67)。两分子的苯丙烯侧链聚合形成芳基四氢萘为基本骨架的环木脂素类(化合物43)。倍半木脂素在二级质谱中醚键断裂后,其剩余骨架的碎裂与双环氧木脂素、单环氧木脂素相似,多为先丢失糖基、CH3、CH2O、CH3OH、OCH3,接着发生四氢呋喃环的裂解,丢失1个或是连续丢失2个CH2O,最终形成特征离子m/z151。以松脂醇二葡萄糖苷的质谱裂解为例,如图2所示,准分子离子峰m/z681连续丢失糖基形成m/z519、357,前体碎片m/z357中的两个四氢呋喃环连续丢失2个CH2O,最终形成m/z151的碎片离子。
2.5.2 环烯醚萜类的裂解特征 从杜仲提取液中共鉴定出13个环烯醚萜类化合物(化合物3、4、5、9、14、17、18、21、30、31、35、45、53),该类化合物的基本母核是含有半缩醛醇羟基的环烯醚萜醇类,多以苷类的形式存在。常见易丢失母核上的功能基团葡萄糖、葡萄糖残基、H2O、CO2、CH3OH、CH3COOH等中性碎片[21-24],形成[M-H-Glu]-、[M-H-Glc]-、[M-H-Glc-H2O]-、[M-H-Glc-CO2]-、[M-H-Glc-H2O-CO2]-等碎片离子。此外环戊烯型的环烯醚萜由1个二氢吡喃环顺式连接五元环,由于母核结构上半缩醛结构的异构化,可能造成二氢吡喃环的断裂[25]。以京尼平苷酸的质谱裂解为例,如图3所示,京尼平苷酸的准分子离子峰m/z373丢失1分子Glc、H2O、CO2等形成m/z211、193、167、149的碎片峰,京尼平苷酸母核结构含有半缩醛结构,易形成2个醛结构的同分异构体,导致母环断裂。m/z123碎片离子的形成源于母环裂解后γH的重排。
2.5.3 黄酮类的裂解特征 从杜仲提取液中共鉴定出9个黄酮化合物(化合物54、56、59、83、88、90、95、96、97),其中5个黄酮醇类、4个黄酮类。由于黄酮类及黄酮醇类的化合物质谱裂解相似,故以芦丁的质谱裂解为例进行分析[26-28],如图4所示,芦丁为槲皮素的芸香糖苷,在一级质谱图中可见准分子离子峰m/z609,在丢失芸香糖中性碎片后形成苷元碎片m/z301,苷元碎片发生RDA裂解产生碎片m/z151,此外,m/z301丢失1分子H2O、CO产生碎片离子m/z255,该碎片离子经重排后易丢失中性分子CO产生m/z227的碎片离子。
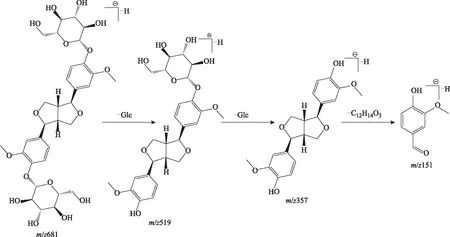
图2 ESI负离子模式下松脂醇二葡萄糖苷可能的裂解途径

图3 ESI负离子模式下,京尼平苷酸可能的裂解途径
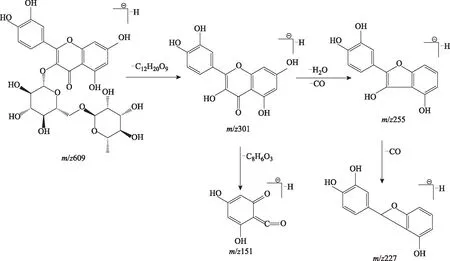
图4 ESI负离子模式下芦丁可能的裂解途径
2.5.4 苯丙素类的裂解特征 在杜仲提取物中鉴定出15个苯丙素类化合物(化合物7、15、16、20、22、24、28、29、34、42、49、60、66、75、92)。已鉴定的多数苯丙素的结构与绿原酸相似或是绿原酸的某个片段,故以绿原酸为例说明已解析的苯丙素可能的裂解规律[29-30]。绿原酸是咖啡酸与奎宁酸形成的酯。在一级质谱中可见其准分子峰m/z353,绿原酸的酯键断裂后形成碎片m/z191、179,奎宁酸片段m/z191在丢失1分子H2O后形成碎片离子m/z173,咖啡酸片段m/z179在丢失一分子CO2后形成碎片m/z135。
3 定量分析方法与结果
3.1 溶液的配制
3.1.1 供试品溶液配制 精密称取2.1.1项下的流浸膏,以水为稀释液,稀释不同倍数后作为供试品溶液。
3.1.2 对照品溶液配制 分别精密称取松脂醇二葡萄糖苷、松脂醇单葡萄糖苷、丁香脂素二葡萄糖苷、桃叶珊瑚苷、京尼平苷、京尼平苷酸、车叶草苷,甲醇溶解,配制成质量浓度为1 mg·mL-1的对照品贮备液,取适量对照品贮备液混合后,得对照品混合液。
3.2 液质条件
3.2.1 色谱条件 色谱柱Waters ACQUITY UPLC HSS T3(100 mm×2.1 mm,1.8 μm),柱温:30 ℃,进样量:10 μL,流动相A:体积分数为0.01%的氨水,流动相B:体积分数为0.01%氨水的乙腈甲醇(1∶1),流速:0.2 mL·min-1,梯度洗脱条件:0~3 min,100%A;3~5 min,100%~90%A;5~8 min,90%~90%A;8~11 min,90%~80%A;
11~13 min,80%~20%A;13~15 min,20%~0%A;15~16 min,0%A;16~16.1 min,0%~100%A;16.1~20 min,100%A。
3.2.2 质谱条件 离子源为ESI源,负离子检测模式。Sheath Gas Temp为300 ℃,Sheath Gas Flow流速为11 L·min-1,Gas Temp为325 ℃,Gas Flow为8 L·min-1。Capillary电压为4000 V(-),Nebulizing Gas为45 psi(1psi=6.895 kPa),Nozzle Voltage电压为500 V(-)。扫描模式为多反应检测模式(MRM),7种成分的质谱参数见表2,色谱图见图5。

表2 杜仲提取物中7个主要成分的质谱测定参数

注:A.对照品;B.杜仲提取物样品;1.车叶草苷;2.桃叶珊瑚苷;3.京尼平苷;4.京尼平苷酸;5.松脂醇单葡萄糖苷;6.松脂醇二葡萄糖苷;7.丁香脂素葡萄糖苷。图5 杜仲提取物中7个主要成分的离子流图
3.3 定量方法学考察
3.3.1 线性关系考察 取3.1.2项下的各对照品母液以水进行不同倍数稀释,得到系列浓度的混合对照品工作液。依3.2项下的色谱-质谱条件进样分析。以各待测组分的质量浓度(X,μg·L-1)分别对相应峰面积(Y)进行线性回归,得相应的回归方程和相关系数。结果表明,在一定的质量浓度范围内,各成分均有良好的线性关系。将线性范围的最低质量浓度继续稀释,进样分析,以信噪比S/N=10的进样浓度为定量下限(LOQ),以信噪比S/N=3时的进样浓度为检测限(LOD)。结果见表3。
3.3.2 精密度试验 取3.1.2项下对照品混合溶液,按3.2项下的色谱质谱条件测定。连续进样6次,7个待测化合物峰面积的RSD分别为2.75%、2.25%、2.17%、2.11%、2.21%、1.29%、3.42%,结果见表3,RSD均小于5.0%,表明该仪器及方法的精密度良好。
3.3.3 稳定性试验 取3.1.2项下对照品混合溶液,在3.2项液质条件下,分别于0、4、8、12、24 h进样分析,根据随行标准曲线和样品峰面积计算各成分的含量和RSD,结果显示各成分含量的RSD分别为4.12%、1.90%、2.71%、2.62%、2.96%、5.01%、4.96%,RSD均小于6%,表明各被测成分在24 h内稳定性良好。
3.3.4 重复性试验 按3.1.1项下方法制备杜仲提取物的供试品溶液,在3.2项液质条件下,根据随行标准曲线和样品峰面积计算7个成分的含量及RSD,得出各成分质量浓度平均值分别为28.42、252.57、100.55、351.57、174.40、225.22、160.89 μg·L-1,RSD分别为1.95%、2.93%、4.32%、1.11%、2.57%、3.15%、3.06%,RSD均小于5%,表明该方法重复性良好。
3.3.5 加样回收率试验 称定同一批已知含量的杜仲提取物约1 mg,平行6份,置于量瓶中,分别加入各对照品适量,按3.2.1项下方法制备供试品,进样分析,计算回收率及其RSD,结果见表4。各成分平均回收率在90%~110%,RSD均小于5%,表明该方法准确可靠。
3.4 样品含量测定
精密称量杜仲提取物,平行6份,按3.1.1项方法制备供试品溶液,在3.2项液质条件下进样分析,根据随行标准曲线和样品峰面积计算各成分的含量,结果每克杜仲生药含车叶草苷2.84 μg、桃叶珊瑚苷101.03 μg、京尼平苷167.59 μg、京尼平苷酸585.95 μg、松脂醇单葡萄糖苷290.67 μg、松脂醇二葡萄糖苷1 638.50 μg、丁香脂素二葡萄糖苷268.15 μg。
4 讨论
在实验中,定性色谱条件考察了包括乙腈-0.1%甲酸水和甲醇-0.1%甲酸水的不同配比和梯度洗脱,最终确定乙腈-0.1%甲酸水色谱峰的分离度、峰形及质谱的离子化效率更好;定量色谱条件考察中发现加入0.01%氨水后,色谱峰的峰型及离子化更佳。同时考察了Waters ACQUITY UPLC BEH C18色谱柱以及Waters ACQUITY UPLC HSS T3色谱柱的差异,通过结果对比最终选择了0.01%氨水-0.01%(V/V)氨水的乙腈-甲醇(1∶1)系统以及Waters HSS T3柱。质谱条件考察了UPLC-QE高分辨质谱正、负离子检测模式,得出负离子模式下的各类化合物的离子化更佳、信息更丰富。结合杜仲中化合物的类型,选择负离子检测模式为成分分析及含量测定的方法。
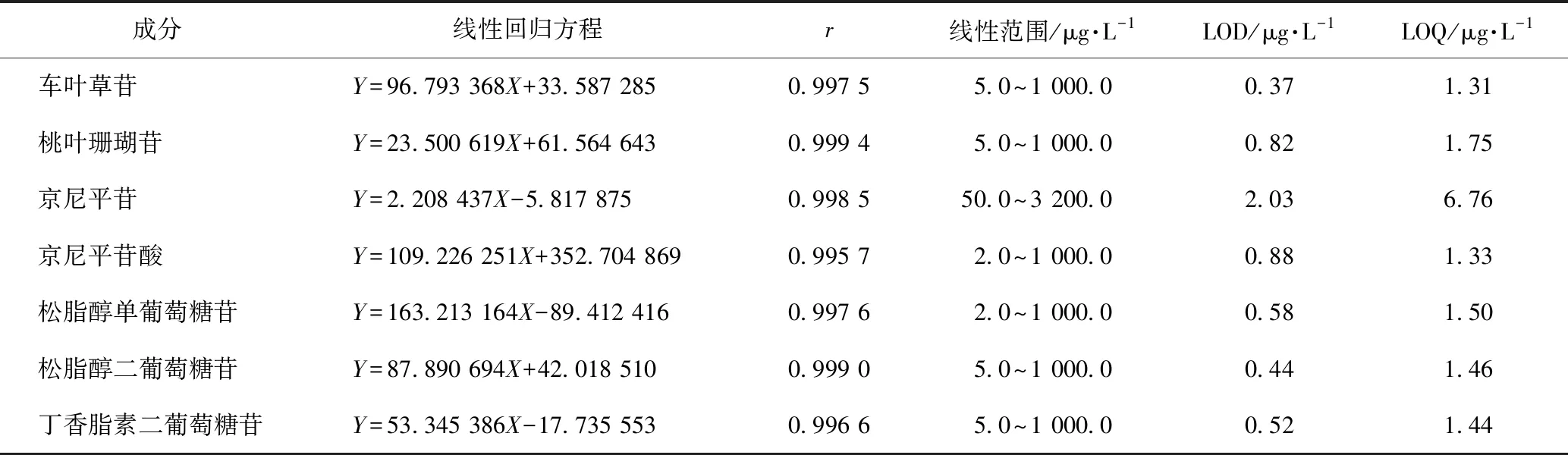
表3 杜仲提取物中7个主要成分的回归方程、线性范围、LOD、LOQ

表4 杜仲提取物中7个主要成分的回收率试验结果
本研究采用UPLC-QE技术快速、全面分析杜仲中的化学成分,共鉴定出98个化合物,包括木脂素类38个,环烯醚萜类13个,黄酮类9个,苯丙素类15个,酚类7个,其余化合物16个。杜仲在含有丰富化合物基础上,其药理活性与临床应用也比较广泛[1-3],目前《中华人民共和国药典》2015版(一部)中杜仲项下仅对松脂醇二葡萄糖苷进行测定,因此本研究随后选择杜仲中含量丰富且药理活性明确的松脂醇二葡萄糖苷、松脂醇单葡萄糖苷、丁香脂素二葡萄糖苷、桃叶珊瑚苷、京尼平苷、京尼平苷酸、车叶草苷共7种化合物进行含量测定。对杜仲中上述7种主要活性成分进行含量测定的方法学考察,确定含量测定方法,为综合评价杜仲的药用质量提供重要参考。
