表观扩散系数直方图对脑胶质瘤病理分级的相关性研究
2019-08-20王鹏张东友
王鹏,张东友
武汉市第一医院 放射科,湖北 武汉 430022
引言
2016 年WHO 中枢神经系统肿瘤分类指南[1]中提出:按肿瘤的侵袭性及恶性生物学行为,将胶质瘤分为Ⅰ~Ⅳ级;其中,Ⅰ+Ⅱ级胶质瘤预后较好,实施手术局灶切除,并辅以小范围的术后放化疗;而Ⅲ+Ⅳ级胶质瘤预后较差,一般手术切除范围较大,并接受长时间、大剂量的放化疗,且术后复发率高、并发症多。由此可见,术前准确评估胶质瘤的病理分级对患者治疗方案的制定及预后评估具有重要意义。近年来,有不少文献报道了磁共振扩散加权成像(Diffusion-Weighted Imaging,DWI)对脑胶质瘤病理分级的诊断价值。但因各文献报道的表观扩散系数(Apparent Diffusion Coefficient,ADC)诊断阈值不同,感兴趣区域的勾画方法也有差异,故研究结论不尽一致[2-6]。鉴于ADC直方图能够客观地反映全瘤灶的水分子扩散受限特征,在脑胶质瘤的鉴别诊断及预后评估等方面也有相关研究[7-8],笔者尝试利用ADC 直方图对脑胶质瘤病理分级进行评估,旨在探讨ADC 直方图对脑胶质瘤病理分级的应用价值。
1 资料与方法
1.1 临床资料
收集2013 年1 月至2018 年1 月期间收治的71 例脑胶质瘤患者的临床及影像学资料进行回顾性分析。纳入标准:①接受磁共振检查前未行手术、放化疗等胶质瘤相关性治疗;② 手术后病理证实为脑胶质瘤;③ 磁共振扫描与手术时间不超出2 周。排除标准:① 患者临床、影像资料不齐全或质量不合格;② 病灶内存在显著钙化灶。根据本研究设定的入组标准严格筛选后(图1),最终收集到49 例脑胶质瘤患者,男性26 例、女性23 例;年龄21~69 岁,中位年龄47 岁;胶质瘤短径范围为1.3~5.9 cm,平均值为3.1 cm;术后病理标本参照2016 年WHO 中枢神经系统肿瘤分类标准[1]分为:低级别(Ⅰ~Ⅱ级,16 例)、高级别(Ⅲ~Ⅳ级,33 例)。
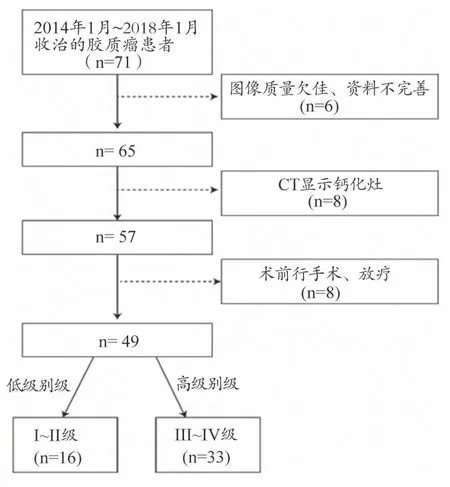
图1 病例入组流程图
1.2 磁共振扫描技术
使用GE 公司Signa 3.0T 超导磁共振成像设备,8 通道相控阵头部线圈,患者仰卧位。扫描序列包括:T1Flair、T2Flair、T2FSE、增强扫描序列和DWI 序列。常规扫描参数:层厚6 mm,层间距2 mm,矩阵512×512,视野(FOV)240.00 mm;T1Flair 序列TE/TR:21 ms/2229 ms;T2Flair 序列TE/TR:170 ms/8602 ms;T2FSE 序列TE/TR:118 ms/3460 ms。DWI 序 列TE/TR:74 ms/6000 ms,矩 阵256×256,b 值取0 和1000 s/mm2。
1.3 图像及数据处理
将后处理工作站自动生成的ADC 图全部导出至软件Image J,参照金观桥等[9]报道的方法,沿瘤灶边缘逐层勾画ROI,并覆盖整个瘤灶所有层,得到ADC 体素直方图。以ADC 直方图的X 轴表示ADC 值,Y 轴表示瘤灶的总像素频数百分比;记录ADC 直方图各定量参数,包括最大值、最小值、平均值、中位数、偏度值及峰度值。以上操作分别由两名具有10 年以上工作经验的影像科医师独立进行,结果取平均值。
1.4 统计学分析
采用SPSS 19.0 进行统计学分析,使用Shapiro-Wilk法对ADC 直方图各参数值进行正态性分布检验。对符合正态分布的参数值以表示;符合偏态分布的参数值则以Q(P25~P75)表示。通过受试者工作曲线(Receiver Operating Curve,ROC)评估ADC 直方图各参数值对不同级别脑胶质瘤的鉴别诊断效能,并计算出各参数值的曲线下面积(Area Under Curve,AUC)、最佳诊断阈值(Optimal Diagnostic Threshold)、Youden 指数以及相应的敏感度(Sensitivity,SE)、特异度(Specificity,SP)。P<0.05 表示差异具有统计学意义(双尾)。
2 结果
2.1 不同级别脑胶质瘤的ADC直方图各参数比较
不同级别脑胶质瘤的DWI、ADC 图以及ADC 直方图分别见图2~3。低级别胶质瘤ADC 直方图的最小值、平均值、中位数均高于高级别胶质瘤,且以负偏态分布为主(均P<0.05)。两组的峰值无统计学差异(均)。详见表1。
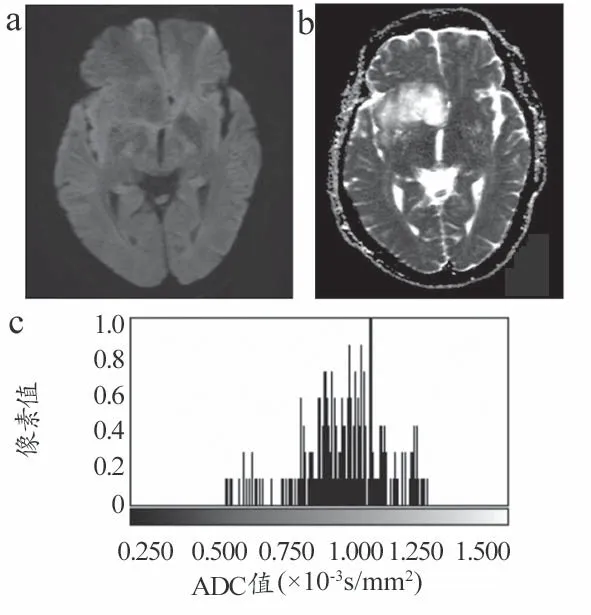
图2 病理结果示胶质瘤Ⅱ级图像(男,41岁)
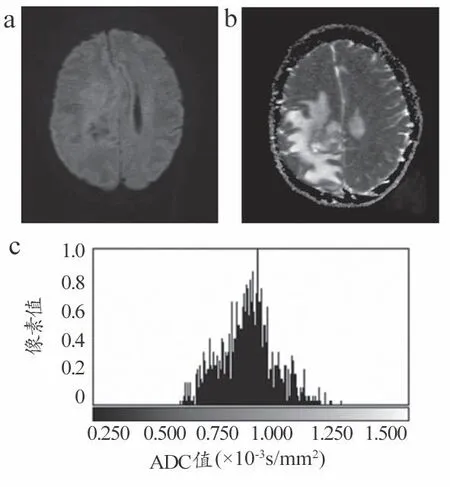
图3 病理结果示胶质瘤Ⅲ级图像(男,55岁)
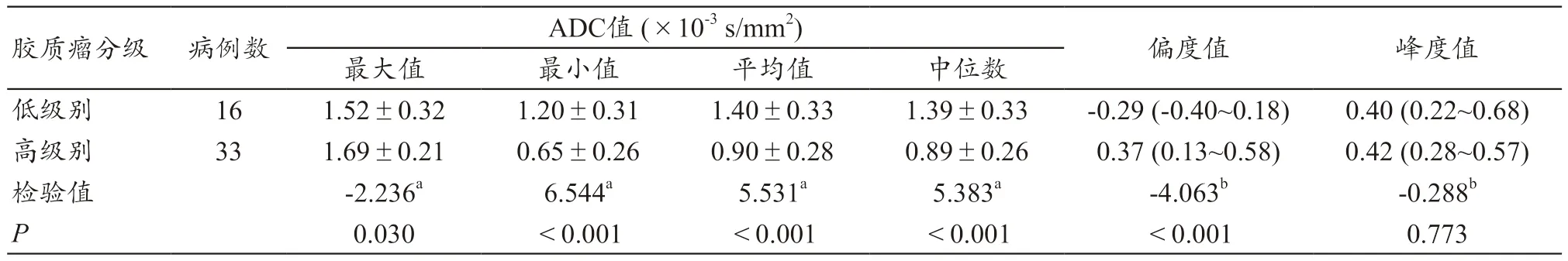
表1 低、高级别胶质瘤ADC直方图各参数比较
2.2 ADC直方图各参数对不同级别胶质瘤的诊断效能分析
ADC 直方图各参数值在胶质瘤分级评估中,以最小值的诊断效能最高,以0.8×10-3s/mm2作为最佳诊断阈值时,其曲线下面积为0.920,对应的Youden 指数以及敏感度、特异度分别为0.754 和87.88%、87.50%。详见图4、表2。
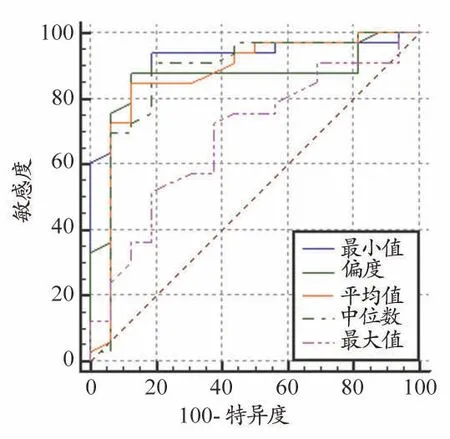
图4 ADC直方图各参数值对不同级别胶质瘤诊断效能的ROC曲线分析
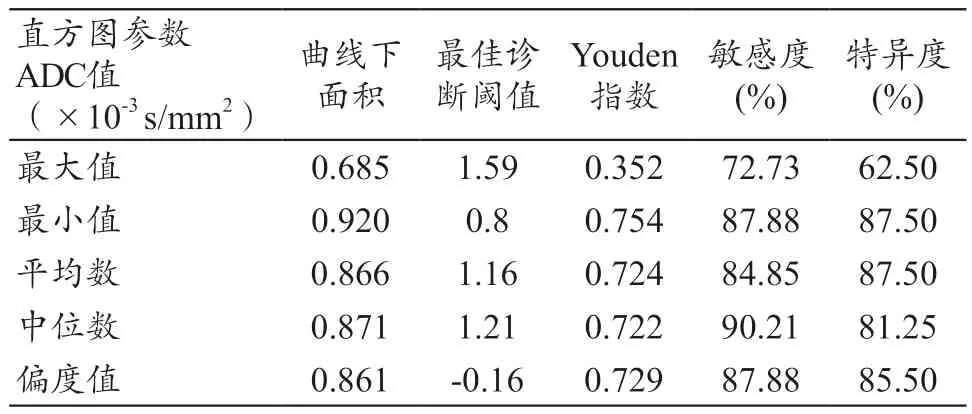
表2 ADC直方图对低、高级别胶质瘤的鉴别诊断效能
3 讨论
3.1 DWI对恶性肿瘤分级的应用价值
DWI 的优势在于能够监测活体水分子的扩散运动情况,并通过ADC 值对其扩散受限程度进行定量分析。活体水分子的扩散状况主要取决于水分子所处的微环境变化,包括细胞间致密性、各种大分子物质的渗出或核质比的改变等;活体病理状态下致使水分子微环境发生改变时,水分子的扩散特性也随之发生相应改变;当肿瘤进展至病理级别较高时,癌细胞的排列更加致密、核质比更高,导致水分子扩散受限更加显著,表现为ADC 值的降低[2-8]。近年来陆续有文献报道指出,ADC 值对直肠癌[10]、乳腺癌[11]、前列腺癌[12]、肾癌[13]以及脑胶质瘤[2-6]等恶性肿瘤的病理分级具有很大相关性,往往表现为随着肿瘤病理级别的上升或分化程度的下降,ADC 值呈降低的趋势。
3.2 ADC直方图在肿瘤影像学诊断的应用价值
恶性肿瘤在侵袭进展过程中,具有较大的生物学异质性,而这种异质性造成了肿瘤病理成分的不均匀,且随着肿瘤病理级别越高、分化越差,肿瘤的异质性越大;由此可见,在肿瘤组织ADC 值的测量时,单层面的ROI 往往具有较大的片面性,易存在选择偏倚,其测量数值难以代表整个瘤体组织的水分子扩散受限特性。
ADC 直方图的优势在于,能够通过对整个瘤灶进行全容积、全体素分析,能够反映瘤灶整体的水分子扩散特征,且重复性强、具有较大的客观性[7-8,14-15]。ADC 直方图分析在直肠癌[14]、前列腺癌[15]等恶性肿瘤的病理分级中具有较高的诊断价值,在脑胶质瘤的鉴别诊断及预后评估等方面也有相关研究[7-8],但ADC 直方图应用于脑胶质瘤的病理分级却鲜有文献报道。
本研究结果显示:① 低级别胶质瘤ADC 直方图的最小值、平均值、中位数均高于高级别胶质瘤,原因在于随着肿瘤级别的升高,细胞排列致密性更大、核质比更高,造成水分子受限更加明显;② 低级别胶质瘤ADC 直方图的最大值低于高级别胶质瘤。原因在于,ADC 最大值是对囊变、坏死区域的反映,高级别胶质瘤的囊变、坏死率显著高于低级别胶质瘤,故而两者ADC 最大值亦存在统计学差异[7-8,16];③ 低级别胶质瘤ADC 直方图以负偏态分布为主,而高级别胶质瘤则以正偏态分布为主,且高级别胶质瘤偏度系数的绝对值高于低级别胶质瘤。这表明高级别胶质瘤与低级别胶质瘤比较,有更多体素的ADC 值低于平均值,进一步验证了高级别胶质瘤细胞致密性更高,造成了水分子扩散受限较低级别胶质瘤更显著,导致ADC 体素值在ADC 直方图中多集中接近于曲线左侧。高级别胶质瘤偏度系数的绝对值更大,说明高级别胶质瘤体素ADC 值变异性更大,这可能是由于高级别胶质瘤异质性更高,病理成分更加复杂,造成了ADC 值的多样性[7-8,16]。
在进一步的诊断效能分析中,ADC 最小值鉴别高、低级别胶质瘤的诊断效能更高,而最大值的诊断效能最低。笔者综合既往文献[14-16],分析其原因可能是:ADC 最小值是对水分子扩散受限最显著区域的反映,由于本研究排除了合并钙化灶的病例,因此ADC 最小值反映的是肿瘤细胞聚集区,排除了其他病理成分的干扰,故而其诊断效能最高。而ADC 最大值的鉴别诊断效能最低,这可能是由于恶性程度较高的胶质瘤易发生坏死囊变,而坏死和囊变区的ADC扩散受限不明显,导致恶性胶质瘤与低级别胶质瘤的ADC最大值相近,从而造成了其特异度不高,诊断效能欠缺。
3.3 本研究局限性
本研究属于单中心回顾性研究,可能存在一定程度上的选择偏倚。此外,本研究病例数有限,有待进一步扩充样本量,以获取更丰富的研究成果。
