猪德尔塔病毒H223 株的分离鉴定和持续传代及N 基因遗传进化分析
2019-08-20贺东生李锦辉苏丹萍司广斌
贺东生,李锦辉,苏丹萍,司广斌,李 根
(华南农业大学兽医学院,广东 广州 510642)
猪德尔塔病毒,又名猪丁型冠 状 病 毒、δ 冠 状 病 毒(Porcine Deltacoronavirus,PDCoV), 是近年来新出现的一种猪肠道冠状病毒。猪丁型冠状病毒属于套式病 毒 目(Nidovirales)、 冠 状 病 毒科(Coronaviridae)、 冠 状 病 毒 属(Coronaviras) 的新成员,为不分节段的单股正链RNA 病毒,基因组全长约25.4 kb,基因组结构为5'UTR-ORF1a-ORF1b-S-E-M-NS6-NNS7-3' UTR[1,2]。
猪丁型冠状病毒引起的临床症状与猪传染性胃肠炎和猪流行性腹泻相似[3,4],很难通过临床等手段鉴别诊断[5]。发病猪主要表现为呕吐、腹泻、脱水、嗜睡等特征[6]。PDCoV 发病后会因年龄差异而有不同的症状[7],新生仔猪往往表现为严重腹泻,且由于大量脱水而死亡迅速[8],成年猪则不甚相同,无症状或症状较轻[9],不易死亡,母猪感染PDCoV 的临床症状为腹泻和厌食。
PDCoV 的病变主要集中在在小肠和胃[10]。发病仔猪剖检可见小肠肠管扩张,肠壁透亮明显可见肠内水样内容物,并且含有泡沫或是未消化的凝乳块,尤其是空肠和回肠发生严重性的萎缩性肠炎,肠系膜明显可见出血的淋巴结和扩张的血管。显微镜下可以观察到炎性细胞浸润,肠黏膜绒毛严重萎缩。胃部出现明显膨胀,胃底膜内有轻度出血发红的现象[11]。
猪丁型冠状病毒最早在2012 年被香港学者报道出来,2014 年在美国俄亥俄州大范围暴发,之后很快传播到美国的其他地区。目前为止,美国、加拿大、韩国、中国大陆、泰国和老挝等国家均已经检测和报道了PDCoV[2,12-14]。如今该病毒已经给世界上的养猪大国造成了严重的经济损失。
我们在2015 年率先报道了本病在规模猪场暴发,但未能成功分离到病毒[5]。本研究从江西某疑似病毒性腹泻猪场的发病仔猪小肠内容物中获取病料,通过在ST 细胞系上连续盲传,成功分离到猪丁型冠状病毒,并对该分离株的N 基因进行遗传进化分析,报道如下。
1 材料与方法
1.1 病毒及细胞系
病料来源于江西省某病毒性腹泻猪场哺乳仔猪小肠内容物,ST 传代细胞系由华南农业大学兽医学院传染病教研室保存。
1.2 试剂与仪器
胰 蛋 白 酶、DMEM 营 养液、 胎 牛 血 清 购 自Gibco 公司;One step RT-PCR 试 剂 盒、DNA Marker-1000 购自Takara 公司;细胞培养箱购自赛默飞公司,倒置显微镜(尼康)。
1.3 引物的设计及合成
根 据Genbank 中 登 录 的PDCoV 参考毒株全基因序列,利用Primers 5.0 软件合成1 对针对N 基因的特异性引物,引物序列引物由华大生物技术有限公司合成。
1.4 病毒RNA 的提取
将小肠内容物与PBS 以1:3的比例稀释,充分震荡后反复冻融3 次,6 000 r/min 离心10 min,按试剂盒说明书提取上清液中,将病毒总RNA 置于-80 ℃保存备用。
1.5 病毒的PCR 检测
以病毒总RNA 为模板进行PCR 扩增,反应体系为:Onestep RT-PCR buffer 10 μL,上下游引物 各0.5 μL , RNA 模 板3 μL, 灭菌 的DEPC 水5.6 UL。PCR 扩 增程序为:50 ℃ 30 min;94 ℃预变性5 min;95 ℃变性1 min;53 ℃复性30 S;72 ℃延伸1 min,45 个循环;72 ℃延伸10 min。取10 μL PCR 扩增产物经琼脂糖凝胶电泳检侧,用凝胶成像系统对电泳结果进行分析。
1.6 病毒的分离
取PCR 检测结果呈阳性的病料样品,在12 000 g 下离心8 min,取上清液用0.22 μm 无菌过滤器过滤除菌,以获得接种细胞的无菌病毒液。将ST细胞铺满整个6孔细胞培养板,待单层细胞融合至90%~95%时弃去培养液,用PBS 清洗3 遍,将处理好的病毒液以600 μL/孔接种5孔,另1 孔接种DMEM 培养液作为阴性对照,置于37 ℃培养箱孵育1 h 后取出培养板,弃去液体,每孔中加入2 mL 的含有胰酶的维持液,然后将培养板置于培养箱中继续培养3 d,收获病毒培养物,反复冻融3 次,继续进行下一代盲传,直至出现稳定的CPE。
1.7 N 基因的克隆测序
将阳性PCR 产物经纯化回收后与PMD-19T 载体连接,转化到DH5a 感受态细胞中,培养后挑单个菌落进行PCR 鉴定,鉴定成功的重组质粒送往华大基因生物技术有限公司进行测序。
1.8 N 基因的遗传进化分析
根据GeneBank 上已公布的10株PDCoV 参考毒株(表1),利用DNA Star 和MEGA7 软件对N 基因的测序结果进行处理和遗传进化分析,并绘制遗传进化树。
2 结果与分析
2.1 病料PCR 检测结果
以 提 取 的RNA 为 模 板, 用PDCoV 的N 基因引物对样品进行检侧。结果所示(见图1),PDCoV 在1 248 bp 左右有明显条带,检侧结果为阳性。由此说明该病毒为PDCoV。将PDCoV PCR 产物纯化后构建至pMD-19T 质粒并进行测序,成功克隆了该病毒的目标序列,并获得N基因序列,序列长度为1 248 bp。
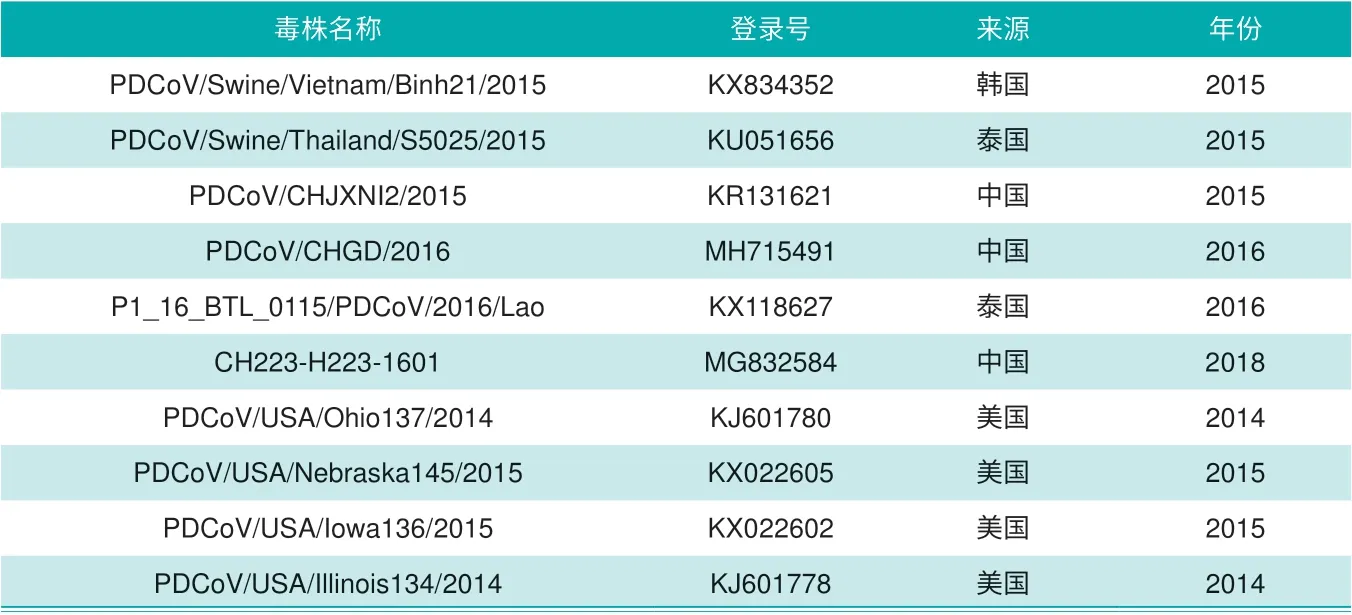
表1 GeneBank 已登录的PDCoV 参考毒株
2.2 PDCoV H223 株的分离
病毒接种单层ST 细胞盲传后,在20 h 时后开始出现病变,细胞变圆、细胞核浓缩、病变细胞呈拉丝细状态并大量死亡,死亡细胞悬浮于培养液中(图2A),对照组细胞生长良好(图2B)。36 h 后,细胞的CPE 达80%以上,对照组仍存在致密的单层细胞,只有少量的细胞漂浮在液面。该病毒在ST 细胞系上能够稳定增殖。
在感染ST 细胞后72 h 收毒,每代次的病毒收获物均进行PCR 检测结果均为阳性。随着传代次数的增加,出现CPE 的时间缩短且程度随之加剧。病毒传代每隔5 代都进行N 基因核苷酸测序,已确保分离的是PDCoV,目前已传至第65 代,确定成功分离了一株猪丁型冠状病毒,命名为PDCoV H223 株。

图1 PDCoV H223 株的N 基因PCR 扩增结果图
2.3 PDCoV H223 株N 基因的同源性分析
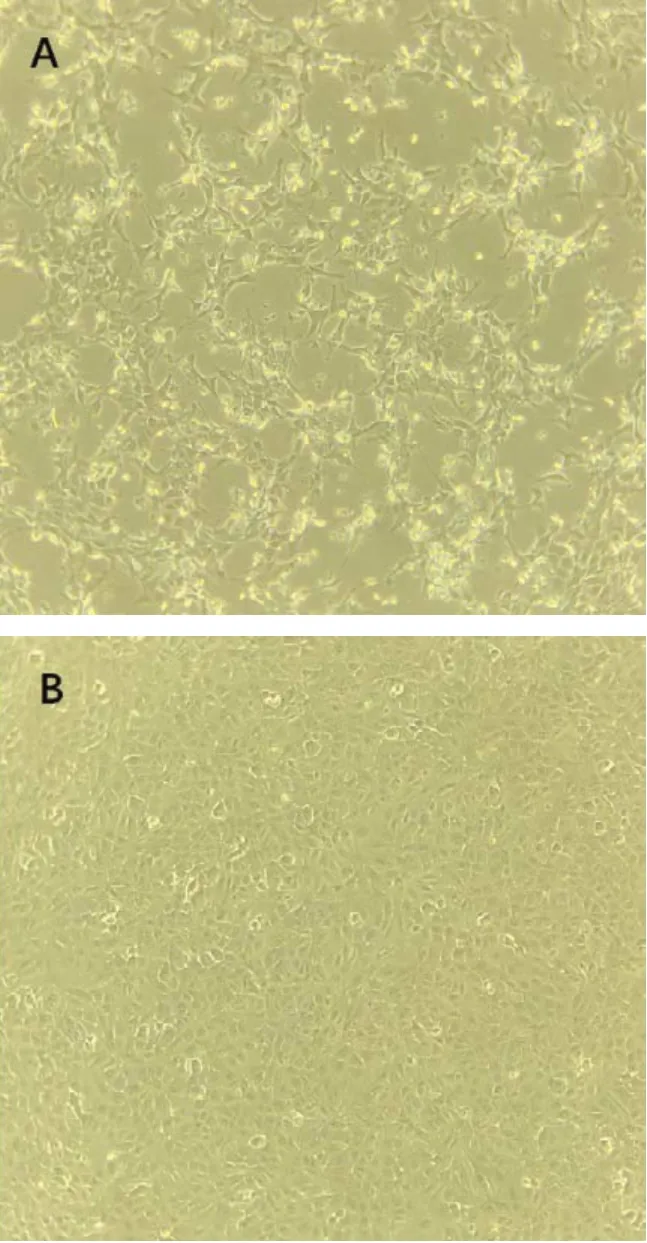
图2 PDCoV H223 株接种ST 细胞的细胞病变图

图3 PDCoV H223 株N 基因的序列同源性分析

图4 PDCoV 223 毒株N 基因的遗传进化树
以GenBank 中已发表的10株PDCoV 毒株为参考(表1),用DNA Star 软件进行PDCoV N 基因序列同源性分析(图3)。结果显示,H223 株N 基因序列与已公布的10株PDCoV N 基因序列的同源性为97.2%~99.3%,与中国广东毒株的同源性最高,与越南毒株的同源性最低。
2.4 PDCoV H223 株N 基因的遗传进化分析
以表1 中的10 株PDCoV 参考毒株为参考,运用MEGA7.0 软件采用Neigh-bor-Joining 聚类分析方法构建基于N 基因序列的遗传进化树(图4)。结果显示,H223 毒株与广东毒株PDCoVCHGD2016 毒株处于同一分支,与越南、美国等其他国家的亲缘关系较远。本次鉴定毒株为猪丁型冠状病毒病毒(PDCoV),命名为H223。
3 讨论
猪丁型冠状病毒自2014 年美国首次在俄亥俄州被检测到并且成功分离到此病毒以来,该病毒的暴发和流行呈现全球性趋势[2]。近年来我国养猪业发展较快,但总体水平不高,据调查,腹泻引起的仔猪死亡数占仔猪总死亡数的半数以上,其中引发仔猪高发病率、高死亡率的主要的病原是猪腹泻病毒。猪腹泻病毒主要有3 种,TGEV、PEDV和PDCoV,近几年主要的病原为PEDV 和PDCoV, 其 中PEDV 在临床上有灭活疫苗或部分活疫苗用于防治,而PDCoV 由于发现较晚,病毒分离非常困难,对其研究难以深入,目前尚无有效的防控措施,且由于感染PDCoV 的动物临床症状与感染PEDV,TGEV 的动物临床症状相似,PDCoV 常与PDEV 等发生混合感染,导致确诊困难,使得PDCoV 成为现在影响养猪业发展的一大难题。
猪丁型冠状病毒严重影响着养猪业的健康发展,迫切需要进一步加强其生物学特性以及致病性研究,提供防控预案,缓解由猪丁型冠状病毒给养猪产业带来的的经济损失。本研究成功分离了一株猪丁型冠状病毒,并命名为H223,对该分离株高和低代次的N 基因进行了测序和遗传进化分析,分析结果表明该病毒的遗传稳定性很高。该病毒目前已传至第65 代,且能出现稳定的病变,有较高的病毒滴度,有望对新疫苗的研制提供帮助。
