增强玉米幼苗抗干旱能力内生真菌的筛选
2019-08-16李超李丽莉卢增斌孙艺昕宋莹莹李喆门兴元
李超 李丽莉 卢增斌 孙艺昕 宋莹莹 李喆 门兴元
摘要:室内盆栽条件下,将从玉米及小麦组织中分离的20种内生真菌接种玉米幼苗,采用8% PEG-6000模拟干旱胁迫,比较正常浇水及干旱胁迫下玉米幼苗的生长差异。结果显示,接种玉米来源的Cladosporium、Chaetomium、Beauveria对玉米幼苗的促生作用均优于Epicoccum、Alternaria,其中,LW29(Cladosporium sp.)、JN16(Cladosporium sp.)、NY15 (Chaetomium sp.)及YC1(Beauveria sp.)4个菌株对玉米幼苗的促生作用明显,可增强玉米幼苗的抗干旱能力。小麦来源的木霉菌JN-MY1(Trichoderma sp.)对玉米幼苗有一定的促生作用,但效果不如NY15、LW29、YC1及JN16。
关键词:干旱胁迫;内生真菌;玉米幼苗;植株生长
中图分类号:S423+.4 文献标识号:A 文章编号:1001-4942(2019)06-0139-05
Abstract In this study, 20 species of endophytic fungi isolated from maize and wheat tissues were inoculated into maize seedlings in a pot experiment under well-watered and drought stress simulated with 8% PEG-6000 in greenhouse. The differences in plant growth were analyzed. The results showed that the growth promoting effect of Cladosporium, Chaetomium and Beauveria from maize tissues on maize seedlings were superior to that of Epicoccum and Alternaria. LW29 (Cladosporium sp.), JN16 (Cladosporium sp.), NY15 (Chaetomium sp.) and YC1 (Beauveria sp.) promoted the growth of maize seedlings obviously both under well-water and drought stress conditions enhancing the drought resistance of maize seedlings. JN-MY1 (Trichoderma sp.), a wheat-based Trichoderma, also exhibited growth-promoting effects on maize seedlings, but less than those of NY15, LW29, YC1 and JN16.
Keywords Drought stress; Endophytic fungi; Maize seedlings; Plant growth
自然界中的大部分植物都被证实有内生菌寄生,这些内生菌能促进植物的生长及组织分化,同时增强植物抵御一系列生物及非生物胁迫,但不引起植物的损伤[1]。内生真菌在植物体内种类相对丰富,分布较为广泛的是半壳霉属、拟隐孢霉属、拟茎点霉属及叶点霉属的种类[2,3]。内生真菌是植物组织与植物共生真菌的主要组成部分,存在于植物的根、茎、叶等多种组织中,其可以增强植物对生物及非生物胁迫的适应性,如有效防治植物病虫害[4],促进植物生长[5]、提高植物抗逆性[6,7]。
干旱脅迫是限制作物生长的主要因素之一,对作物的代谢及产量影响严重。内生真菌可以促使宿主植物在严峻的环境中生存,与植物互作后,可增强植物对非生物胁迫的耐受性,尤其是抗干旱胁迫。研究表明,内生真菌可以通过影响植物的形态发育以及对胁迫的生理生化反应,从而诱导宿主的抗旱性[8]。接种哈茨木霉Trichoderma harzianum(T35)的水稻增强了对干旱胁迫的耐受性,其体内抗氧化酶、超氧化物歧化酶、过氧化氢酶及抗坏血酸过氧化物酶的活性增强[9]。内生真菌还可以通过产生植物生长素,同时抑制钠离子的吸收或阻止其迁移来增强植物应对干旱胁迫的能力[10]。在盐、干旱胁迫下,内生真菌通过促进植物对钾、钙等养分的吸收,促进养分平衡,从而增加了寄主植物的耐受性[11]。
玉米作为我国种植面积最广、产量最高的农作物,在保障国家粮食安全中占有举足轻重的地位[12]。干旱是影响玉米产量的主要因素之一,尤其对幼苗阶段的影响较为严重,会使幼苗生长缓慢、成活率低,造成不同程度的减产,严重时可导致绝产[13]。先前的研究多集中在玉米抗旱机理及抗旱品种的选育上,内生真菌的利用为提高玉米抗旱性提供了新思路。本研究选取从玉米及小麦组织中分离的20种内生真菌接种玉米幼苗,采用8% PEG-6000模拟干旱胁迫[14],分析正常浇水及干旱胁迫下玉米幼苗的生长差异,以期筛选出能提高玉米抗旱能力的内生真菌,为内生真菌在农业生产中的进一步开发利用提供重要的微生物资源。
1 材料与方法
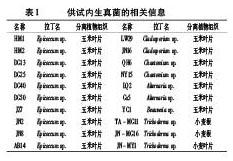
1.1 内生真菌来源
供试内生真菌分离自玉米叶片、小麦根及叶片,共20株菌株,具体名称及来源详见表1。挑取适量菌株接种于9 cm平板的PDA培养基中,25℃培养7 d。待菌丝铺满培养基,选取直径1 cm的菌落接种至100 mL的PDA液体培养基中,25℃,100 r/min培养7 d。
1.2 供试植物及基质
供试玉米品种为郑单958。培养基质选用混合土壤(营养土∶ 蛭石=1∶ 1),高温灭菌备用。
1.3 试验方法
选取大小一致、饱满的玉米种子用70%乙醇浸泡30 s,之后用3%次氯酸钠进行表面消毒3 min,无菌水冲洗3遍,然后将表面消毒后的种子放入培养后的菌液中浸种12 h。将灭菌后的混合土壤按照4∶ 1的比例加入自来水,混匀后装入营养钵(15 cm高×12 cm直径)。
盆栽试验分为正常浇水(每隔1 d浇水20 mL)及干旱模拟两组(每隔1 d浇8%PEG-6000溶液20 mL),每组设置接种20株内生真菌及未接菌对照共21个处理,重复3次,每盆播种3粒浸泡处理后的玉米种子。在27℃、光周期16L/8D、相对湿度50%的温室内进行培养,播种后4 d,记录玉米出苗情况,10 d后,测定不同处理玉米植株的株高、根长及地上部鲜重。
1.4 数据处理及分析
采用单因素方差分析(One-way ANOVA)检验不同处理下根长、株高及地上生物量的显著性差异,并用LSD法进行多重比较。数据分析采用统计软件SPSS 16.0进行处理。
2 结果与分析
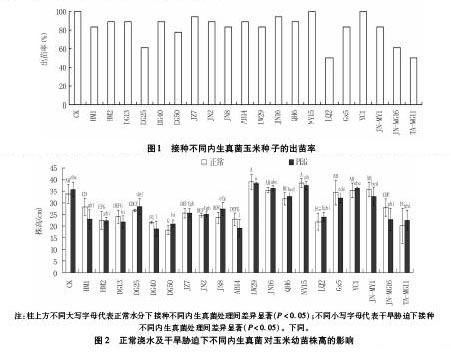
2.1 不同内生真菌对玉米种子出苗率的影响
由图1看出,接种不同的内生真菌对玉米出苗率有显著影响。大部分处理玉米的出苗率在80%以上,其中,接种NY15、YC1的出苗率最高,均达到100%,接种JZ7及JN16的出苗率也均超过90%。接种DG50、DG25、JN-MG16、LQ2 及TA-MG11的出苗率在80%以下,其中JN-MG16及TA-MG11为小麦来源的两种内生真菌,接种LQ2 及TA-MG11的出苗率最低,均为50%。
2.2 不同内生真菌对玉米幼苗株高的影响
正常浇水及干旱胁迫处理下,接种不同内生真菌对玉米幼苗株高有显著影响(图2)。正常浇水下,接种LW29、NY15、JN-MY1、JN16、YC1及Gx5的玉米幼苗株高均高于未接菌对照;干旱胁迫下,接种LW29、NY15、JN16及YC1的玉米幼苗株高高于未接菌对照,而接种JN-MY1及Gx5内生真菌的玉米幼苗株高则略低于未接菌对照。其它菌株接种下的玉米幼苗在正常浇水及干旱胁迫条件下的株高均低于未接菌对照。
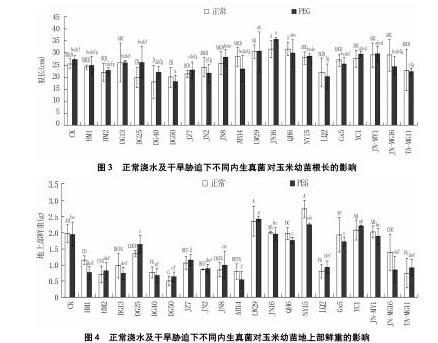
2.3 不同内生真菌对玉米根长的影响
正常浇水情况下,大部分菌株有利于玉米根的延长,其中包括小麦来源的两株木霉菌(Trichoderma spp.)JN-MG16及JN-MY1(图3)。干旱胁迫下,仅接种JN16、LW29、QH6、JN-MY1、YC1、NY15及JN8内生真菌的玉米幼苗根长大于未接菌对照。接种HM1、JN2、TA-MG11、HM2、LQ2、JZ7、DG50、DG25及DG40内生真菌的玉米幼苗根长在正常浇水及干旱胁迫下均短于未接菌对照。
2.4 不同内生真菌对玉米地上部鲜重的影响
由图4看出,接种不同内生真菌的玉米幼苗地上部鲜重有显著差异。接种NY15、LW29、YC1及JN16内生真菌的玉米幼苗在正常浇水及干旱胁迫条件下,其地上部鲜重均高于未接菌对照。而接种JN-MY1内生真菌的玉米幼苗地上部鲜重仅在正常浇水下高于未接菌对照,在干旱胁迫下则差异不显著。除接种Gx5、QH6菌株的玉米幼苗低于对照但差异不显著,接种其它内生真菌的玉米幼苗地上部鲜重在正常浇水及干旱胁迫下均显著低于未接菌对照。
3 讨论与结论
干旱作为一种非生物胁迫,对农作物的生长发育及产量具有不利的影响。内生真菌作为一种植物体内的共生体,在促进植物生长、增强植物抗病虫及抗逆境能力等方面具有重要作用[15]。本研究发现,接种不同种类内生真菌的玉米幼苗在正常及干旱胁迫下的生长发育存在一定差异,不同来源的同一属相同或近缘种类的内生真菌对玉米幼苗的生长发育也有不同的影响。这表明不同生态型内生真菌对植物具有不同的影响,这与真菌自身的特性有关。分离自兰科植物的5株内生真菌Fusarium,其中的1株具有合成赤霉素的相关基因ggs2和cps/ks,可以促进植物生长[16]。接种来源于盐渍土及非盐渍土的两株丛枝菌根真菌Glomus mosseae M1和M2对棉花在盐胁迫环境下的生长状况具有不同的促进作用[17]。同时,可以看到PEG模拟干旱处理下可以部分地促进玉米幼苗的生长,这有可能是植物在应对低渗胁迫时的一种应激反应[18]。
总体上,接种玉米来源的内生真菌对玉米种子的出苗率没有明显影响,但LQ2 (Alternaria sp.)除外,这有可能是LQ2在玉米生长发育的早期以内生菌的方式与玉米共生,而在玉米生长发育到一定阶段,又以病原菌的方式来为害植物[19]。然而,小麦组织来源的3株内生真菌接种玉米种子后,其中的两株JN-MG16及TA-MG11显著降低了玉米的出苗率,分析其原因可能是植物内生菌对不同宿主的亲和能力不一样,有些对宿主的选择存在一定的专一性[20]。
在正常浇水及干旱胁迫下,接种Cladosporium、Chaetomium、Beauveria菌属的内生真菌对玉米幼苗的促生作用均优于其它菌属的内生真菌,表明这3种菌属来源的内生菌在增强玉米幼苗抗旱性方面具有很大的开发潜力。这同前人的研究相似,接種Chaetomium sp. AS1221及Penicillium sp. AS1618对促进玉米幼苗的抗旱性要优于Alternaria sp. AS1113和Colletotrichum sp. AS1716[21]。作为玉米的主要内生真菌,Alternaria被发现会增强玉米对病原菌的抗性,同时能产生纤维素酶等相关酶类,降解玉米秸秆[22]。添加Alternaria提取物的SRD可以不同程度地促进干旱胁迫下玉米种子萌芽期的生长,从而提高玉米的抗旱能力[23]。我们之前的研究发现Gx5(Alternaria sp.)在正常浇水环境下,可以促进玉米的生长,并对玉米蚜有较高的防效。在本次研究中,也发现正常浇水环境下,Gx5对玉米幼苗的生长有一定的促进作用,然而,在干旱胁迫下,其促生长作用并不显著,对于其对玉米幼苗在不同环境下的生长发育影响尚需进一步研究。木霉菌Trichoderma可以通过增加植物体内次生代谢物质以及脯氨酸的含量来增强植物的抗旱能力[24],本研究中小麦来源的木霉菌JN-MY1对玉米幼苗有一定的促生作用,但不如NY15、LW29、YC1及JN16的促生作用明显。
综合正常浇水及干旱胁迫下玉米生长的各个指标,玉米内生真菌NY15、LW29、YC1及JN16对玉米幼苗的促生作用明显,可增强玉米幼苗的抗干旱能力,具有较大的开发潜力。后续将在内生真菌培养条件的优化、接种方式的选择及同玉米的互作机制方面进行进一步探索。
参 考 文 献:
[1] Saikkonen K, Faeth S H, Helander M, et al. Fungal endophytes: a continuum of interactions with host plants[J].Annual Review of Ecology and Systematics, 1998, 29 (1): 319-343.
[2] Jacobson D J, Lefebvre S M, Ojerio R S, et al. Persistent, systemic, asymptomatic infections of Albugo candida, an oomycete parasite, detected in three wild crucifer species[J]. Canadian Journal of Botany, 1998, 76 (5): 739-750.
[3] Duckett J G, Russell J,Ligrone R. Basidiomycetous endophytes in jungerman-nialean (leafy) liverworts have novel cytology and species-specific host ranges: a cytological and experimental study[J]. Canadian Journal of Botany, 2006, 84 (7): 1075-1093.
[4] Nettles R, Watkins J, Ricks K, et al. Influence of pesticide seed treatments on rhizosphere fungal and bacterial communities and leaf fungal endophyte communities in maize and soybean[J]. Applied Soil Ecology, 2016, 102: 61-69.
[5] 王娜, 杨镇, 曹君, 等. 植物内生菌提取物对水稻生长发育的影响[J].吉林農业大学学报,2014,36(1): 10-16.
[6] Hubbard M, Germida J J, Vujanovic V. Fungal endophytes enhance wheat and drought tolerance in terms of grain yield and second-generation seed viability[J]. Journal of Applied Microbiology, 2014, 116 (1): 109-122.
[7] Azad K, Kaminskyj S. A fungal endophyte strategy for mitigating the effect of salt and drought stress on plant growth[J]. Symbiosis,2016, 68 (1/2/3): 73-78.
[8] Malinowski D P, Belesky D P. Adaptations of endophyte-infected cool-season grasses to environmental stresses: mechanisms of drought and mineral stress tolerance[J]. Crop Science, 2000, 40 (4): 923-940.
[9] Gusain Y S, Singh U S, Sharma A K. Enhance activity of stress related enzymes in rice (Oryza sativa L.) induced by plant growth promoting fungi under drought stress[J]. African Journal of Agricultural Research, 2014, 9: 1430-1434.
[10] Rai M, Rathod D, Agarka, G, et al. Fungal growth promoter endophytes: a pragmatic approach towards sustainable food and agriculture[J]. Symbiosis, 2014, 62 (2): 63-79.
[11] Mei C, Flinn B S. The use of beneficial microbial endophytes for plant biomass and stress tolerance improvement[J]. Recent Patents Biotechnol.,2010, 4 (1): 81-95.
[12] 翁凌云. 我国玉米生产现状及发展对策分析[J]. 中国食品与营养, 2010(1): 22-25.
[13] 范翠丽, 陈景堂. 玉米苗期及萌芽期抗旱性评定方法筛选[J]. 玉米科学, 2007, 15(3): 114-117.
[14] Seema N, Hamayun M, Hussain A, et al. Endophytic fungi promote growth of Zea mays L. under PEG induced drought stress[J]. Journal of Applied Environmental and Biological Sciences, 2018, 8 (3): 95-101.
[15] Stone J K, Bacon C W, White J F,et al. An overview of endophytic microbes: endophytism defined[M]// Bacon C W, White J F (Eds.). Microbial Endophytes. Marcel Dekker, Inc., N Y, 2000.
[16] Eleena A T, Christiane B, Alexander I N, et al. Production of gibberellic acids by an orchid-associated Fusarium proliferatum strain[J]. Fungal Genetics and Biology, 2008, 45 (10): 1393-1403.
[17] 冯固, 白灯莎, 杨茂秋, 等. 不同生态型摩西球囊霉菌株对棉花耐盐性的影响[J]. 生态学报, 2001,21(2): 259-264.
[18] 姚彩艷, 汪晓丽, 盛海军, 等. NaCl和PEG胁迫对玉米幼苗根系生长的影响[J].扬州大学学报 (农业与生命科学版), 2007,28(4): 42-46.
[19] Koide K, Osono T, Takeda H. Colonization and lignin decomposition of Camellia japonica leaf litter by endophytic fungi[J]. Mycoscience, 2005, 46 (5): 280-286.
[20] 王坚, 刁治民, 徐广, 等. 植物内生菌的研究概况及其应用[J].青海草业, 2008(1): 24-28.
[21] 胡美玲, 郑勇, 孙翔, 等. 内生真菌促进玉米幼苗的抗旱性研究[J]. 菌物学报, 2017, 36 (11): 1556-1565.
[22] 张可可. 玉米内生链格孢多样性及其生态功能研究[D]. 郑州:郑州大学, 2017.
[23] 刘国丽, 王娜, 龚娜, 等. 干旱胁迫下植物内生菌提取物对玉米萌芽期抗旱性的影响[J]. 山东农业科学, 2015, 47 (10): 39-41.
[24] Alwhibi M S, Hashem A, Abd_Allah E F, et al. Increased resistance of drought by Trichoderma harzianum fungal treatment correlates with increased secondary metabolites and proline content[J]. Journal of Integrative Agriculture, 2017, 16 (8): 1751-1757.
