多花黄精植株再生及繁殖研究
2019-08-132
2
(1.福建农林大学园艺学院, 福州 350002;2.兰科植物保护与利用国家林业与草原局重点实验室, 福州 350002)
多花黄精(PolygonatumcyrtonemaHua)属于百合科( Liliaceae )黄精属(PolygonatumMill.)多年生草本药用植物[1-2]。分布在东北、华北、西北和华东等地,多花黄精集药用、观赏和食用价值于一体,根茎含淀粉、烟酸、黄酮、多种氨基酸、维生素、多种皂甙,具有益气养阴、强壮筋骨、治疗风湿痛、降血脂、降血压、降血糖、抗衰老及抗肿瘤等作用[3-7]。随着多花黄精药用价值的开发,野生资源被人为肆意挖掘破坏严重,使得有限的野生资源逐渐减少[8-9]。
由于多花黄精种子繁殖后代性状分化严重,不能通过播种大量繁殖苗木[10]。繁育培养既能实现植物个体的快速大量繁殖,又能较好地保持植物的种质特性[11],是实现多花黄精工厂化育苗,加快良种推广应用的关键技术。有关多花黄精的组培快繁技术已有不少研究[12-19],但主要集中在根茎繁殖[13],使用未成熟黄精荚果进行芽萌发诱导少见报道。为了建立一套高效、高质、快速的多花黄精工厂化育苗体系,本实验在前人对多花黄精组培快繁技术研究与生产实践的基础上,选取优质多花黄精母株上成熟度为70%的荚果为外植体进行繁育,研究不同激素、不同生长素配比、不同光照强度控制等因素对多花黄精种子芽萌发诱导、芽增殖诱导、瓶苗生根诱导及移栽的影响,建立了多花黄精植株再生体系。

图1 A为野生多花黄精植株,B为成熟度为70%荚果
1 材料与方法
1.1 材 料
试验材料采自福建泰宁大田乡垒际村夏家地海拔500 m的林下,选择长势良好黄精植株作为母株,取颗粒饱满、无病虫害、成熟度为70%的荚果,用湿纱布包裹带回实验室,置4 ℃冰箱中保存备用。
1.2 外植体处理
用洗衣粉清洗去除荚果表面尘埃,置于流水下冲洗干净,纯水冲荡2~3遍,置于超净工作台内用体积分数为75%酒精消毒30 s,用5%次氯酸钠消毒10~15 min并加入2~3滴吐温80,无菌水冲荡3~4遍后,用无菌滤纸吸干材料表面水分备用。
1.3 培养基与培养条件
基本培养基为MS,附加蔗糖 20 g·L-1、琼脂 7.0 g·L-1、活性炭 0.5 g·L-1,pH值为5.8,温度为(23±2)℃,初始接种的培养体在暗培养条件下5~10 d,然后移到光照强度为0~2 000 lx 递增培养,光照时间为每天10 h。
1.4 外植体选择
将无菌处理后的荚果,用无菌手术刀剥除外种皮,把剥除种皮后的种子接种到MS培养基上,附加蔗糖20 g·L-1、琼脂7.0 g·L-1、活性炭0.5 g·L-1,pH值为5.8,总计5个组,每组接10瓶,每瓶接入3粒种子,重复3次。在温度(23±2)℃下暗培养10 d。10 d后移到光照强度为0~2 000 lx下培养,光照时间为每天10 h。30 d后统计萌发率,用于研究不同成熟度对种子萌发的影响。
萌发率(%)=(每组萌发种子粒数/每组接种种子粒数)×100%。
1.5 诱导种子萌发
将无菌处理后的种子,用无菌手术刀剥除外种皮,把剥除种皮后的种子接种到MS基本培养基,附加蔗糖 20 g·L-1、琼脂 7.0 g·L-1、活性炭 0.5 g·L-1,pH值为5.8,然后将不同质量浓度的BA、NAA分组加入,总计15个组,每组接10瓶,每瓶接入3粒种子,重复3次。在温度(23±2)℃下暗培养10 d。10 d后移到光照强度为0~500 lx递增培养,光照时间为每天10 h。30 d后统计萌发率,研究不同质量浓度BA、NAA配比对多花黄精种子芽诱导萌发的影响。
诱导萌发率(%)=(萌发粒数/接种总粒数)×100%。
1.6 诱导芽增殖
当种子抽出茎叶并长出胚根时,切取茎段,将其转入MS基本培养基中进行增殖培养,附加蔗糖 20 g·L-1、琼脂 7.0 g·L-1、活性炭 0.5 g·L-1,pH值为5.8,然后将不同质量浓度的BA、KT、NAA分组加入(见表2),总计9组,每组接10瓶,重复3次,每瓶接入3个茎段。在温度(23±2)℃,光照强度从500~1 000 lx递增,光照时间为每天10 h。培养30 d(见图3)后统计各处理的诱导芽数和增殖率,从中筛选出最适宜多花黄精诱导芽增殖的培养基。
芽增殖率(%)=(每组增殖粒数/每组接种粒数)×100%。
1.7 诱导瓶苗生根
经诱导芽增殖培养后,选取长势健壮的植株,接种到1/2 MS基本培养基进行生根培养(见图4),附加蔗糖 20 g·L-1、琼脂 7.0 g·L-1、活性炭 0.5 g·L-1,pH值为5.8,然后将不同质量浓度的IBA和IAA分组加入(见表3),总计16组,每组接10瓶,重复3次,每瓶接入1棵植株,温度(23±2)℃,光照强度从1 000~2 000 lx递增,光照时间为每天10 h。培养40 d(见图3)后统计生根率和平均生根数,从中筛选出最适宜多花黄精诱导瓶苗生根的培养基。

图3 A为接种30 d,B为接种40 d

图2 去除荚果种皮接种于MS培养基
生根率(%)=(生根苗数/接种苗数)×100%;
平均生根数=每组根数总和/每组接种苗数。
1.8 炼苗与移栽
经生根培养后,选取健壮植株试管苗,置自然光温室环境下炼苗5~8 d,打开瓶盖炼苗3~5 d,将根表面残留培养基冲洗干净,移栽到V(腐殖质)∶V(粉碎落叶)=2∶1、V(腐殖质)∶V(沙子)=1∶1及V(泥炭土)∶V(腐殖质)∶V(珍珠岩)=6∶3∶1的3种混合基质中,每盆种植1株在温室环境下培养,移栽苗第1次水浇透,每隔3 d浇水1次(可根据不同季节、天气来调整),光照强度保持在1 000~2 000 lx,温室内空气湿度保持在75%~85%之间,避免阳光直射。30 d后统计成活率,筛选出最适宜多花黄精瓶苗移栽的基质。
成活率(%)=(成活总数/移栽总数)×100%。
1.9 数据分析
采用DPS分析软件进行数据处理及方差分析,多重比较采用显著系数为0.05的Duncan新复极差法分析评价差异显著性。所有处理应用正交试验设计法,计算结果用“平均数±标准差”表示。
2 结果与分析
2.1 不同成熟度荚果对种子萌发的影响
由表1可知,不同成熟度荚果对种子萌发具有不同的影响;30 d后统计发现,萌发率最高。
表1 不同成熟度荚果对种子萌发的影响
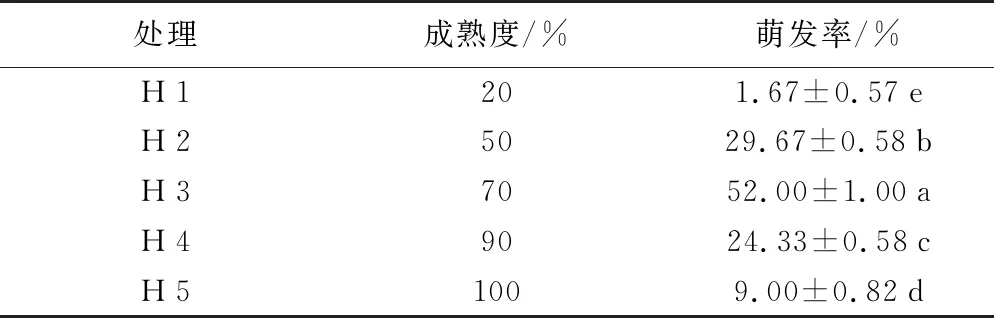
处理成熟度/%萌发率/%H120 1.67±0.57eH25029.67±0.58bH37052.00±1.00aH49024.33±0.58cH5100 9.00±0.82d
注:表中同列不同小写字母表示差异显著水平。下同。
2.2 不同浓度NAA、BA对芽诱导的影响
以MS为基本培养基,将不同浓度的NAA、BA分组加入,在温度(23±2)℃下暗培养10 d。10 d后移到光照强度为0~500 lx条件下培养,光照时间为每天10 h。30 d后统计萌发率,由表2可知:在不加NAA的W 2到W 5中,随着BA浓度的递增,芽诱导萌发率呈先增后减的趋势;当BA浓度为0.5 mg·L-1时,萌发率最高,为61.33%,效果最明显;随着BA浓度从0.5 mg·L-1到1.5 mg·L-1增加,萌发率呈递减趋势;当BA浓度为1.5 mg·L-1时,抽出的芽有死亡的预兆。在不加BA的W 6和W 11中,随着NAA浓度的增加,诱导萌发率较低,与空白对照的W 1无显著性差异;在W 7到W 10中,当NAA浓度为0.1 mg·L-1时,随着BA浓度的增加,诱导萌发率呈递减趋势,BA浓度为0.5 mg·L-1时,效果最明显;W 12到W 15呈现出与W 6到W 11一致的现象。在W 2、W 7、W 12中,BA浓度为0.5 mg·L-1不变,随着NAA浓度从0 mg·L-1到0.3 mg·L-1递增,诱导萌发率呈递减趋势,且BA浓度为0.5 mg·L-1、NAA浓度为0 mg·L-1时,效果最明显。综上:多花黄精种子芽诱导培养最适宜的培养基为MS+BA 0.5 mg·L-1+琼脂7.0 g·L-1+蔗糖 20 g·L-1+活性炭 0.5 g·L-1。

图4 A为增殖诱导,B为移栽
表2 不同质量浓度NAA、BA对芽诱导的影响
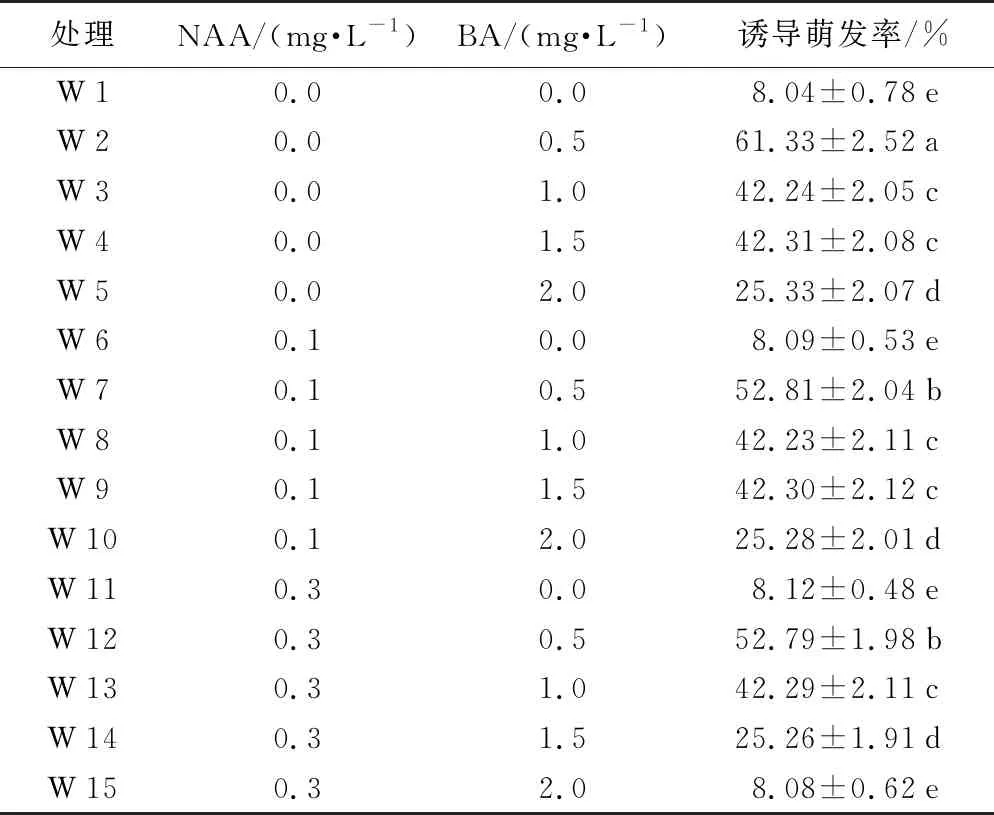
处理NAA/(mg·L-1)BA/(mg·L-1)诱导萌发率/%W10.00.0 8.04±0.78eW20.00.5 61.33±2.52aW30.01.0 42.24±2.05cW40.01.5 42.31±2.08cW50.02.0 25.33±2.07dW60.1 0.0 8.09±0.53eW70.1 0.5 52.81±2.04bW80.1 1.0 42.23±2.11cW90.1 1.5 42.30±2.12cW100.1 2.0 25.28±2.01dW110.3 0.0 8.12±0.48eW120.3 0.5 52.79±1.98bW130.3 1.0 42.29±2.11cW140.3 1.5 25.26±1.91dW150.3 2.0 8.08±0.62e
2.3 不同浓度激素配比对诱导芽增殖的影响
由表3可知,不同浓度激素配比对多花黄精诱导芽增殖具有不同的影响;经增殖培养,30 d后统计发现,在M 1、M 4、M 7中,KT为0.5 mg·L-1,随着BA浓度的递增,诱导芽数和增殖率都呈递增趋势,当BA浓度为1.5 mg·L-1,丛生芽较多,有效芽少,可知高浓度BA有利于增殖倍数的增加,抑制有效芽产生;在M 4到M 6中,BA为1.0 mg·L-1,随着KT浓度的递增,NAA浓度的递减,诱导芽数和增殖率M 5>M 6>M 4,表明在KT浓度为1.0 mg·L-1时,出芽情况最佳;在M 2、M 4、M 7、M 8处理中,诱导芽数和增殖率没有显著性差异,但NAA浓度为0.5 mg·L-1的M 2和M 4较NAA浓度为0.3 mg·L-1和 0.1 mg·L-1的M 7和M 8长势差,M 7和M 8中芽苗长势好,叶色绿;NAA为0.3 mg·L-1时,接种的材料有毛细根生成,且生长较快。芽苗长势最好且有效芽最多的是处理M 5,效果最明显;综上:多花黄精诱导芽增殖培养的适宜培养基为MS + NAA 0.3 mg·L-1+ BA 1.0 mg·L-1+ KT 1.0 mg·L-1+ 蔗糖 20 g·L-1+ 琼脂 7.0 g·L-1+ 活性炭 0.5 g·L-1,诱导芽数为3.42个,芽增殖率为76.74%,且长势好,生根快。
2.4 不同浓度激素配比对诱导生根的影响
由表4可知,不同浓度激素配比对诱导生根具有不同的影响,经生根培养,40 d后统计发现,在只加入IAA的P 2到P 4中,随着IAA浓度递增,生根率和平均生根数呈递增趋势;在只加入IBA的P 5到P 7中,随着IBA浓度的递增,生根率和平均生根数呈递增趋势;从表4可看出,在相同浓度下,只加入IBA培养基各方面指标明显优于只加入IAA的培养基;故生根培养诱导能力IBA>IAA。在加入不同浓度、不同配比的P 8到P 10中,IAA为0.5 mg·L-1,IBA从0.5 mg·L-1到1.5 mg·L-1递增,生根率和平均生根数呈递减趋势;P 11到P 13和P 14到P 16与P 8到P 10结果一致;即IBA为0.5 mg·L-1最有利于瓶苗生根。在加入IBA 0.5 mg·L-1和IAA 1.0 mg·L-1的P 11中,生根率为81.71%,平均生根数为6.11个,效果最明显;综上:多花黄精瓶苗生根培养适宜培养基为1/2 MS+IAA 1.0 mg·L-1+IBA 0.5 mg·L-1+蔗糖20 g·L-1+琼脂7.0 g·L-1+活性炭0.5 g·L-1。
2.5 移栽基质的选择
经移栽培养,30 d后统计发现,在V(腐殖质)∶V(落叶)=2∶1、V(腐殖质)∶V(沙子)=1∶1及V(泥炭土)∶V(腐殖质)∶V(珍珠岩)=6∶3∶1三种混合基质中都能成活,移栽成活率分别为72%、65%、85%,因此移栽的适宜基质为V(泥炭土)∶V(腐殖质)∶V(珍珠岩)=6∶3∶1的混合基质。
表3 不同浓度激素配比对诱导芽增殖的影响
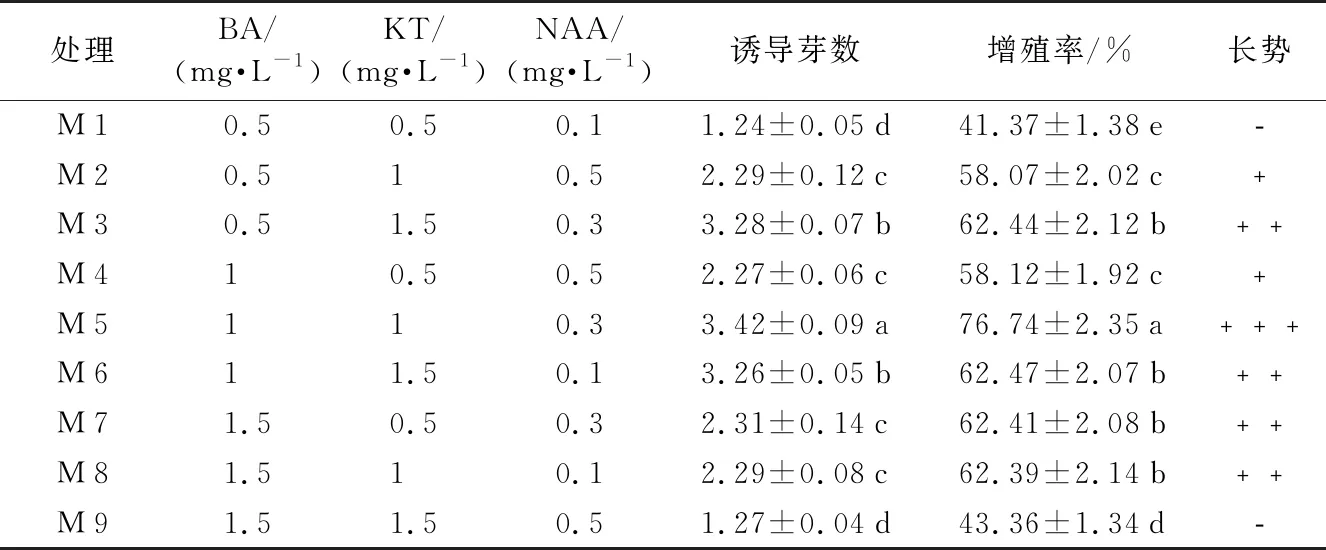
处理BA/(mg·L-1)KT/(mg·L-1)NAA/(mg·L-1)诱导芽数增殖率/%长势M10.50.50.11.24±0.05d41.37±1.38e﹣M20.510.52.29±0.12c58.07±2.02c﹢M30.51.50.33.28±0.07b62.44±2.12b﹢﹢M410.50.52.27±0.06c58.12±1.92c﹢M5110.33.42±0.09a76.74±2.35a﹢﹢﹢M611.50.13.26±0.05b62.47±2.07b﹢﹢M71.50.50.32.31±0.14c62.41±2.08b﹢﹢M81.510.12.29±0.08c62.39±2.14b﹢﹢M91.51.50.51.27±0.04d43.36±1.34d﹣
注:“﹢﹢﹢”表示长势好,“﹢﹢”表示长势较好,“﹢”表示长势一般,“﹣”表示长势差。下同。
表4 不同浓度的激素配比对诱导生根的影响
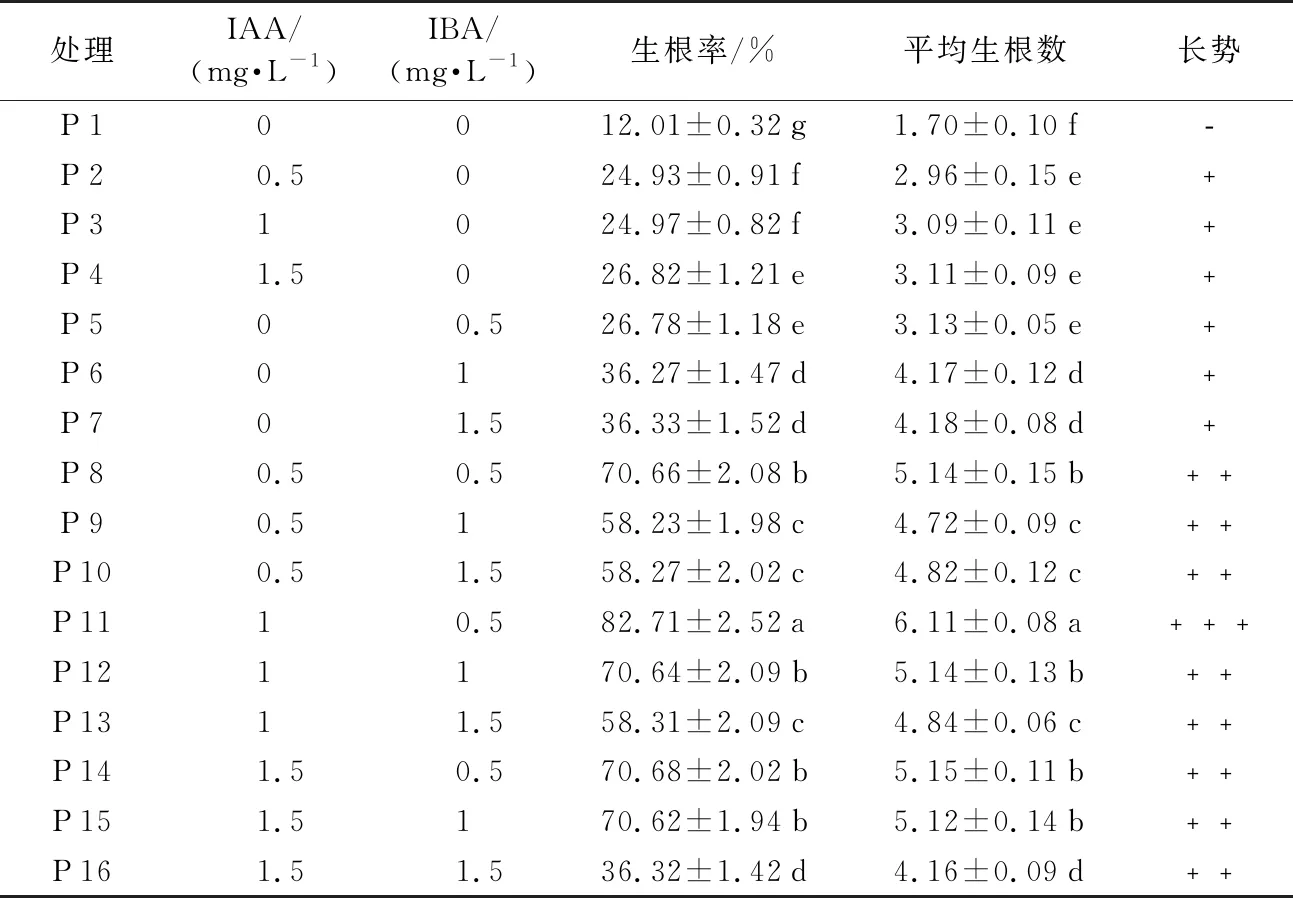
处理IAA/(mg·L-1)IBA/(mg·L-1)生根率/%平均生根数长势P10012.01±0.32g1.70±0.10f﹣P20.5024.93±0.91f2.96±0.15e﹢P31024.97±0.82f3.09±0.11e﹢P41.5026.82±1.21e3.11±0.09e﹢P500.526.78±1.18e3.13±0.05e﹢P60136.27±1.47d4.17±0.12d﹢P701.536.33±1.52d4.18±0.08d﹢P80.50.570.66±2.08b5.14±0.15b﹢﹢P90.5158.23±1.98c4.72±0.09c﹢﹢P100.51.558.27±2.02c4.82±0.12c﹢﹢P1110.582.71±2.52a6.11±0.08a﹢﹢﹢P121170.64±2.09b5.14±0.13b﹢﹢P1311.558.31±2.09c4.84±0.06c﹢﹢P141.50.570.68±2.02b5.15±0.11b﹢﹢P151.5170.62±1.94b5.12±0.14b﹢﹢P161.51.536.32±1.42d4.16±0.09d﹢﹢
3 讨 论
3.1 外植体的选择
本研究以成熟度为70%的野生多花黄精母株上的荚果为外植体,在繁育过程中发现,取完全成熟的果子比70%成熟度荚果为外植体的萌发时间要迟30~35 d,成熟度为20%~50%的种子萌发时间较成熟度70%种子萌发率低,萌发生长不一致甚至出现死亡发黑现象。内源激素ABA会抑制胚的萌发,诱导种子休眠;而多花黄精种子在成熟过程中,前期ABA含量较高,中期ABA含量最低,完熟期ABA变高[20]。这与本研究结果一致,因此,选择荚果成熟度为70%的野生多花黄精为外植体,更有利于解除种子休眠,促进离体培养时种子的萌发。
3.2 芽诱导培养中存在的问题
在芽诱导培养中,在W 2到W 5中,随着BA浓度递增,种子萌发率呈先增后减的趋势;当BA浓度为0.5 mg·L-1时,萌发率最高,为61.33%;随着BA浓度(0.5~1.5 mg·L-1)的增加,萌发率呈降低趋势;当BA浓度为1.5 mg·L-1时,抽出的芽有死亡的预兆;在W 2、W 7、W 12中,BA浓度为0.5 mg·L-1不变,随着NAA浓度从0~0.3 mg·L-1递增,诱导萌发率呈递减趋势,表明NAA在多花黄精芽诱导培养中没有明显作用。由于黄精种子在打破休眠,生长期长、难以取材等方面有一定的难度,所以有关使用未成熟黄精荚果进行芽萌发诱导的研究少有报道。在繁育培养中,多花黄精种子易于消毒,较根茎容易建立无菌体系[21]。本研究61.33%的芽诱导率不太理想,希望能为多花黄精种子芽诱导萌发培养提供材料。
3.3 芽增殖培养中存在的问题
在诱导芽增殖培养中,若要提高增殖倍数需增加BA和KT的用量,但得到的芽苗细弱,相反若想让芽苗长得完整、健壮,则增殖倍数就会降低[22],这与本研究结果一致,当BA浓度为1.5 mg·L-1时,增殖倍数增加,有效芽少;因此,在既保证有效健壮芽的增加又能提高增殖倍数的情况下,选择出多花黄精种子诱导芽增殖最适宜的培养基是MS+BA 1.0 mg·L-1+KT 1.0 mg·L-1+NAA 0.3 mg·L-1+蔗糖20 g·L-1+琼脂7.0 g·L-1+活性炭0.5 g·L-1;诱导芽数为3.42个,芽增殖率为76.74%。
表5 不同基质配方对瓶苗移栽成活的影响

处理基质成活率/%V1V(泥炭土)∶V(腐殖质)∶V(珍珠岩)=6∶3∶185V2V(腐殖质)∶V(沙子)=1∶165V3V(腐殖质)∶V(粉碎落叶)=2∶172
3.4 生根培养中存在的问题
本研究结果表明:生根培养时以1/2 MS为基本培养基,加入IBA 0.5 mg·L-1和IAA 1.0 mg·L-1后,效果最佳,生根率为81.71%,这与刘红美等[23]的研究结果不同,这可能与试验中使用的药品来源、碳源种类、光照时间、光照强度、培养时间或黄精的种源等不同有关;本研究还得出不同质量浓度的生长素对生根培养的诱导能力IBA>IAA,这与周新华等[24]的研究结论相同。然而,由于试验规模和时间的限制,加之生根培养受多种因素的影响[25],本研究仅从IBA和IAA的不同配比、温度、光照时间及光照强度等几方面入手探讨其对黄精诱导生根的影响;未能从不同添加剂、不同激素种类及其浓度与配比、不同基本培养基等对诱导生根的影响问题进行探讨,有不足之处还需要作进一步的试验研究。
3.5 不同光照强度对多花黄精种子离体培养的影响
通过观察,诱导芽增殖培养时,将瓶苗从500 lx移到1 000 lx下,培养几天后,发现在突然增加光照强度时,瓶苗出现黄化,长势不良的状况;诱导生根时,从1 000 lx移到2 000 lx则不会出现这样的现象;综上,多花黄精种子诱导芽增殖培养时对光照强度较敏感,需要一定的适应阶段,在繁育过程中可根据不同的生长阶段供给不同区间的光照强度,光照强度从0~2 000 lx递增培养,光照时间为每天10 h,帮助植物尽快适应外部环境;多花黄精诱导生根培养时对光照强度适应性强,这与周新华等[24]的研究结论相同。
4 结 论
本试验以成熟度为70%的优质多花黄精种子为外植体,进行了种子萌发、芽增殖、瓶苗生根和移栽的研究,建立多花黄精植株再生体系。芽诱导适宜培养基为MS+BA 0.5 mg·L-1+KT 0.5 mg·L-1琼脂7.0 g·L-1+蔗糖20 g·L-1+活性炭0.5 g·L-1;芽增殖适宜培养基为MS+BA 1.0 mg·L-1+KT 1.0 mg·L-1+NAA 0.3 mg·L-1+蔗糖20 g·L-1+琼脂7.0 g·L-1+活性炭0.5 g·L-1;生根适宜培养基为1/2 MS+IBA 0.5 mg·L-1+IAA 1.0 mg·L-1+蔗糖20 g·L-1+琼脂7.0 g·L-1+活性炭0.5 g·L-1;瓶苗移栽适宜基质为V(泥炭土)∶V(腐殖质)∶V(珍珠岩)=6∶3∶1的混合基质。
试验结果表明:采用成熟度为70%的优质多花黄精荚果为外植体,进行繁育培养。通过该技术建立的再生体系可获得61.33%以上的正常萌芽;芽增殖培养时,诱导芽数为3.42个,芽增殖率为76.74%;经瓶苗生根培养,生根率为81.71%,平均生根数为6.11个;经炼苗移栽,成活率达85%。
