L-色氨酸混菌发酵工艺
2019-08-12张震熊海波徐庆阳
张震,熊海波,徐庆阳,2,3*
1(天津科技大学 生物工程学院,天津,300457) 2(代谢控制发酵技术国家地方联合工程实验室,天津,300457)3(天津市氨基酸高效绿色制造工程实验室,天津,300457)
混菌发酵是指利用两种或多种微生物的协同作用共同完成发酵过程的一种发酵技术[1]。混菌发酵中不同菌种各自的代谢活动具有互补性,并且不会互相抑制生长,表现出互生关系。这种互补性质有时也能获得纯种培养难以达到的良好效果,例如可提高产品产率、获得特殊代谢产物等[2-3]。目前,混菌发酵在食品发酵、废物处理、酒精生产及环境改造等领域已有较多应用,其他方面的应用也在逐渐开展[4]。
L-色氨酸是8种必需氨基酸之一,又被称为第二必需氨基酸[5]。它能够调节人和动物的新陈代谢和生理功能,改善人和动物的消化功能,并提高其免疫功能,对人和动物的生长发育起着至关重要的作用[6-7],因而被广泛用于饲料和医药行业。近年来,随着色氨酸功能的进一步研究,开始在食品、农业与环境等领域推广应用,市场发展前景十分广阔[8]。
微生物直接发酵法是当前L-色氨酸生产的主流方法,该法以葡萄糖等廉价原料为碳源,利用优良的色氨酸生产菌种来生产色氨酸,其中大肠杆菌和谷氨酸棒杆菌应用较多[9-10]。但是大肠杆菌在以葡萄糖作为原料生产色氨酸时,会有很大一部分碳源流向乙酸、乳酸等代谢副产物。当副产物累积到一定浓度时,菌体生长受到严重抑制,比生长速率迅速下降,从而导致产物合成速率降低,产量下降[11-12],影响产品质量,因此减少乙酸、乳酸等副产物的积累对发酵法生产L-色氨酸具有重要意义。谷氨酸棒杆菌能利用乙酸、乳酸等有机酸作为其代谢碳源进行生长[13]且不会对大肠杆菌产生抑制[14]。本研究以无拮抗反应的2株色氨酸生产菌大肠杆菌(Escherichiacoli)TRTH和谷氨酸棒杆菌(Corynebacteriumglutamicum) TQ2223作为混菌发酵研究对象,构建了以大肠杆菌为主、谷氨酸棒杆菌为辅的L-色氨酸混菌发酵工艺,并采用单因素试验对混菌发酵的最佳生产条件进行优化,有效地降低了发酵过程中乙酸、乳酸等代谢副产物的积累,提高了L-色氨酸的产量及糖酸转化率,为发酵法高效生产L-色氨酸提供了新方案。
1 材料与方法
1.1 菌种
L-色氨酸工程菌大肠杆菌TRTH(trpEDCBA+TetR),L-色氨酸工程菌谷氨酸棒杆菌TQ2223(Phe-+Tyr-),由天津科技大学代谢工程研究室提供。
1.2 培养基
1.2.1 斜面培养基
大肠杆菌TRTH(g/L):蛋白胨10,酵母粉5,牛肉膏10,KH2PO41,MgSO4·7H2O 0.5,琼脂粉20,四环素0.05。
谷氨酸棒杆菌TQ2223(g/L):蛋白胨10,酵母粉5,牛肉膏10,NaCl 2.5,玉米浆粉8,KH2PO41,MgSO4·7H2O 0.5,琼脂粉20。
1.2.2 种子培养基
大肠杆菌TRTH:葡萄糖10 g/L,酵母粉4 g/L,柠檬酸0.5 g/L, (NH4)2SO41 g/L,KH2PO41 g/L,VB11 mg/L,VH0.3 mg/L, MgSO4·7H2O 1.5 g/L,FeSO4·7H2O 2.8 mg/L,微量元素混合溶液2 mL/L。
谷氨酸棒杆菌TQ2223:葡萄糖20 g/L,酵母粉4 g/L, 豆饼水解液20 mL/L,(NH4)2SO45 g/L,KH2PO41 g/L,VB10.3 mg/L,VH0.2 mg/L,MgSO4·7H2O 1 g/L,FeSO4·7H2O 10 mg/L,Phe 0.1 g/L,Tyr 0.1 g/L。
1.2.3 发酵培养基
混菌发酵和对照发酵培养基:葡萄糖15 g/L,酵母粉6 g/L,柠檬酸2 g/L,(NH4)2SO44 g/L, KH2PO45 g/L,MgSO4·7H2O 2 g/L, FeSO4·7H2O 75 mg/L,VB15 mg/L,VH0.2 mg/L,微量元素混合溶液4 mL/L。
1.3 仪器与设备
LDZH-100KBS立式压力蒸汽灭菌器,上海申安医疗器械厂; 5 L不锈钢机械搅拌发酵罐,上海保兴生物设备工程有限公司;30 L不锈钢机械搅拌发酵罐,上海保兴生物设备工程有限公司;BST-AH智能电加热蒸汽发生器,湖北贝思特智能科技有限公司;SBA-40E生物传感分析仪,山东省科学院生物研究所;TU 1810紫外可见分光光度计,北京普析通用仪器有限责任公司;LC20AT高效液相色谱仪,日本岛津公司;A300氨基酸分析仪,德国安米诺西斯公司。
1.4 培养方法
1.4.1 菌种活化
取甘油管中菌种接种于斜面培养基中,传代活化2次。大肠杆菌TRTH:37 ℃恒温倒置培养,每代培养12 h;谷氨酸棒杆菌TQ2223:32 ℃恒温倒置培养,每代培养24 h。
1.4.2 摇瓶培养
种子培养:从活化好的斜面上刮取1环菌体到装有30 mL种子培养基的三角瓶(500 mL)中,9层纱布封口。大肠杆菌TRTH:37 ℃,220 r/min培养8~10 h;谷氨酸棒杆菌TQ2223:32 ℃,200 r/min培养12~14 h。
发酵培养:将培养好的种子液按一定接种量接种到装有30 mL发酵培养基的500 mL容量瓶中,9层纱布封口,摇床转速220 r/min,培养26~28 h。过程中补加氨水维持pH,补加600 g/L的葡萄糖溶液维持碳源供给。
1.4.3 5 L罐种子培养
利用5 L发酵罐进行种子培养,初始发酵液体积定容至3 L。初始通气量为2 L/min,初始搅拌转速为200 r/min,通过自动流加25%的氨水控制发酵液pH值在7.0~7.2,TRTH 37 ℃培养,TQ2223 32 ℃培养,通过搅拌和通风控制溶氧,TRTH维持在25%~30%,TQ2223维持在15%~30%,以消泡剂消泡。
1.4.4 30 L罐发酵培养
在最优条件下利用30 L发酵罐进行混菌发酵培养,初始发酵液体积定容至15 L,通过自动流加25%的氨水控制培养基pH,通过搅拌和通风控制溶氧在25%~40%,通过流加800 g/L的葡萄糖溶液维持发酵,维持罐内糖质量浓度≤1 g/L,发酵过程中,以泡敌消泡,每隔2 h测样、记录数据。
1.5 试验方法
1.5.1 菌株拮抗试验
利用平板扩散对峙法检测大肠杆菌TRTH和谷氨酸棒杆菌TQ2223菌株间的拮抗反应,具体步骤如下:将2种菌分别在斜面培养基中培养24 h之后用无菌水洗脱,制备菌悬液,取2%接种到发酵培养基中,32或37 ℃振荡培养24 h。培养结束后,分别取200 μL发酵液涂布在不同的发酵培养基平板上,并打孔。随后将2株菌的发酵液离心取上清(13 000 r/min、2 min), 并将1种菌株的上清液100 μL滴加在涂布有另一种菌株的平板孔中,以无菌水做阴性对照,设置3组平行试验,置32或37 ℃恒温箱中培养24 h后观察有无抑菌圈形成。
1.5.2 单因素试验
在摇瓶水平上进行单因素实验,对混菌发酵生产色氨酸的最适条件进行初步探究。固定大肠杆菌TRTH接种量(10%)、培养体积(30 mL/500 mL)、摇床转速(220 r/min)及培养时间(26~28 h),分别考察2种菌的接种间隔时间、谷氨酸棒杆菌TQ2223接种量、pH及培养温度对OD600值、L-色氨酸产量及乙酸积累量的影响(表1)。
1.5.3 混菌发酵工艺流程
本工艺采用2个5L发酵罐(罐A、罐B)和1个30L发酵罐(罐C),3罐1组进行双菌混合发酵。罐A用于大肠杆菌TRTH种子培养,罐B用于谷氨酸棒杆菌TQ2223种子培养,罐C用于混菌发酵培养。
罐A、罐B同时开始种子培养,罐A内大肠杆菌TRTH种子培养好后先接入已消毒的罐C中,开始发酵培养,发酵至14 h时,再将培养好的罐B内谷氨酸棒杆菌TQ2223种子接入罐C中,实现混菌发酵培养。具体操作要点如下:

表1 培养条件单因素试验因素与水平Table 1 Factors and levels of single factor experiment for culture conditions
注:“-”表示无该因素水平。
(1)首先将2株菌种扩培到相应的5 L种子罐中进行种子培养,种子培养基均定容至3 L,大肠杆菌TRTH 37 ℃培养,谷氨酸棒杆菌TQ2223于32 ℃培养,在此期间将罐C空消(121 ℃,20 min),之后加入发酵培养基并加水定容至13.5 L后实消(115 ℃,15 min)。
(2)待罐A内大肠杆菌TRTH种子液菌体浓度OD600达到10~12时,利用压差将其按10%接种量(1.5 L)经无菌管道接入实消好的罐C中,发酵培养基最终定容至15 L,维持36 ℃、pH 7.0发酵培养,同时,罐B内谷氨酸棒杆菌TQ2223继续维持种子培养。
(3)罐C发酵开始14 h后,先将发酵液放出1.1 L,再将罐B内培养好的谷氨酸棒杆菌TQ2223种子液利用压差按7.5%接种量(≈1.1 L)经无菌管道接入罐C中,继续维持36 ℃、pH 7.0发酵培养。混菌发酵工艺流程如图1所示。
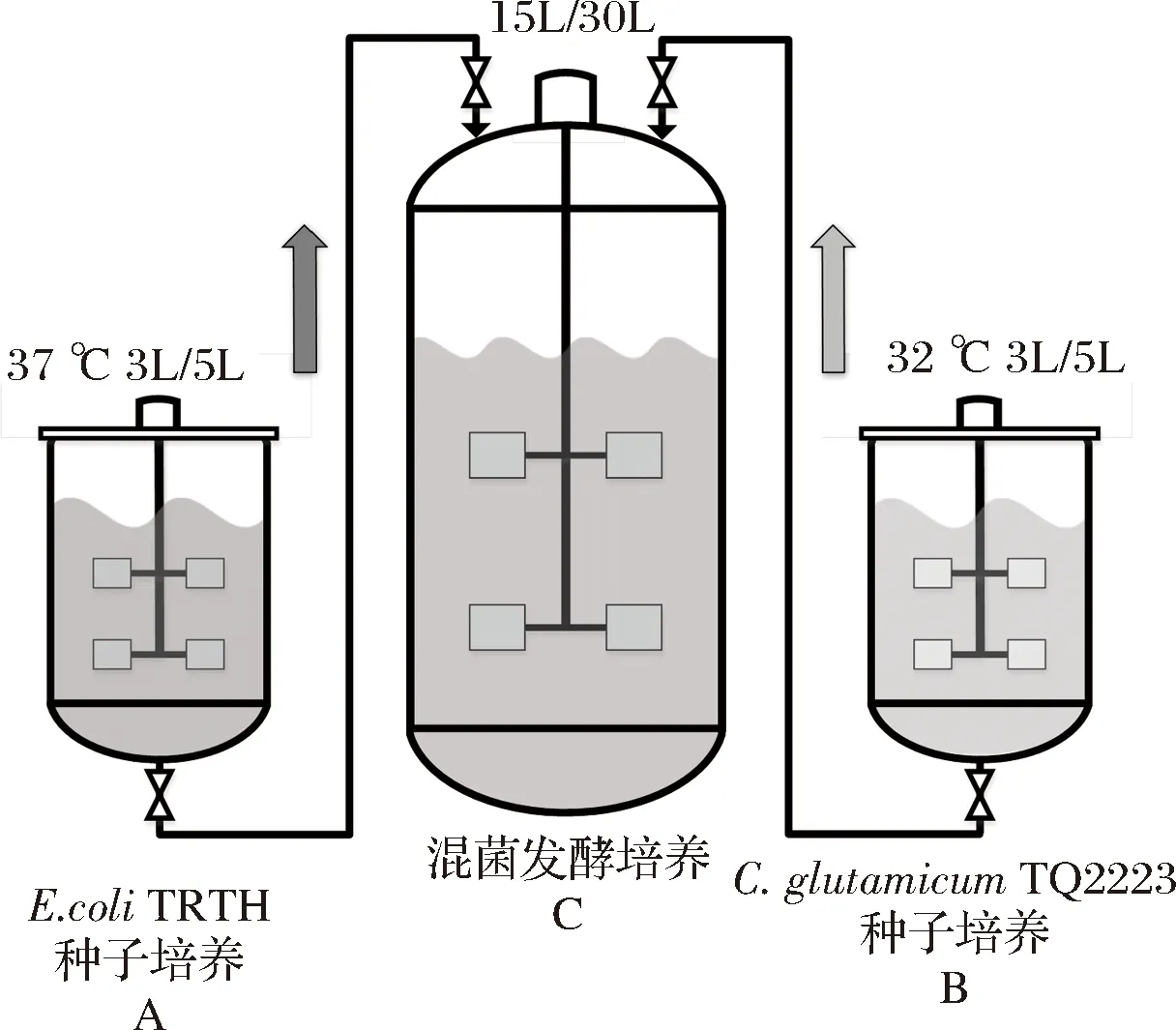
图1 混菌发酵工艺流程示意图Fig.1 Schematic diagram of mixed bacteria fermentation process
1.6 检测方法
1.6.1 pH值测定
采用Hamilton pH电极在线检测,精密试纸(pH 6.4~8.0)辅助检测。
1.6.2 菌体浓度测定
见参考文献[15]。
1.6.3L-色氨酸含量测定
见参考文献[16]。
1.6.4 有机酸副产物含量测定
采用高效液相色谱法检测有机酸含量。Aminex HPX-87H色谱柱(300 mm×7.8 mm),流动相5 mmol/L H2SO4,柱温30 ℃,流速0.5 mL/min,紫外检测波长215 nm。
1.6.5 氨基酸副产物含量测定
采用A300氨基酸分析仪进行测定。
1.7 分析方法
糖酸转化率根据公式(1)计算:
糖酸转化率/%=
(1)
式中:发酵液中L-色氨酸质量浓度,g/L;发酵液总体积,L;总耗糖量,g。
所有试验数据取3次实验的平均值。单因素方差分析后Dunnett检验来确定数据差异的显著性(P<0.05)。
2 结果与分析
2.1 菌种拮抗试验结果及共生体系的构建
平板扩散对峙试验结果表明,大肠杆菌TRTH与谷氨酸棒杆菌TQ2223无拮抗反应(无抑菌圈形成),可以进行混菌发酵(图2)。
大肠杆菌TRTH是利用基因工程定向改造所得到的L-色氨酸高产菌株,拥有极佳的L-色氨酸生产能力,30 L小试发酵34 h,产酸可达45 g/L以上[17],但同时也伴随有乙酸、乳酸等副产物生成,副产物的大量积累会给发酵带来严重的不利影响。而谷氨酸棒杆菌TQ2223虽然L-色氨酸生产能力较弱,同等规模发酵72 h,产酸只有10 g/L左右[8],但它可以快速地吸收和消耗乙酸、乳酸等有机酸作为自身的生长底物。所以,结合混菌发酵,通过在大肠杆菌TRTH的发酵过程中选择合适的时间加入适当量的谷氨酸棒杆菌TQ2223,解决大肠杆菌TRTH单菌发酵(对照发酵)的抑制性副产物积累问题是可行的。

A-谷氨酸棒杆菌TQ2223涂布(大肠杆菌TRTH上清点孔); B-大肠杆菌TRTH涂布(谷氨酸棒杆菌TQ2223上清点孔); C-无菌水涂布(无菌水点孔)图2 平板扩散对峙试验结果Fig.2 Results of plate diffusion confrontation test
2.2 单因素试验结果分析
2.2.1 谷氨酸棒杆菌TQ2223接种量对混菌发酵的影响
将培养好的大肠杆菌TRTH种子液按10%接种量接入发酵培养基内,在发酵开始后8 h时分别接入0%、1.25%、2.5%、5%、7.5%、10%的谷氨酸棒杆菌TQ2223种子液,在37 ℃、pH 7.0的条件下,巡回恒温摇床(220 r/min)培养26 h。发酵结束后测定OD600、L-色氨酸产量和乙酸积累量,结果如图3。
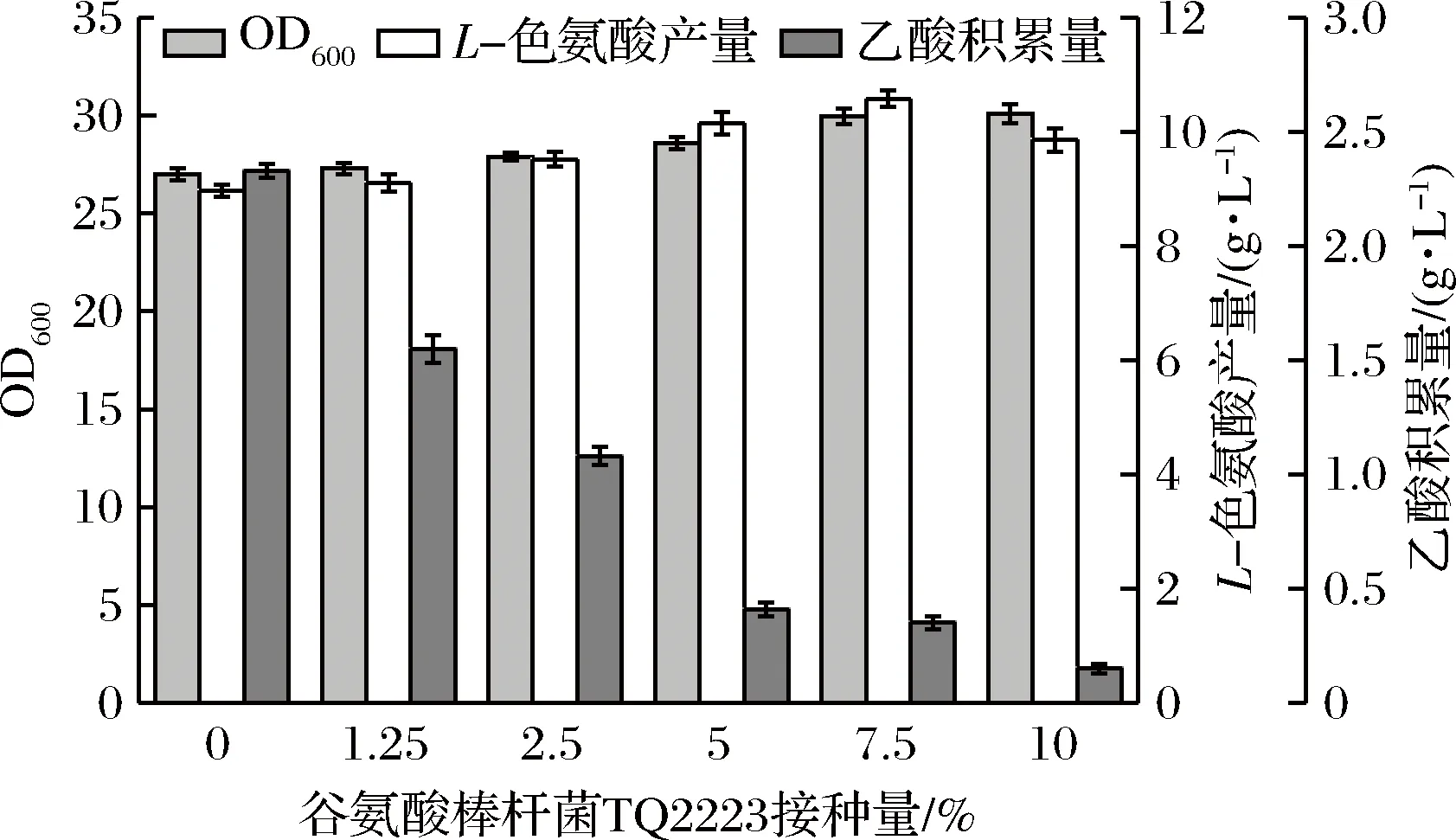
图3 谷氨酸棒杆菌TQ2223接种量对混菌发酵产L-色氨酸的影响Fig.3 Effect of Corynebacterium glutamicum TQ2223 inoculum on L-tryptophan production by mixed fermentation
由图3可以明显看出,随着谷氨酸棒杆菌TQ2223接种量的增加,乙酸积累量大幅减少,并在接种量为10%时达到最低,为0.15 g/L,比最高(接种量为0%)时的2.33 g/L下降了93.6%。同时,OD600和L-色氨酸产量逐渐增加,且L-色氨酸产量在谷氨酸棒杆菌TQ2223接种量为7.5%时达到最高(10.58 g/L),之后开始下降。分析可知,谷氨酸棒杆菌TQ2223能够有效地消耗大肠杆菌TRTH在发酵过程中产生的乙酸,使得混菌发酵的乙酸积累量远低于大肠杆菌TRTH单菌发酵,菌体活力和整体产酸能力得到提升。谷氨酸棒杆菌TQ2223接种量过小, OD600值和L-色氨酸产量无太大变化,而谷氨酸棒杆菌TQ2223接种量过高会使其过多地占用大肠杆菌TRTH的生长空间,对大肠杆菌的生长产生不利影响,这时虽然乙酸积累量达到最低水平,但是混菌发酵的整体产酸性能却开始呈现下降趋势。因此综合考虑,选择7.5% 为谷氨酸棒杆菌TQ2223最佳接种量。
2.2.2 接种间隔时间对混菌发酵的影响
在最佳谷氨酸棒杆菌TQ2223接种量条件下,分别在发酵开始后8、10、12、14、16、18 h接入谷氨酸棒杆菌TQ2223种子液,其他培养条件不变,巡回恒温摇床培养26 h。发酵结束后测定OD600、L-色氨酸产量和乙酸积累量,结果如图4。
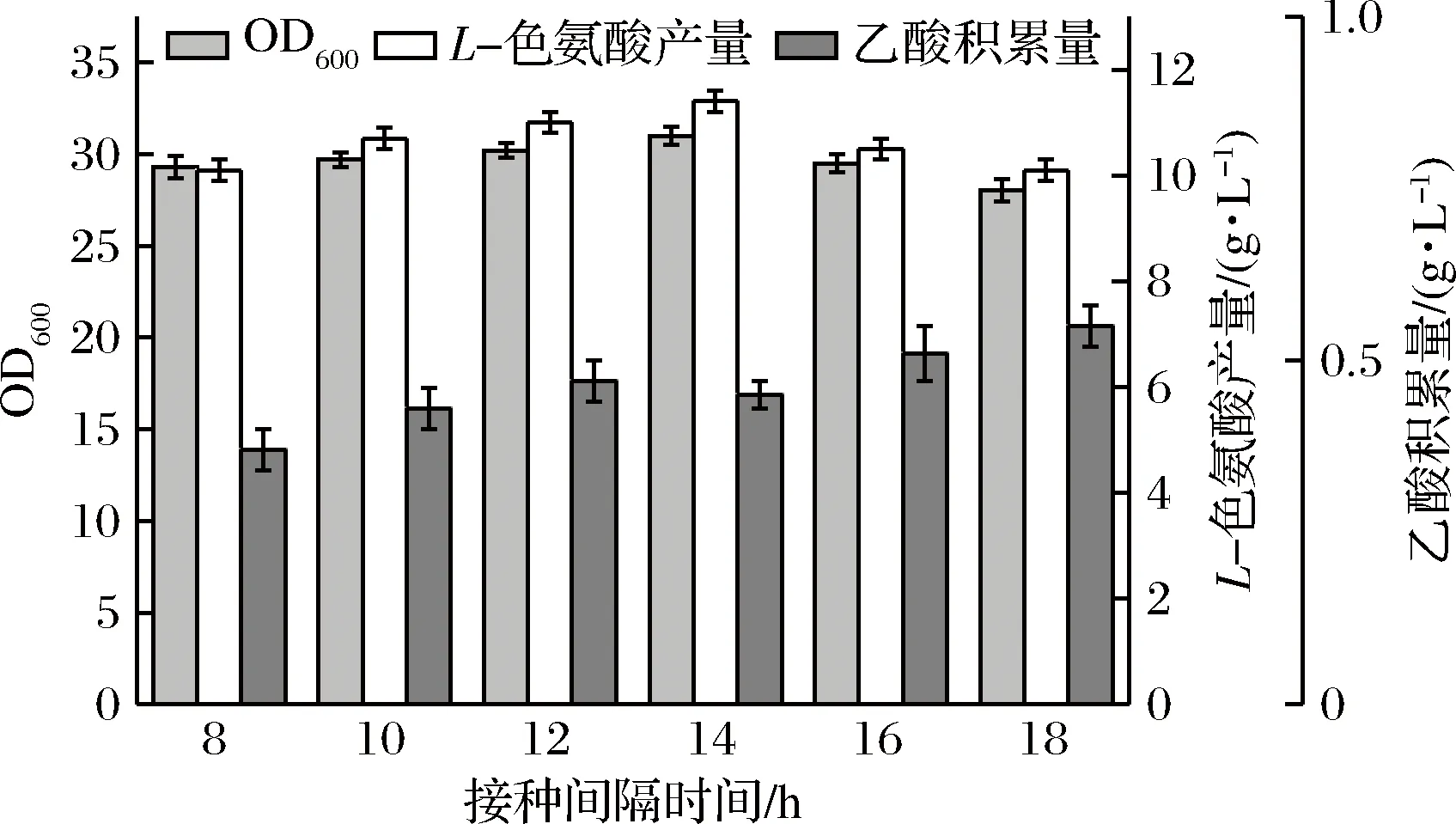
图4 接种间隔时间对混菌发酵产L-色氨酸的影响Fig.4 Effect of inoculation interval on L-tryptophan production by mixed fermentation
随着接种间隔时间的增加,混菌发酵的乙酸积累量与OD600均无较大变化,且乙酸积累量始终保持在较低水平;L-色氨酸产量先增加,在接种间隔时间为14 h时达到最高,为11.4 g/L,随后下降。分析可知,接种间隔时间对乙酸最终积累量影响不大,只要在发酵中接入了谷氨酸棒杆菌TQ2223,乙酸积累都会得到有效控制。另外,大肠杆菌TRTH单菌发酵一般在10 h左右开始产生副产物乙酸,所以不应在发酵前期进行混菌操作。同时,过晚接入谷氨酸棒杆菌TQ2223又会错过菌体生长产酸及控制副产物积累的关键时期,导致混菌发酵效果不佳。综合考虑,选择14 h为最佳接种间隔时间。
2.2.3 pH对混菌发酵的影响
在最佳谷氨酸棒杆菌TQ2223接种量、最佳接种间隔时间条件下,分别于pH值为6.6、6.8、7.0、7.2、7.4、 7.6环境中混菌发酵26 h,其他培养条件不变。发酵结束后测定OD600、L-色氨酸产量和乙酸积累量,结果如图5。
图5 pH对混菌发酵产L-色氨酸的影响Fig.5 Effects of pH value on L-tryptophan production by mixed fermentation
由图5可知,在pH为6.6~7.6的条件下,混菌发酵均能生长并维持一定的产酸能力,在pH值为7.0时,混菌发酵的OD600值及L-色氨酸产量均达到最高,分别为30.56和10.75 g/L;乙酸积累量最低,为0.47 g/L,此时混菌发酵的菌体活力最为旺盛,产物合成率最高。因此,选择pH 7.0为混菌发酵产L-色氨酸的最佳pH。
2.2.4 培养温度对混菌发酵的影响
在最佳谷氨酸棒杆菌TQ2223接种量、最佳接种间隔时间和最佳pH条件下,分别于34、35、36、37、38 ℃环境中混菌发酵26 h,其他培养条件不变。发酵结束后测定OD600、L-色氨酸产量和乙酸积累量,结果如图6。

图6 发酵温度对混菌发酵产L-色氨酸的影响Fig.6 Effects of fermentation temperature on L-tryptophan production by mixed fermentation
由图6可知,混菌发酵的乙酸积累量随着温度的升高有小幅增长,但总体差异不大。在培养温度低于36 ℃时,随着温度的升高,混菌发酵的OD600和L-色氨酸产量逐渐增加,且均在36 ℃时达到最高值,分别为32.1和11.82 g/L;当培养温度高于36 ℃时,随着温度的升高,混菌发酵的OD600和L-色氨酸产量均呈下降趋势。分析可知,在不同的培养温度下,混菌发酵的乙酸积累量均维持在较低水平。培养温度过高或过低都不利于菌体生长和产酸,较低的温度会使大肠杆菌TRTH的菌体活力受到抑制,菌体生长较为缓慢,导致混菌发酵体系整体产酸性能下降;较高的培养温度又会加快菌体衰亡,使菌体活力快速下降,L-色氨酸产量降低。所以综合考虑,选择36 ℃为混菌发酵的最佳温度。
2.3 混菌发酵验证试验结果分析
根据上述试验所得最佳发酵条件完善L-色氨酸混菌发酵工艺,并按照1.5.4所述工艺流程进行3批次平行发酵验证,发酵培养过程检测OD600、L-色氨酸产量及乙酸积累量,并计算L-色氨酸合成速率及乙酸积累速率,结果如图7所示。
由图7可知,在发酵前14 h,混菌发酵和对照发酵的OD600、L-色氨酸产量及乙酸积累量大致相同,此时段二者的L-色氨酸合成速率及乙酸积累速率也无较大差异,这是因为在发酵前14 h,混菌发酵还未接入谷氨酸棒杆菌TQ2223,且前期发酵条件和过程控制与对照发酵完全相同所致。在发酵14 h,混菌发酵接入谷氨酸棒杆菌TQ2223之后,两种工艺的乙酸积累量首先开始出现较大差异,且随着发酵的进行,混菌发酵的乙酸浓度大幅降低,并始终保持在较低水平。到36 h发酵结束时,混菌发酵的乙酸积累量只有0.87 g/L,较对照发酵的5.72 g/L降低了84.7%,两种菌株在乙酸的产生和消耗上形成了一种动态平衡,并使乙酸积累得到了有效控制。同时,从乙酸积累速率来看(图7-c),对照发酵的乙酸积累速率在14 h开始跃升,并在22 h左右达到峰值(0.55 g/(L·h)),而混菌发酵及时进行了混菌操作,乙酸被接入的谷氨酸棒杆菌TQ2223迅速消耗,积累速率大幅降低,最低值达到0.19 g/(L·h),最高值也仅为0.12 g/(L·h),较对照发酵的0.55 g/(L·h),降低了78.2%,乙酸去除效果显著,乙酸积累给发酵带来的负面影响也随之大幅减弱。
由图7-a可知,在16 h之后,两种工艺的OD600值和L-色氨酸产量均开始出现明显差异,且随着发酵的进行,混菌发酵的优势逐步增大,菌体生长进入稳定期以后,混菌发酵的OD600值维持在100左右,较对照发酵的93.5提高了6.9%;36 h放罐时,混菌发酵L-色氨酸产量为52.72 g/L,较对照发酵的46.43 g/L提高了13.6%。另外,就L-色氨酸合成速率而言(图7-b),混菌发酵表现出较高的单位产酸能力,从而使整体L-色氨酸合成能力高于对照发酵,最高L-色氨酸合成速率为2.02 g/(L·h),较对照发酵的1.82 g/(L·h)提高了11.0%,且在14~32 h的产酸能力均维持较高水平,这有利于色氨酸的大量积累。由表2可知,混菌发酵的最终糖酸转化率为21.2%,比对照发酵提高了19.1%,菌体和底物利用率均大幅提高。
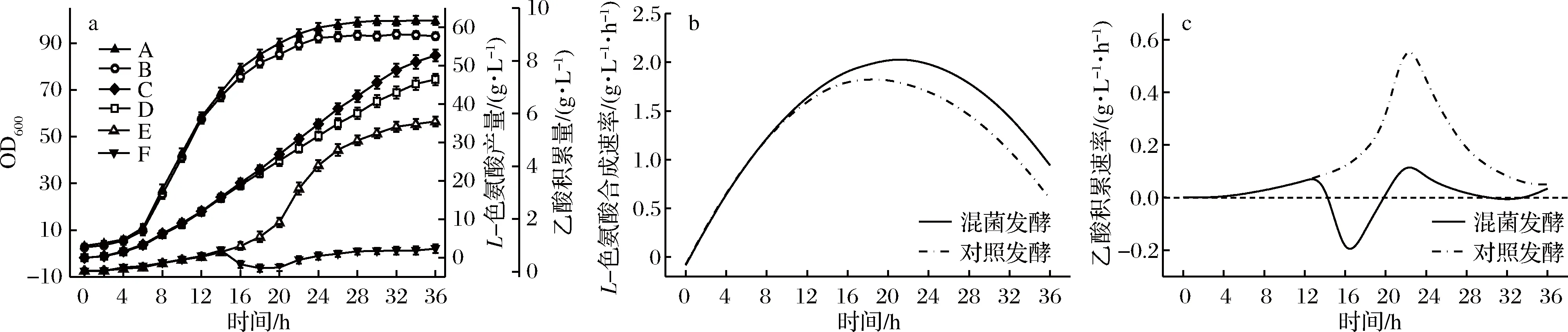
a-OD600、L-色氨酸产量和乙酸积累量;b-L-色氨酸合成速率;c-乙酸积累速率图7 混菌发酵和对照发酵产色氨酸过程曲线Fig.7 Time courses of L-tryptophan production mixed fermentation and common fermentation注:A、C、F分别为混菌发酵的OD600、L-色氨酸产量和乙酸积累量;B、D、E分别为对照发酵的OD600、L-色氨酸产量和乙酸积累量。

表2 不同发酵工艺参数结果对比Table 2 Comparison of different fermentation process parameters results
注:表中消耗葡萄糖糖总量为已除去所含结晶水和溶剂水的葡萄糖含量。
在利用大肠杆菌发酵产L-色氨酸时产生的代谢副产物中,乙酸对发酵的影响最大,乙酸会破坏菌体细胞的跨膜质子梯度,进而对氧化磷酸化和其他需能跨膜运输造成抑制。同时,分子态的乙酸还会通过改变菌体细胞的内部pH来扰乱细胞的正常代谢和生理活性[11, 18]。程立坤等[16]利用外源添加试验证明发酵液内乙酸质量浓度高于2 g/L(pH 7.0)时,大肠杆菌TRTH的生长速率、产物转化率及最高细胞密度均会受到不利影响。而谷氨酸棒杆菌可以快速地吸收和代谢乙酸,其利用体内的乙酸激酶在ATP的参与下将乙酸磷酸化为乙酰磷酸,之后乙酰磷酸再由磷酸转乙酰酶的催化下生成乙酰辅酶A,最后乙酰辅酶A进入三羧酸循环完成乙酸代谢[19-20]。验证结果表明混菌发酵的乙酸积累量始终维持低于1 g/L,远小于造成菌体抑制的临界浓度,乙酸对菌体生长和产酸造成的不利影响得以解除,菌体活力旺盛,生物量、糖酸转化率提高,从而使整体产酸能力得到增强,L-色氨酸产量大幅提高。

图8 混菌发酵对其他代谢副产物积累的影响Fig.8 Effect of mixed fermentation on accumulation of other by-products
另一方面,由图8可知,混菌发酵的副产物乳酸和丙氨酸的积累量也大幅减少,分别由对照发酵的1.46 和0.95 g/L,降低到0.25 和0.21 g/L。同时,36 h放罐时,发酵液中未检测到谷氨酸棒杆菌TQ2223的发酵副产物异亮氨酸、亮氨酸[21],这可能是因为异亮氨酸、亮氨酸等副产物被大肠杆菌TRTH完全消耗所致。分析可知,在混菌发酵过程中,两种菌株可以相互利用对方产生的发酵副产物,大肠杆菌TRTH受益于谷氨酸棒杆菌TQ2223的存在,而大肠杆菌TRTH的存在又不会影响谷氨酸棒杆菌TQ2223的生长,二者形成了互利互惠的共生关系。
3 结论
本研究利用2株色氨酸工程菌大肠杆菌TRTH和谷氨酸棒杆菌TQ2223构建了以大肠杆菌为主、谷氨酸棒杆菌为辅的L-色氨酸混菌发酵工艺,并通过单因素试验确定了混菌发酵的最佳接种间隔时间14 h,谷氨酸棒杆菌TQ2223接种量7.5%,培养温度36 ℃,pH 7.0,完善了混菌发酵工艺。验证试验结果表明,混菌发酵工艺可以有效降低L-色氨酸发酵过程中乙酸、乳酸等抑制性副产物的积累量,显著解除副产物对发酵的不利影响,大幅提高菌体活力和葡萄糖利用率及L-色氨酸产量。最终,与普通发酵工艺相比,混菌发酵工艺的乙酸积累量减少了84.75%,乳酸积累量减少了82.88%,L-色氨酸产量提高了13.6%,糖酸转化率提高了19.1%。
