低氧模拟剂预处理提高预构皮瓣成活率的实验研究
2019-08-07李玢程辰李华昝涛
李玢 程辰 李华 昝涛
预构皮瓣是指通过在皮瓣内植入轴型血管,经过一段时间的再血管化后,将随意皮瓣变为轴型血管皮瓣。皮瓣预构技术不仅能扩大游离皮瓣供区的选择,还能够按照一定的设计和构想,将皮瓣改造成具有一定功能和特性的皮瓣,使其更便于修复大面积器官缺损,尤其适合面颈部大面积烧伤后的重建[1]。该技术结合皮肤软组织扩张器的运用,能够形成一面积大、厚度薄、色泽质地与头面部较为接近的轴型皮瓣,用于全面部烧伤的重建[2]。
尽管预构皮瓣已是修复复合缺损的理想手段,但是皮瓣坏死的风险仍是亟待解决的问题。作为人为制造的轴型皮瓣,预构皮瓣的有效血运范围很难预估,其存活依赖于植入血管与受区组织的再血管化。因此,促进预构皮瓣的再血管化,可提高其存活率并减少并发症。
许多因素都能促进组织再血管化,组织缺氧是血管新生最重要的刺激因素,血管新生本身就是组织对抗低氧的一种表现。在组织创伤、失血、缺氧等病理状态下,机体组织的低氧诱导因子(Hypoxia Inducing Factor,HIF)转录活性上调,其下游所调控的效应蛋白中有很大一部分是与血管化相关的细胞因子,如VEGF等,可促进机体新生血管,以获得更多的氧供[3]。而HIF的活性,是由脯氨酸羟化酶(prolyl hydroxylase domain-containing enzymes,PHDs)起总调控作用,其中尤以PHD2对HIF-1α的调控最为重要[4]。PHD2是一个能感受环境氧浓度的分子,在亚铁离子和抗坏血酸的辅助下,可直接感受氧浓度的变化并作出反应,能通过将脯氨酸羟化抑制HIF-1α的活性,发挥一系列重要的生物学效应,如血管新生、红细胞增多等,来对抗组织的缺血、缺氧状态,在机体组织氧代谢平衡中起核心调控作用[5]。文献证实,使用基因治疗手段将PHD2基因抑制,可提高细胞HIF-1α转录水平,促进血管新生,提高缺血下肢抵抗缺氧的能力,并且这种作用是通过HIF-1α介导的[6]。有研究认为,利用ADSC治疗能有效促进预构皮瓣血管化,并观察到治疗后预构皮瓣VEGF水平增高[7]。 去铁胺(Defetoxamine,DFO)是一种铁离子螯合剂,而PHD2发挥生物活性需铁离子作为共同底物,所以螯合铁离子能够抑制PHD2的活性[8-9]。文献证实,利用低氧模拟剂去铁胺能够促进随意皮瓣的成活,降低缺血坏死的发生率,并且组织细胞的VEGF水平和细胞增殖活力在DFO干预后明显提高[10]。文献报道,应用PHD抑制剂DMOG在小鼠缺血皮瓣模型上,可观察到防止皮瓣缺血坏死的治疗效果[11]。因此,如能证实DFO促进预构皮瓣血管化,有可能为预构皮瓣更加安全地运用于临床增添一种辅助手段,有利于预构皮瓣技术在基层医院的推广。
1 材料与方法
1.1 实验动物及主要试剂
雄性 Wistar大鼠,8~12 周龄,体质量 280~300g(上海斯莱克公司)。所购动物饲养于华东师范大学实验动物中心(SPF级别),常规分笼饲养。注射用甲磺酸去铁胺 (商品名得斯芬,Novartis Pharma Stein AG,Switzerland)。
1.2 实验方法
1.2.1 大鼠腹部预构皮瓣模型的建立
建立大鼠腹部预构皮瓣模型:一期手术时将股动、静脉血管束植入腹壁皮下进行预构(图1)。4周后(二期)掀起以预构的血管束为蒂的岛状皮瓣,原位缝合(图 2)。
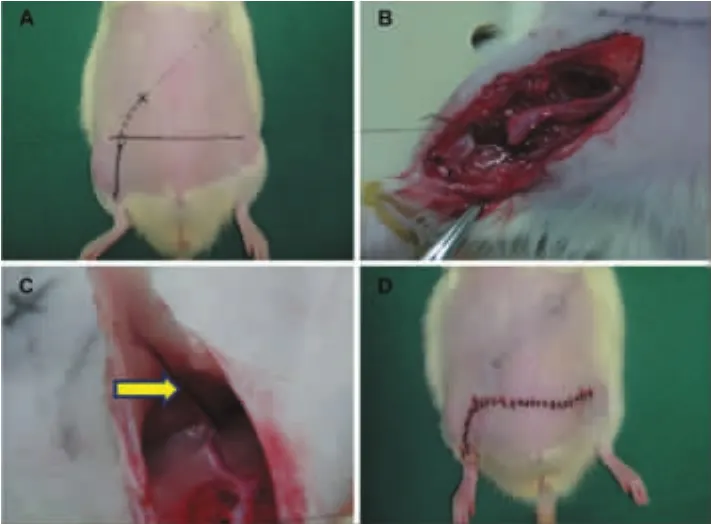
图1 大鼠腹部预构皮瓣一期手术示意图Fig.1 Surgical procedures of flap prefabrication on a rat model:stage I

图2 大鼠腹部预构皮瓣二期手术示意图Fig.2 Surgical procedures of flap prefabrication on a rat model:stage II
1.2.2 实验干预及分组
造模成功的大鼠随机分为 4组 (n=13):①对照组,无干预;②去铁胺腹腔注射组:一期术中及术后3 d给予腹腔注射去铁胺(20 mg/Kg);③去铁胺皮下注射组:一期术中及术后3 d在转位的血管蒂周围腹部皮下注射去铁胺(20 mg/Kg);④延迟组:在二期手术前一周,按照二期手术的切口设计(图3),将大鼠腹部两侧的纵行皮肤切口切开并原位缝合。
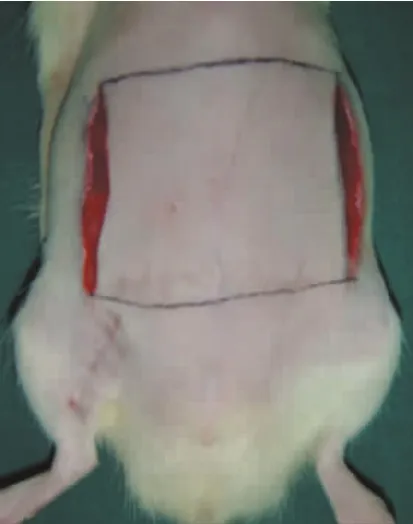
图3 二期手术前延迟切口示意图Fig.3 Delay procedure before the 2ndstage operation
1.2.3 预构皮瓣成活率评估
预构皮瓣二期术后即刻,用半透明纸拓下皮瓣面积,作为预构皮瓣的总面积;二期手术后第5~7天,当坏死区域界限明显时,将大鼠麻醉处死,以半透明纸拓下皮瓣存活面积。皮瓣坏死标准为皮瓣的颜色变黑、组织回缩、质地变硬或液化坏死形成创面。照片用Image Pro Plus软件分析面积,存活面积除以皮瓣总面积即为皮瓣存活率。
1.2.4 皮瓣微血管密度计数
在评估完皮瓣成活率之后,将皮瓣切下,切取植入的股血管束末端近旁成活的皮瓣组织,在10%中性甲醛缓冲液中固定24 h,而后置于30%蔗糖溶液中脱水48 h,PBS冲洗,75%乙醇浸泡保存。脱水、石蜡包埋,垂直于皮瓣平面连续切片(厚度8 μm,使用防脱片剂),VEGF免疫组化染色,镜下观察:每个皮瓣选择一张靠近皮瓣中间位置的切片,随机选择一个视野计数染色阳性的血管数量。
1.2.5 大鼠皮肤成纤维细胞的分离培养
选取出生7 d内的Wistar大鼠,处死后75%乙醇浸泡15 min消毒。将老鼠皮肤浸入0.2%中性蛋白酶溶液中,4℃过夜。次日小心剥除表皮组织,将真皮组织充分切碎,经37℃,0.2%胶原酶充分消化。过滤后离心,重悬沉淀于含10%胎牛血清的高糖培养液中,37℃、5%CO2恒温培养箱中培养。当细胞生长融合达80%~90%时,以1∶3或1∶4的比例传代。
1.2.6 大鼠皮肤成纤维细胞去铁胺干预及定量PCR分析
第2代的大鼠皮肤成纤维细胞加入去铁胺进行联合培养,培养至80%以上融合时,提取RNA行定量PCR检测,与单独培养的成纤维细胞比较。所使用 的 引 物 序 列 如 下 :NF-KB-Forward,5'CATGCGTTTCCGTT ACAAGTGCGA3';NF-KB-Reverse,5'TGGGTGCGTCTTAGTGGTATCTGT3';ANG-Forward,5'AATGGCTAGACATACCCAGCA3';ANG-Reverse,5'GCCTAAGCAGTTCACTTCCAC3';GAPDH-Forward,5'AATGGATTTGGACGCATTGGT3';GAPDH-Reverse,5'TTTGCACTGGTACGTGTTGAT3';VEGF-Forward,5'CAACGTCACTATGCAGATCATGCG3';VEGF-Reverse,5'GGTCTAGTTCCCGAAACCCTGAG3';PHD2-Forward,5'GATGCCCAGAAGCACGATGT 3';PHD2-Reverse,5'TAGAGAGTCTCGAACTCGCAG 3'。
1.3 统计分析
使用SPSS 16.0统计软件进行分析。皮瓣成活率及PCR实验数据用(x±s)来表示,组间差异比较:当方差齐时,采用单因素方差分析,两两比较采用LSD-t检验;若方差不齐,则采用Kruskal-Wallis H检验,组间两两比较采用Mann-Whitney U检验,多重检验校正采用Bonferroni校正,以α=0.05为检验水准。皮瓣血管计数采用中位数Median(P25,P75)进行描述,多组间差异比较采用Kruskal Wallis检验,两两组间比较采用Mann-Whitney检验。P<0.05为差异有统计学意义。
2 结果
2.1 预构皮瓣成活率对比
预构皮瓣二期术后第5天左右,坏死面积已稳定清晰,此时描记皮瓣存活面积,行皮瓣存活率分析,结果显示:去铁胺皮下注射和腹腔注射组的皮瓣存活率皆高于对照组(P<0.001),与延迟组疗效相当,且两种给药方式的疗效无明显差异(P=0.104)。各组的皮瓣成活率:对照组为26.66%±8.85%;DFO腹腔注射组为 52.48%±11.49%;DFO皮下注射组为60.83%±9.59%;手术延迟组为 51.74%±20.51%(图4)。
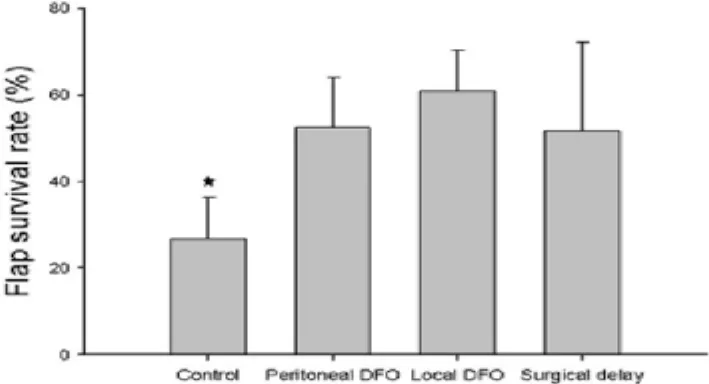
图4 去铁胺治疗后各组预构皮瓣的成活率(*P<0.001)Fig.4 Comparison of flap survival rate among groups after DFO treatment(*P<0.001)
2.2 预构皮瓣微血管计数对比
镜下观察,注射了去铁胺的实验组其血管口径较对照组要粗,而延迟组血管数目明显多于其他3组,但口径较细(图5)。
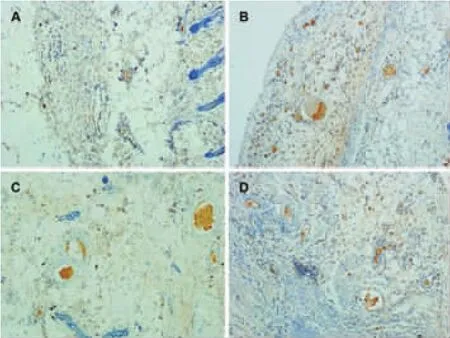
图5 大鼠预构皮瓣VEGF免疫组化染色(40×)Fig.5 Immunohistochemistry staining of VEGF for the prefabricated flaps(40×)
各组血管计数的结果使用中位数(P25,P75)进行描述,对照组、腹腔用药组、皮下给药组及手术延迟组的血管计数分别为:1(1,2)、3(2,5.5)、5.5(4,7)和20.5(14.25,33)。各组间两两比较血管密度计数均有统计学差异(P<0.05)。
2.3 体外实验PCR结果
定量PCR结果:经去铁胺处理的大鼠成纤维细胞,其PHD2的表达明显降低;同时,促血管化因子HIF-1α、VEGF 和 NF-κ B 的表达明显上调(图 6)。

图6 大鼠皮肤成纤维细胞PCR结果(*P<0.01;**P<0.001)Fig.6 Quantitative-PCR assay of the rat fibroblasts(*P<0.01;**P<0.001)
3 讨论
本实验结果显示,在预构皮瓣一期手术时应用低氧模拟剂去铁胺,可促进预构皮瓣的血管化,提高预构皮瓣的生存活力,其效果相当于在预构皮瓣二期手术之前进行了一次延迟手术。这个发现具有很好的临床价值和意义:首先,实验中所使用的去铁胺是临床已应用多年的药物,是治疗地中海贫血的一线药物,很多患者需终身用药,无明显毒副作用及对重要脏器的损害。因此,相比其他促进血管化的方法(细胞治疗、基因治疗、细胞因子等),是更加安全、简便、可行的方法,易于普及,能促进预构皮瓣技术的推广。其次,临床上大面积皮瓣转移之前,为了保证皮瓣的存活,常先给予延迟手术,增强皮瓣血流之后再行皮瓣转移术,给患者增加了手术痛苦,也多占用了医疗资源,而且由于延迟手术的切口范围是凭借经验估计的,有可能在真正的皮瓣转移术中会发现皮瓣的面积不足以覆盖受区缺损等尴尬局面,甚至有将皮瓣的重要侧支循环切断,使其失去supercharge增强血流的机会的可能。而本实验的结果证实预构一期手术时给予去铁胺,效果相当于二期手术前做了一次延迟。
低氧模拟剂预处理对组织细胞抗缺血缺氧能力的提高在多种动物模型中已有报道,同类研究一般都在组织缺血损伤之前用药,而本实验则在一期预构皮瓣的术中及术后用药。因为预构皮瓣 (一期手术)模型与其他(如下肢缺血、心肌梗死、随意皮瓣等)缺血模型有一个显著的不同,即造模后组织不发生坏死,也就是说模型本身对组织造成的缺血、缺氧损伤程度较轻。在其他模型中,若在组织已经发生缺氧损伤后用药,存在加重组织缺血坏死的顾虑,而在预构皮瓣(一期手术)模型中则不存在这样的顾虑。相较以往的预构皮瓣动物模型[7,12],本实验改进了一期手术的切口设计,使之更符合临床应用的设计方式,对腹部皮瓣造成的破坏更小,更加不存在术后缺血坏死的可能,所以我们可以在术中甚至术后给予去铁胺干预,这种差异是动物模型的不同造成的。
本实验中,皮瓣存活率的对比和血管计数的对比结果不完全一致:皮瓣成活率对照组与其他3组间有统计学差异。不论是皮下注射还是腹腔注射去铁胺,亦或在二期手术前先进行延迟,其皮瓣存活率均没有统计学差异;然而,血管计数的结果显示4组之间两两比较都是有差异的,这提示我们,血管计数的结果并不一定能完全反映最终的皮瓣活力与治疗效果。此外,我们还发现两个有趣的现象。首先,经过治疗处理的实验组,不论使用的是去铁胺还是手术延迟,其微血管的口径都普遍比对照组粗,也就是说这些干预治疗措施都刺激了小血管扩张。其次,手术延迟组的毛细血管数量明显多于另外2组,大量的细小血管出现在延迟组的组织切片上,推测这是由于延迟主要引起了choke vessel的开放所致。可见,虽然低氧模拟剂与手术延迟都能起到相同的促进预构皮瓣血管化的效果,但其作用机理是不同的:延迟主要是通过开放choke vessel,增加侧枝血流,重塑皮瓣内部的血流方向来增加皮瓣的血流,同时也存在小血管口径的增粗;而低氧模拟剂则主要通过刺激小血管口径增粗来增强皮瓣的血流。这个现象通过低氧模拟剂的信号传导通路也较容易理解。去铁胺螯合铁离子,能够竞争性地抑制PHD2活性,导致HIF-1α的快速堆积,转录活性升高,引起下游的一系列效应分子的表达水平上调和释放,其中最有代表性的就是VEGF,而VEGF的作用之一就是强烈地扩张小血管平滑肌,增加血管通透性。通过低氧模拟剂的这种作用通路,亦可表明其相对于细胞因子的优越性:细胞因子是单一的下游效应分子,而低氧模拟剂则调控了处于血管化最上游的开关PHD分子,能引起一系列级联式反应,其作用更加均衡、全面;此外,细胞因子是蛋白制剂,成本高,价格昂贵,还存在过敏反应可能;而去铁胺是化学药物,成本低廉,易存贮和运输,应用安全性相对较高。
4 结论
使用低氧模拟剂去铁胺,在预构皮瓣一期手术时运用,能显著提高预构皮瓣的血管化并增强皮瓣活力,其作用相当于在二期皮瓣转位前进行了一次延迟手术。
