局部进展期直肠癌新辅助放化疗后病理完全反应相关临床因素的研究
2019-08-05张瑾熔王海江
刘 燕, 曾 敏, 张瑾熔, 王海江
(1新疆医科大学第三临床医学院, 新疆医科大学附属肿瘤医院2胸腹放疗科, 3胃肠外科, 乌鲁木齐 830011 )
局部进展期直肠癌的标准治疗模式是新辅助放化疗联合全直肠系膜切除术(TME)[1],但因个体差异,患者对新辅助放化疗的治疗反应不尽相同。大多数患者可达到降期效果,大约10%~30%的患者达病理完全反应(pCR)[2]。有研究已证实,获得pCR的患者临床结局更好[3-4]。因此预测新辅助放化疗后pCR反应的能力对受益于这种多模式治疗的患者具有重要的临床意义。本研究回顾性分析新疆医科大学附属肿瘤医院2010年1月1日-2017年12月31日行新辅助放化疗联合TME治疗的289例局部进展期直肠癌患者的临床资料,旨在明确与新辅助放化疗后pCR反应相关的临床因素,以便更好地预测患者的治疗反应并指导临床决策。
1 资料与方法
1.1 纳入标准与排除标准(1)纳入标准:年龄18~80岁;KPS评分≥70分;初次治疗并经直肠指检、结直肠镜检查证实肿瘤距离肛缘≤12 cm;病理类型为直肠腺癌;腹盆腔CT、MRI等检查评估为局部进展期[T3/T4、N0/N+];在本院完成新辅助放化疗联合TME 治疗的患者。(2)排除标准:初诊时影像学检查提示出现肝、肺、骨等远处转移;未在本院坚持完成全程治疗者;既往患恶性肿瘤史者;病历资料不完整者。
1.2 一般资料289例病例均为新疆医科大学附属肿瘤医院2010年1月-2017年12月间收治的局部进展期直肠腺癌患者。男性162例,女性127例,年龄24~78岁,中位年龄58岁;汉族180例,其他民族 109 例(维吾尔族69例,回族 19例,哈萨克族18例,蒙古族 2 例,俄罗斯族1例)。根据术后病理评估,53例(18.3%)获得了pCR(pCR组),236例(81.7%)未达到pCR(非pCR组)。肿瘤最大径≤3 cm 146例(50.5%),>3 cm 143例(49.5%);完成新辅助放化疗至手术之间的中位间隔时间为8周(4~13周);88例患者于新辅助治疗前后行直肠MRI检查评估病情,放化疗前、后平均表现扩散系数(ADC)平均值分别为 (0.82±0.16)×10-3mm2/s和(1.28±0.28)×10-3mm2/s(表1)。
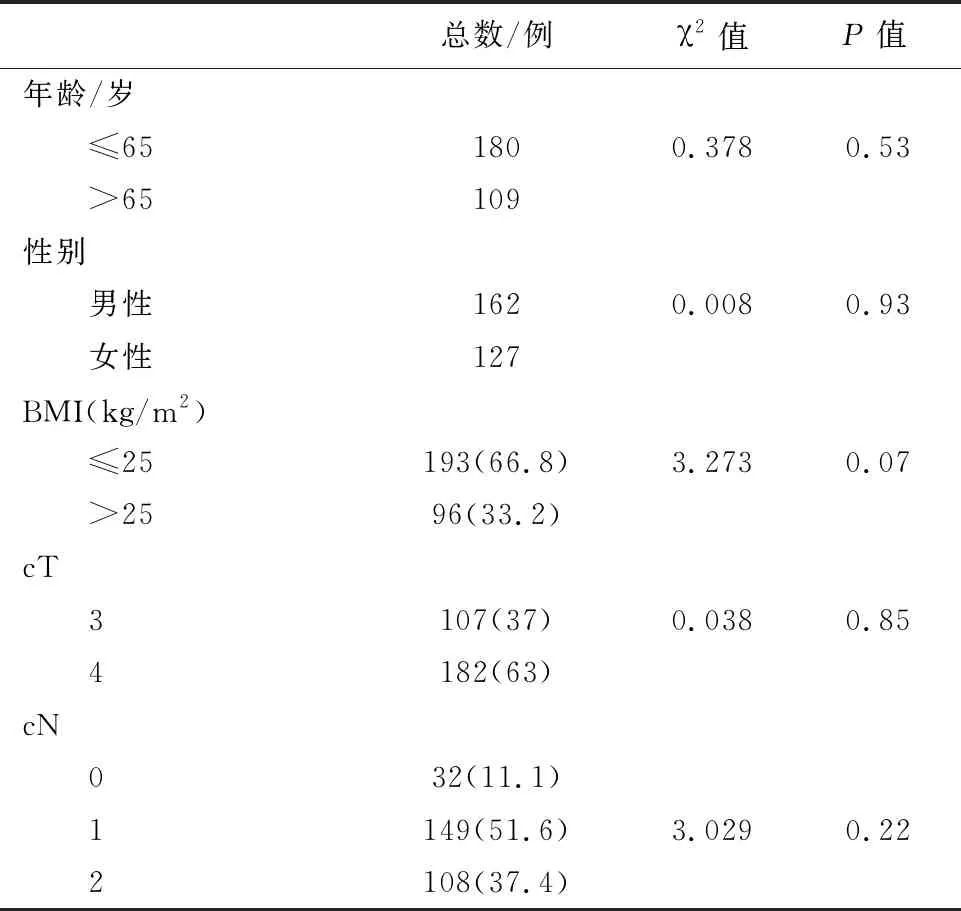
表1 289例局部进展期直肠癌患者临床资料
注:BMI:体质指数;cT:临床T分期;cN:临床N分期。
1.3 方法
1.3.1 新辅助放疗 (1)治疗前憋尿以充盈膀胱,仰卧位双手交叉抱头在模拟定位CT机下,扫描范围上界至第三腰椎,下界至坐骨结节下10 cm,层厚5 mm,将获取图像上传至Varian 放射治疗计划系统勾画靶区和危及器官。(2)大体肿瘤区(gross tumor volume,GTV)包括影像上可见的肿瘤病灶及肿大淋巴结;临床靶区(clinical target volume,CTV)包括肿瘤病灶及相应淋巴结引流区,常规需勾画直肠系膜区、骶前区(盆腔组)、髂内淋巴结区、闭孔淋巴结区;骶前区腹组淋巴结仅于影像学提示转移时需勾画;除无直肠系膜区淋巴结转移的T3期,其余均需勾画髂外淋巴结区;T4期病变侵及肛门括约肌,还需勾画坐骨直肠窝、腹股沟区淋巴结及肛门括约肌复合体,侵犯阴道下1/3也需勾画腹股沟区淋巴结;计划靶区(planning target volume,PTV)为CTV外放0.5~1.0 cm。患者采用适形调强放疗技术(intensity modulated radiation therapy,IMRT),接受PTV 照射总剂量为45~50.4 Gy,分1.8~2 Gy/25~33 d 完成放疗。
1.3.2 同期化疗 以下化学治疗方案中的1种与放射治疗同时进行:(1)卡培他滨片(850 mg/m2,每日两次,口服,放疗日服用);(2)XELOX方案:奥沙利铂130 mg/m2,静点,第1天+卡培他滨1 000 mg/m2,每日两次,口服第1~14天/21 d一周期;(3)FOLFOX方案:奥沙利铂130 mg/m2,静点,第1天+5-氟尿嘧啶400 mg/m2,静点,第1~5 天+亚叶酸钙 400 mg/m2,静点第1~5天/21 d一周期。
1.3.3 手术方案 新辅助放化疗结束后 4~13周行TME治疗。
1.3.4 观察指标 将患者根据是否达pCR分为2组,比较2组的治疗前 CEA 和CA72-4测量值、治疗前肿瘤最大径、同期化疗方案、放化疗结束与手术间隔时间、放化疗前后表观扩散系数(ADC) 值和增长率等有无显著差异。
1.4 评价标准(1)肿瘤分期根据国际抗癌联盟结直肠癌 TNM分期系统(2010年第7版)进行评价;(2)术后pCR评价标准:由2名有经验的病理医师根据美国癌症委员会病理肿瘤分期指南对切除的肿瘤标本进行评估,pCR定义为肿瘤完全消退,仅见纤维组织[5];(3)由2位MRI诊断经验丰富的中级职称及以上影像科医生采集图像数据,测量放化疗前后肿瘤ADC值,ADC值增长率=[(治疗后平均ADC值-治疗前平均ADC值)/治疗前平均ADC值];(4)经直肠镜和MRI/CT检查严格测量肿瘤侵犯直肠管腔周径范围和肿瘤最大直径。肿瘤侵犯直肠管腔周径的75%以上称为全周肿瘤[6]。
1.5 统计学分析应用SPSS 17.0统计软件进行数据分析。单因素分析使用t检验或卡方检验;多因素分析运用二分变量Logistic回归模型;ROC曲线获取最佳临界ADC值。P<0.05为差异有统计学意义。
2 结果
2.1 单因素分析结果治疗前 CEA(P=0.000)、 CA72-4(P=0.004)、 肿瘤最大径(P<0.001)、 肿瘤分化程度(P=0.012)、治疗前ADC 值(P=0.021)、治疗后ADC值(P<0.001)和增长率(P<0.001)对 pCR 有影响,其他因素与pCR无显著相关性(表2、3)。
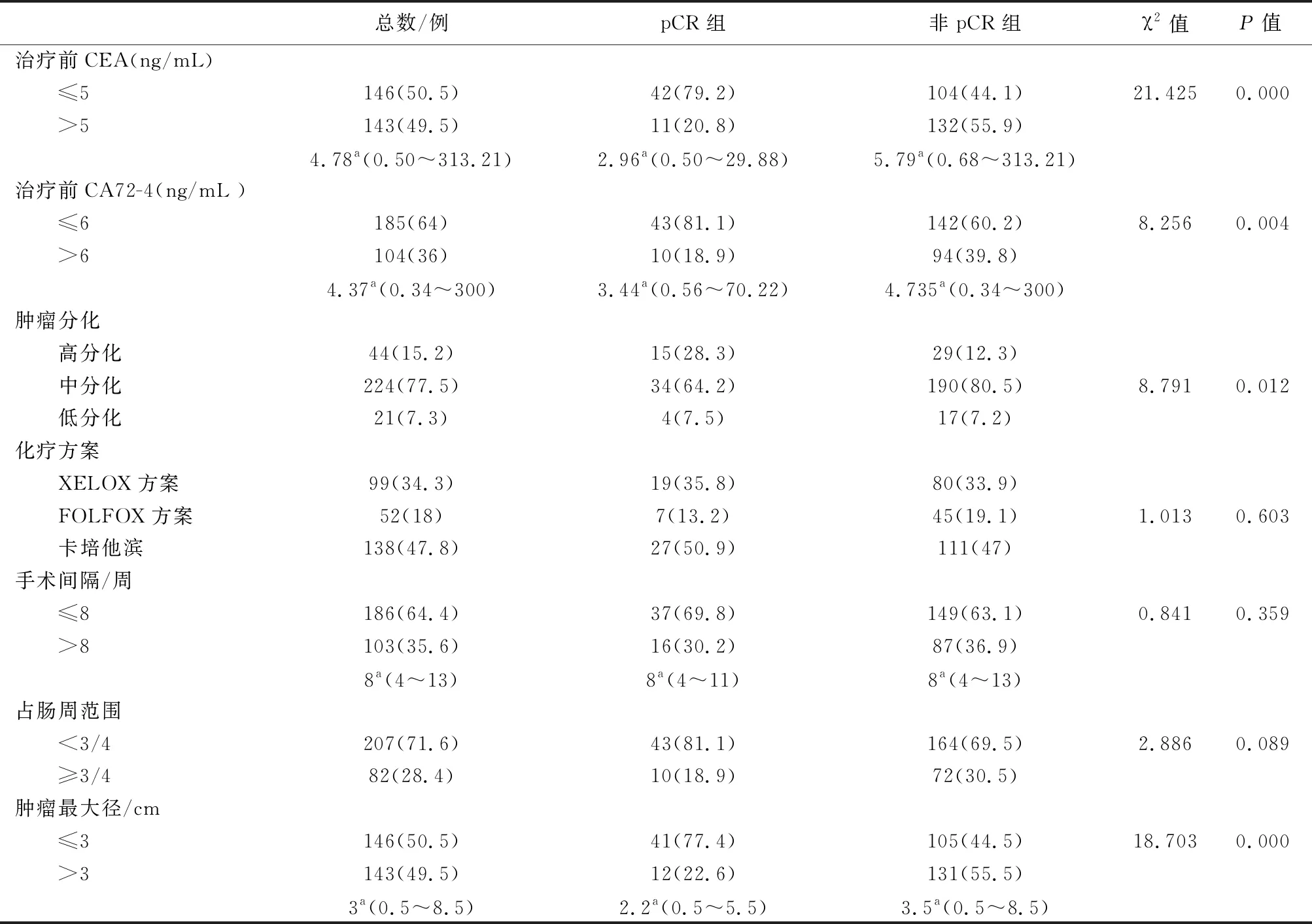
表2 289例局部进展期直肠癌患者pCR影响因素的单因素分析结果
注:a表示中位数。

表3 88例治疗前、后平均ADC值和增长率预测pCR疗效单因素分析结果(10-3mm2/s)
2.2Logistic回归多因素分析结果治疗前 CEA (P=0.07,OR=0.864)和肿瘤最大径(P<0.001,OR=0.539)是 pCR 的独立影响因素(表4)。
2.3 ADC值的ROC曲线分析绘制以新辅助放化疗前平均ADC值(P=0.021)和增长率(P<0.001)作为判断是否为pCR预测指标的ROC曲线。结果显示:治疗前平均ADC值临界值为0.635 ×10-3mm2/s时,灵敏度为0.875,AUC为0.648(95%CI=0.523-0.774)(图1);ADC值增长率取临界值0.749时,灵敏度为0.563,AUC为0.746(95%CI=0.631-0.860)(图2)。结果表明新辅助放化疗前平均ADC值和增长率可以对肿瘤是否出现pCR反应进行较高准确度的预测。
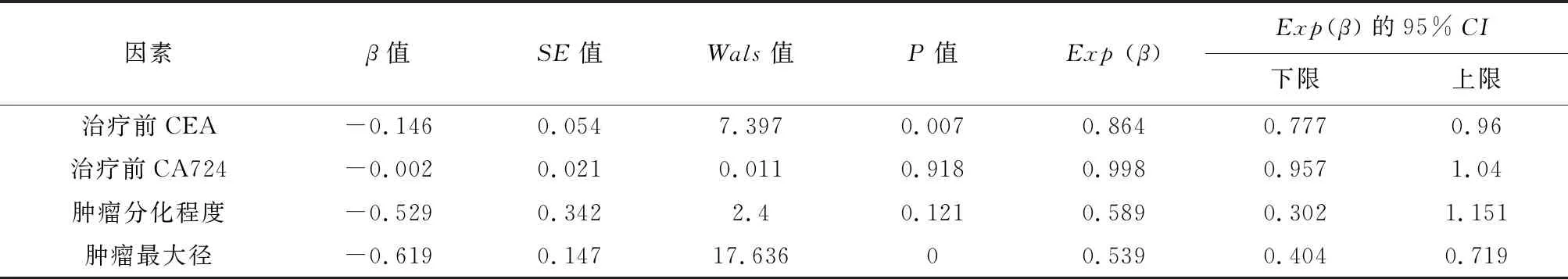
表4 289例局部进展期直肠癌患者pCR影响因素的多因素分析结果
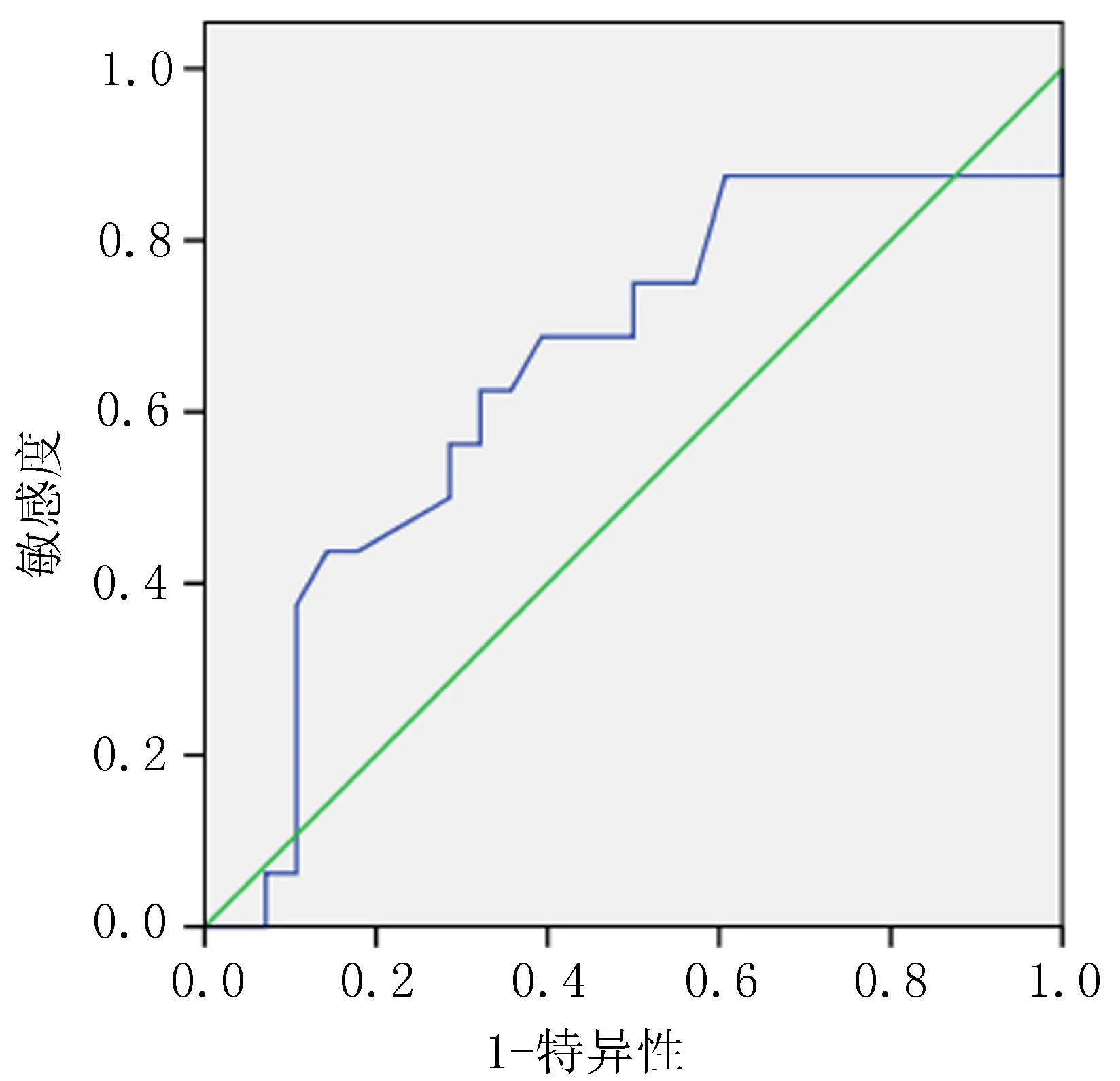
图1 治疗前平均ADC值ROC曲线
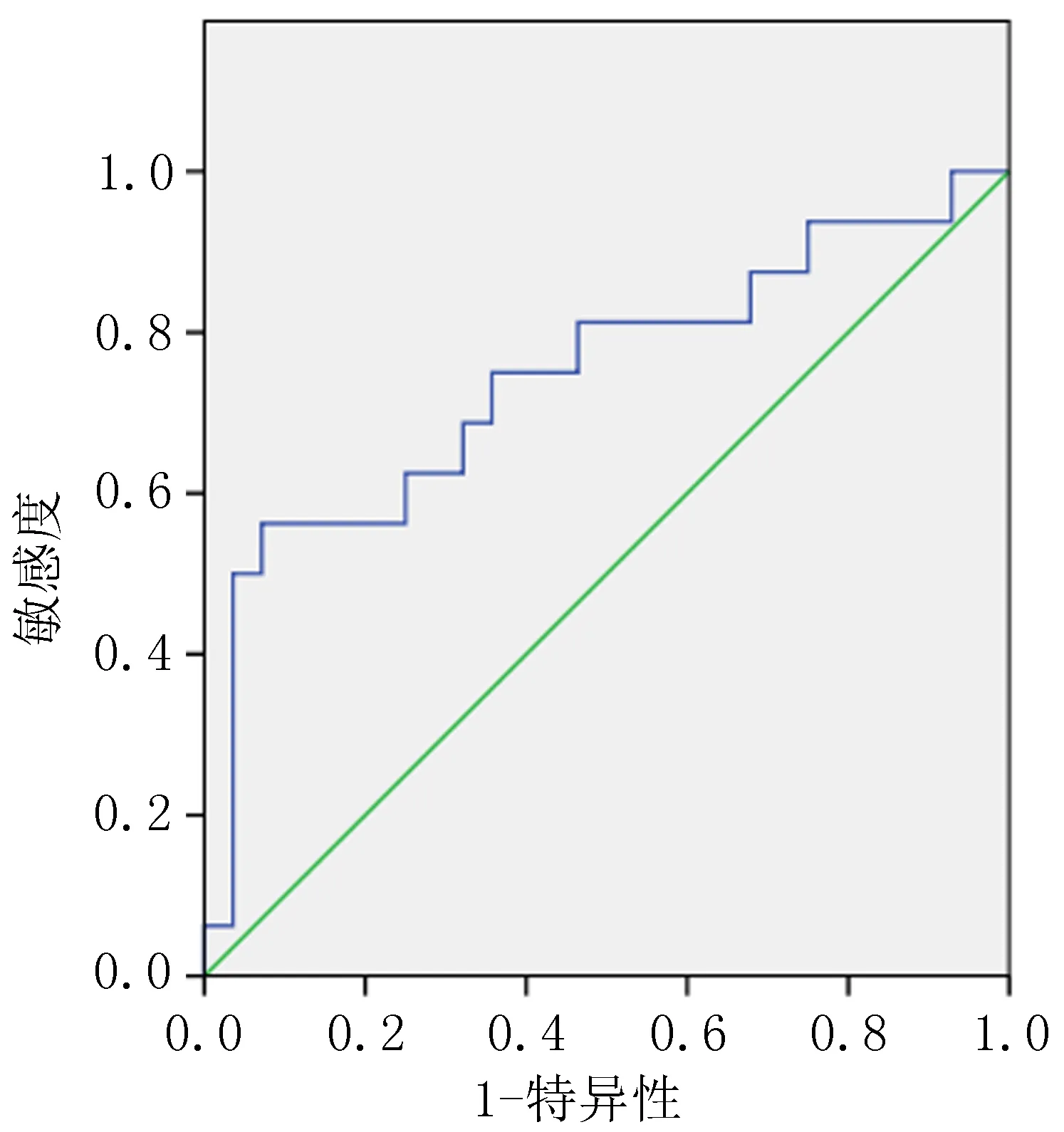
图2 ADC值增长比率ROC曲线
3 讨论
有研究表明,与肿瘤大小相关的临床因素、分子生物标记物、癌胚抗原水平、表皮生长因子受体和p21与新辅助放化疗后pCR相关[7-10]。但限于这些研究的pCR患者样本量很小,并且研究了不同的反应水平,因此,临床医生预测直肠癌新辅助放化疗后的pCR仍然是一个巨大的挑战。
彭海花等[11]发现治疗前CEA水平是pCR的独立预测因子。近年来,也有研究结果显示治疗前低水平的CEA表达与良好的肿瘤病理退缩反应相关,但CEA预测值的结果并不一致[12-14]。本研究结果表明, pCR组与非 pCR组CEA水平差异具有统计学意义(P<0.05),提示治疗前低CEA水平是pCR的独立影响因素(P=0.007),与以前的研究结果相似[11-14]。另外,CEA的升高除与肿瘤性疾病有关,在慢性炎症性疾病以及肝、肾功能不全、衰老和吸烟人群中也会升高[15],因此,在临床评估病情时还应结合患者就诊时基础病史及吸烟状况。CA72-4在消化道肿瘤患者血清中可特异性升高[16],可作为直肠癌疗效判断 、病情监测和预后估计的参考指标。本研究同时纳入CA72-4进行研究,结果显示pCR组与非pCR组患者CA72-4水平差异具有统计学意义(P=0.004),提示治疗前较低水平的CA72-4对pCR 有影响,Logistic回归多因素分析并未显示其与pCR相关(P=0.918),表明CA72-4尚不能作为pCR反应的独立影响因素。在临床工作中,血液学检查较便捷,本研究结果可在预测患者治疗反应时提供参考,建议可于治疗前联合检测CEA、CA72-4以综合评估肿瘤学结果。
刘英强等[17]报道了88例局部晚期的直肠癌新辅助放化疗治疗情况,结果显示术前肿瘤占据肠腔≤1/2周(P=0.041)是影响放化疗后肿瘤pCR的独立因素,但余涛等[18]的研究发现肿瘤体积并不是影响局部进展期直肠癌新辅助放化疗后 pCR率的独立因素。本研究中pCR组中放化疗前肿瘤占肠腔环周比例<3/4者43例(81.1%),肿瘤最大径≤3 cm 41例(77.4%),非pCR组放化疗前肿瘤占肠腔环周比例<3/4者164例(69.5%),肿瘤最大径≤3 cm 105例(44.5%),单因素分析及多因素分析显示肿瘤占据肠腔比例与pCR 反应无关,肿瘤最大径为影响pCR反应的独立因素。但临床中,影像学检查评估肿瘤大小仍存在一定局限性,CT在检测直肠癌远处转移较为有效,内镜超声(EUS)、MRI在T、N期的检出效果更好[19],并且由于图像质量及阅片医师能力的差异,可能很难判断预测pCR反应的肿瘤最大径的最佳临界值,随着诊断技术的进步,联合使用CT、EUS和MRI可以更加准确地对患者直肠癌进行诊断及术前分期。
根据一项荟萃分析,磁共振弥散加权成像(diffusion-weighted imaging,DWI-MRI)可以提高直肠癌新辅助放化疗后评估pCR的诊断价值,灵敏度从19%提高到84%。ADC值是DWI-MRI的定量评估参数,与组织的细胞数呈反比,较高的ADC表示新辅助治疗反应较好,可作为化学放射的潜在预测生物标志物[20]。本研究仅纳入88例行MRI的患者,经单因素分析结果显示,新辅助放化疗前平均ADC值(P=0.021)和ADC增长率(P<0.001)均与pCR相关。但因经济水平限制,本院行术前直肠MRI检查患者病例数较少,影响统计效能,所以未进行多因素分析。通过绘制新辅助放化疗前平均ADC值和增长率的ROC曲线对pCR进行预测,分别以0.635×10-3mm2/s和0.749作为阈值,结果提示治疗前平均ADC值和增长比率在预测pCR中具有中等诊断价值,准确度分别为0.648、0.746,并且ADC增长率比治疗前平均ADC值预测pCR准确度更高。随着本地经济水平及医疗水平的进步,近年来本院逐步开始完善初诊时直肠MRI以期提高诊断直肠癌T、N分期的准确性,因此,ADC值评估治疗反应仍需进一步收集更多病例以明确其预测价值,并筛选成像质量高、空间分辨率好的案例纳入分析。
本项回顾性研究表明,治疗前CEA水平≤5 ng/mL、原发病灶长径较短(≤3 cm)是实现pCR的独立临床预测因子,治疗前平均ADC值和增长比率预测pCR具有中等诊断价值。但限于研究样本量较少,本研究结果仍不足以推广,仅为临床医生预测患者的治疗反应并制定个性化的治疗策略提供参考。
