β一胡萝卜素一15,15’一加氧酶在利鲁牛各组织部位的表达
2019-08-03万发春魏晨张相伦谭秀文刘桂芬游伟赵红波王星凌刘晓牧靳青
万发春 魏晨 张相伦 谭秀文 刘桂芬 游伟 赵红波 王星凌 刘晓牧 靳青


摘要:本试验以利鲁牛(利木赞牛×鲁西黄牛)为研究对象,通过免疫组织化学、蛋白质印迹法( Westernblot)和荧光定量PCR等分子手段检测了BCMOI在利鲁牛肝脏、十二指肠、不同脂肪组织等部位的表达。免疫组织化学和Westem Blot检测结果均显示,BCM01在肝脏、十二指肠、心脏、肾脏和肺脏中具有较高的表达量,在脾和瘤胃内未表达;不同部位脂肪组织内BCMOI相对表达量差异较大,其中在Western Blot检测中BC-MOI在皮下脂肪仅有极少量表达,但免疫组织化学结果显示BCMOI在不同脂肪组织中的表达量相当。荧光定量PCR检测结果显示,BCM01除在十二指肠具有极高的表达量外,在肾脏、心脏、牛皮的表达量均高于肝脏。以上结果对深入研究p一胡萝卜素在肉牛体内的代谢机制提供了科学支撑。
关键词:利鲁牛;B一胡萝卜素- 15,15' -加氧酶;免疫组织化学;蛋白质印迹法;荧光定量PCR;表达量
Expression of [3 - Carotene - 15 ,15' - Monooxygenase(BCM01) in Tissues of Lilu Cattle Wan Fachun, Wei Chen, Zhang Xianglun, Tan Xiuwen, Liu Guifen, You Wei,Zhao Hongbo, Wang Xingling, Liu Xiaomu, Jin Qing
Abstract
The study analyzed the expression of BCM01 in twelve tissues (liver, duodenum, adipose tis-sues and so on) of Limusin X Luxi( Lilu) bull by immunohistochemistry, Western - blot and qRT - PCR. Im-munohistochemical and Western - blot results showed that BCM01 was highly expressed in liver, duodenum,heart and lung, but no expression was detected in spleen and rumen, and the relative expression levels of BC-M01 in different adipose tissues were different. The Western - blot results showed that BCMOI was only ex-pressed in a very small amount in subcutaneous fat tissue, but the immunohistochemical results showed thaithe expression levels of BCM01 in the three fat tissues were similar. Extremely higher BCM01 mRNA relativeexpression was detected in duodenum by qRT - PCR, and the levels in kidney, heart, and skin were all high-er than that in liver. These results provided scientific supports for further research on the metabolic mechanismof beta carotene in beef cattle.
Keywords
Lilu cattle;β- carotene - 15.15' - momoxygenase; Immunohistochemistry; Western -blot; RT - qPCR; Expression quantity
β-胡萝卜素- 15,15' -加氧酶(β-carotene -15,15-momoxygenase 1,BCM01)是类胡萝卜素向维生素A转化过程中的关键酶,催化β-胡萝卜素的中间断裂,生成2分子视黄醛,进一步转化为不同形式的维生素A。BCM01对类胡萝卜素中15,15位置的双键有高度的特异性,在大鼠上β-胡萝卜素的这种中心裂解是产生维生素A的主要途径[1]。人类吸收的35%~90%全反式β-胡萝卜素是在BCM01催化下裂解进而合成维生素A。Hessel等在敲除小鼠BCM01的试验中发现,BCM01功能的缺失能够导致维生素A缺乏,当进一步喂食富含β-胡萝卜素的日粮后,小鼠的肝脏、肺脏和脂肪组织均有大量的β-胡萝卜素积累[2]。可见BCM01在動物体内维生素A合成过程中发挥着不可替代的作用。
目前,BCM01基因已在人、鼠、猪、牛等哺乳动物以及果蝇、鸡、海洋细菌、斑马鱼等物种内被克隆[3],其中Lindqvist等[4]首次获得完整的人类BCM01的分子克隆。早期研究只在人、小鼠、大鼠、豚鼠、兔子、猴子等哺乳动物的肠黏膜中检测到BCM01的活性[5,6],后续发现其在人多数器官组织的上皮细胞中表达[7,8]。上皮细胞通常是对维生素A缺乏非常敏感的结构,尽管BCM01的体外功能尚不清楚,但其在被检测组织的上皮细胞中均有表达,暗示BCM01对维生素A的局部合成非常重要。当膳食中维生素A摄人量不足时,BCM01构成了维生素A合成的一条备用途径。
在牛上,BCM01对胡萝卜素的催化活性首先在卵巢和黄体上被发现[9,10],随后在肝脏和肠道不同部位及性腺组织内被陆续报道[ll]。但BC-M01在肉牛上述组织之外的细胞类型中的表达情况和可能起到的作用仍有待于进一步探索。基于此,本试验对BCM01在肉牛体内12个组织部位的表达情况进行检测,以期为深入研究肉牛体内β-胡萝卜素的代谢机制提供科学支撑。
1 材料与方法
1.1 样品采集
选取4头利鲁牛(利木赞牛×鲁西黄牛)成年育肥公牛作为试验用牛。采集心脏、肝脏、肾脏、肺脏、脾脏、瘤胃、十二指肠、牛皮、背最长肌、皮下脂肪、肌间脂肪、腹腔脂肪共12个组织部位样品,一部分分装于冷冻管中并立即投入液氮中带回实验室-80℃冰箱保存(用于mRMA和蛋白表达检测),另一部分浸泡于含4%多聚甲醛的样品瓶中(用于免疫组织化学检测)。
1.2 主要试剂
超纯RNA提取试剂盒(Ultrapure RNA Kit)购自康为世纪生物有限公司;逆转录试剂盒( HiS-cript⑧ⅡReverse Transcriptase)和荧光定量检测试剂盒( ChamQ'TM SYBR Color qPCR Master Mix)均购自南京诺唯赞生物科技有限公司。
1.3 引物设计与合成
根据GenBank公布的牛BCM01基因的mR-NA序歹0號,利用Primer 5.0和NCBI中BLAST工具设计实时荧光定量检测引物,以β-actin作为内参基因。引物由铂尚生物技术(上海)有限公司合成,具体信息如下:
1.4 BCM01蛋白水平表达的免疫组织化学检测
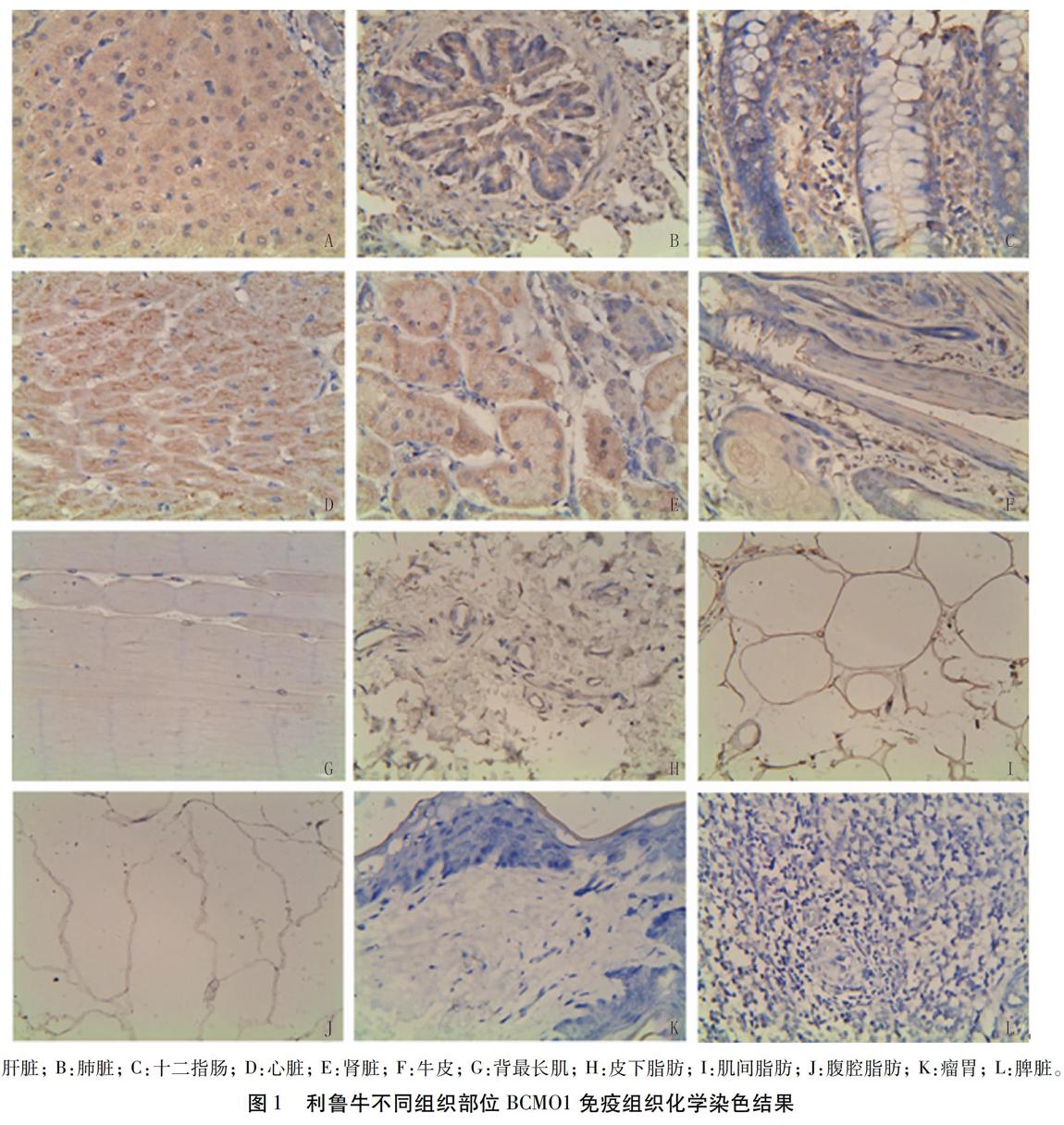
组织部位样品用4%多聚甲醛固定,酒精和二甲苯脱水,石蜡包埋,再经切片、制片后室温脱蜡、水化,后对内源酶进行灭活,加入山羊血清封闭非特异位点,再加I抗4℃过夜,然后经Ⅱ抗、链霉菌抗生物素一过氧化物酶溶液孵育,后用DAB溶液显色,苏木素染核,再经盐酸酒精分化,石蜡脱水,最后用中性树胶封片,置于显微镜下进行观察、拍照。
1.5 BCM01蛋白表达水平Western Blot检测
取适量肉牛组织加100 μL含PMSF的RIPA蛋白裂解液,4℃裂解30 min,期间EP管要经常晃动以促进细胞充分裂解;4℃下12000 r/min离心10min,将上清液转移至新离心管中,得组织蛋白样品。BCA法检测蛋白浓度,根据浓度计算30μg不同蛋白样品的上样体积,将不同上样体积的蛋白样品分别与5×十二烷基硫酸钠(SDS)缓冲液混匀,沸水中煮沸5 min,于冰浴中迅速冷却,后上样进行SDS-PAGE电泳(25 mA恒流电泳至溴酚蓝跑完浓缩胶层,时间大约为30 min。分离胶电泳电流为30 mA,当溴酚蓝迁移至分离胶下缘时,关掉电源,停止电泳);电泳后转PVDF膜,电流为200 mA;将PVDF膜浸入含5%脱脂奶粉封闭液中室温摇床封闭1h;取出已封闭的PVDF膜,浸于TBST缓冲液中洗涤后移人含有一抗的小袋中,4℃孵育过夜,TBST缓冲液摇床洗涤3次,每次15min;将PVDF膜转移到含二抗的玻璃平皿中室温摇床孵育2h,TBST缓冲液摇床洗涤3次,每次15min;将PVDF膜置于保鲜膜上,取适量ECL试剂盒中等体积的A液和B液混合,混匀后加在膜的表面,移人凝胶成像分析仪中,化学光敏模式曝光显影。
1.6 BCM01基因实时荧光定量PCR
取各组织样品约50mg,液氮研磨后加入1mL Trizol,提取总RNA,微量分光光度计检测总RNA浓度,1%琼脂糖凝胶电泳检测RNA完整性。按照逆转录试剂盒进行反转录,反应体系20μL: RNA 3μL,4×gDNA wipe Mix 4μL, RNAase -free ddH20 9μL,5×HiScriptⅡqRT SuperMixⅡ4μL;反应程序:42℃ 2 min,50℃ 15 min,85℃ 5s。逆转录所得cDNA模板按照荧光定量试剂盒进行实时荧光定量PCR检测。反应体系20μL:cDNA lμL,上下游引物各0.4μL,2×ChamQTMSYBR Color qPCR Master Mix 10μL,ddH20 8.2μL。反应程序:95C预变性30 s;95qC变性10 s,60℃退火30 s,40个循环;95℃延伸15s,60℃收集荧光1min。每个样品测定重复3次。
1.7数据处理与分析
将免疫组织化学染色结果和Western Blot胶片扫描图片用Quantity One图像分析软件分析目标条带的光密度值,所得数据利用SAS 9.1软件的一般线性模型进行单因素方差分析进行统计,利用Duncan,s法进行多重比较,P<0.05表示差异显著。
2 结果与分析
2.1 免疫组织化学检测结果
免疫组织化学检测结果显示,在所有检测的组织部位中,BCM01在十二指肠、心脏和肾脏中表达量相当(P>0.05),显著高于其它组织部位(P<0.05),其次为肺脏;在牛皮内的表达量略高于肝脏;在不同部位脂肪组织中表达量差异不大;在背最长肌中表达量显著低于其它组织(P<0.05);在瘤胃和脾脏中未检测到BCM01的表达(图l、图2)。
2.2 BCM01蛋白Western Blot检测结果
蛋白印迹检测结果显示,在所有检测的组织部位中,BCM01在肺脏内的表达量最高,其次为十二指肠和心脏,在肝脏和肾脏内的表达量相当(P>0.05);在不同部位脂肪组织中,肌间脂肪组织内表达量最高,腹腔脂肪中的略低,而在皮下脂肪组织中表达量显著低于其它部位(P<0.05);瘤胃和脾脏中未检测到BCM01的表达(图3)。
2.3 BCM01荧光定量PCR检测结果
BCM01基因mRNA在十二指肠表达水平极高,为肝脏的378倍,其次为肾脏、心脏、牛皮,表达量分别为肝脏的130倍、16倍和3.7倍,牛皮内的表达量为肝脏的3.7倍,其它组织部位BC-M01相对表达量均低于肝脏,但差异不显著(P>0.05),瘤胃内检测到微量的表达,脾脏内未检测到BCM01的相对表达(图4)。
3 讨论與结论
20世纪60年代,Lietz等[12]通过大鼠试验研究发现,β-胡萝卜素转变为维生素A是由一种小肠粘膜和肝脏中的可溶性β-胡萝卜素- 15,15'-加氧酶通过一种假定的横跨B-胡萝卜素分子中间15,15双键上的双氧四环结构媒介物完成。目前对这种酶的性质已经了解,它是一种水溶性胞浆酶,最适pH值稍偏碱性,裂解中需使用分子氧[13]。由于在最早的研究中没有发现任何其它的反应产物,因此称这种酶为β-胡萝卜素- 15,15' -加氧酶,主要存在于小肠粘膜和肝脏细胞的胞浆中[14]。
小肠是β-胡萝卜素在动物体内的主要吸收场所,具有较强的转化维生素A的能力;肝脏是β-胡萝卜素在肉牛体内的主要存储和转化场所,因此BCM01在肝脏和小肠中均具有较高的表达量[15],与本研究检测结果一致。BCM01也是动物体脂肪代谢的重要调控者,通过BCM01基因敲除小鼠试验发现,血清脂质水平发生改变并且引起其肝脏脂肪变性[2]。本团队早期研究也发现,日粮添加B -胡萝卜素可显著降低肉牛背部皮下脂肪厚度,但对肌间脂肪含量并无显著影响,在此过程中BCM01可能发挥着重要作用[16],暗示β-胡萝卜素或BCM01对脂质代谢具有重要的调节作用。
Lindqvist等[7]通过免疫组织化学染色发现,BCM01在人多数部位的上皮细胞中均有表达,包括胃粘膜和腺细胞、小肠、结肠、肝脏实质细胞、胰腺外分泌腺细胞、前列腺腺细胞、子宫内膜、乳腺组织、肾小管细胞、皮肤鳞状上皮细胞的角质形成细胞,此外,在睾丸、卵巢、肾上腺以及骨骼肌细胞中的类固醇生成细胞中也有表达。除上述组织部位之外,BCM01在视网膜色素上皮细胞中大量表达[8,17]。β-胡萝卜素除为动物提供机体所需的维生素A、参与脂肪代谢调控外,还在保护皮肤、提高免疫力、延缓衰老、预防心血管疾病以及防治白内障、关节炎、糖尿病、肾小球炎等慢性疾病方面具有一定的功效,这可能是本研究中在肉牛体内除十二指肠、肝脏和脂肪组织外,在心脏、肾脏、肺脏、皮肤等组织器官内检测到BCM01表达的重要原因之一,具体机制有待进一步研究。
反刍动物的瘤胃微生物无法合成维生素A,只能通过鱼粉、血粉等动物性饲料补充或通过饲喂青草、青贮料等富含胡萝卜素的粗饲料在肝脏内转化合成维生素A,这可能是本研究中未检测到BCM01在肉牛瘤胃内表达的原因之一。脾脏是动物机体最大的免疫器官,是机体细胞免疫和体液免疫的中心,本研究未检测到BCMOI在肉牛脾脏内表达,暗示β-胡萝卜素可能通过其它途径提高肉牛免疫力,与毕宇霖等[18]的研究结果(β-胡萝卜素通过提高机体抗氧化能力从而提高肉牛免疫力)相吻合。
综上,BCMOI在肉牛体内的普遍表达不仅能为各组织器官提供正常生理功能所需的维生素A,在维持与调节心、肺、肾功能方面也具有重要作用,而其具体作用和调控机制有待进一步研究。
参考文献:
[1] Paik J,During A,Harrison E H,et al.Expression and char-acterization ofa murine enzyme able to cleave beta - carotene.The formation of retinoids[J].Journal()f Biological Chemistry,2001,276(34): 32160 - 32168.
[2]Hessel S,Eichinger A,Isken A,et al.CM01 defiCiencv abol-ishes vitamin Aproduction from beta - Carotene and alters lipidmetaholism in miCe[J].Joumal of Biologcal Chemistry.2007.282(46):33553 - 33561.
[3] 靳青,毕宇霖,刘晓牧,等.类胡萝卜素代谢及功能研究进展[J].动物营养学报,2014,26(12):3561 - 3571.
[4] Lindqvist A,Andersson S. Biochemical properties of purifiedrecombinant human beta - carotene 15, 15- monooxygenase[J].Journal of Biological Chemistry, 2002, 277 (26) :23942 - 23948.
[5]von Lintig J. Colors with functions : elucidating the biochemicaland molecular basis of carotenoid metabolism[J] . Annual Re-view of Nutrition , 2010 . 30 : 35 - 56.
[6]During A, Nagao A, Hoshino C. et al. Assay of β- carotene15 .15 ' - dioxygenase activity by reverse - phase high pressureliquid chromatography [J] .Analytical Biochemistry , 1996 , 241(2) : 199 -205.
[7]Lindqvist A, Andersson S. Cell type - specific expression ofβ- carotene 15,15 ' - mono - oxygenase in human tissues [J] .Journal of Histochemistry & Cytochemistry, 2004 . 52 (4) :491 - 499.
[8]Yan W, Jang C F, Haeseleer F, et al. Cloning and character-ization of a human beta , heta - carotene - 15 , 15 ' - dioxygenasethat is highly expressed in the retinal pigment epithelium [J] .Genoruics . 2001 , 72 (2) : 193 - 202.
[9]Sklan D. Carotene cleavage activity in the corpus luteum of cat-tle[J] Intemational Journal for Vitamin and Nutrition Re-search.1983 .53 (l) : 23 - 26.
[10] Schweigert F, Wierich M. Rambeck W. et al. Carotene cleav-age activity in bovine ovarian follicles [J] Theriogenology,1988. 30(5) : 923 -930.
[11] Morales A, Rosas A. Gonzalez A. et al. Cloning of the bovinebeta - carotene - 15 . 15 ' - oxygenase and expression in gonadaltissues [J] . Infemational Joumal for Vitamin and Nutrition Re-search.2006 .76(l) : 9 - 17.
[12] Lietz C, Lange J. Rimbach G. Molecular and dietary regula-tion of beta, heta - carotene 15. 15' - monooxygenase I(BCM01) [J] Archives of Biochemistry and Biophysics,2010 . 502(1) :8 - 16.
[13] von Lintig J, Vogt K. Filling the gap in vitamin A research.Molecular identification of an enzyme c:leaving beta - caroteneto retinal [J] .Journal of Biological Cheruistry ,2000 .275 (16) :11915 - 11920.
[14] Redmond T M. Centleman S, Duncan T, et al. Identification,expression . and substrate specificity of a mammalian heta - car-otene 15 . 15 - dioxygenase [J] . Journal of Biological Chemis-try, 2001 .276 (9) : 6560 - 6565.
[15] Shmarakov I O.Yuen J J. Blaner W S. Carotenoid metabolismand enzymology [M]//TANUMIHARDJO S A. Carotenoidsand human health. Nutrition and health. New York: HumanaPress. 2013 :29 - 56.
[16] Jin Q, Cheng H, Wan F. et al. Effects of feeding β- caroteneon levels of β- carotene and vitamin A in blood and tissues ofheef cattle and the effects on heef quality [J] . Meat Sciem:e,2015 . 110 : 293 - 301.
[17] Chichili G, Nohr D. Schaffer M. et al. β - carotene c:onver-sion into vitamin A in huruan retinal pigment epithelial cells[J] Investigative Ophthalruology & Visual Science. 2005 .46 : 3562 - 3568.
