基于最大截面特征的病变宫颈细胞核的自动筛查
2019-08-01韩颖赵萌陈胜勇王照锡
韩颖 赵萌 陈胜勇 王照锡

摘 要:针对基于细胞图像分割的病变宫颈细胞筛查中由于细胞精细分割复杂而不能实现筛查自动化的问题,提出一种省略精细分割步骤的宫颈细胞分类算法。首先,定义一种新的用于描述像素值分布的特征——最大截面(MAXSection)特征,将该特征与反向传播(BP)神经网络和Selective Search算法结合,实现细胞核感兴趣区域(ROI)的准确提取(最高正确率100%);其次,基于最大截面特征定义了两个参数——估计长与估计宽,用于描述病变细胞核的形态变化;最后,根据宫颈细胞发生癌变时其核会绝对增大的特点,利用以上两参数实现病变细胞核(估计长与估计宽中至少一个参数大于65)与正常细胞核(估计长与估计宽均小于等于65)的分类。实验结果表明,该自动筛查算法的准确率为98.89%,敏感度为98.18%,特异度为99.20%。该算法可以完成从输入整幅巴氏涂片到输出最终筛查结果的全部过程,实现病变宫颈细胞筛查的自动化。
关键词:病变宫颈细胞筛查;精细分割;反向传播神经网络;Selective Search算法
中图分类号:TP391.7
文献标志码:A
文章编号:1001-9081(2019)04-1189-07
Abstract: Aiming at the problem that the complexity of cervical cell image fine segmentation makes it difficult to achieve automatic abnormal cell screening based on cell image segmentation, a cervical cell classification algorithm without fine segmentation step was proposed. Firstly, a new feature named MAXimum Section (MAXSection) was defined for describing the distribution of pixel values, and was combined with Back Propagation (BP) neural network and Selective Search algorithm to realize the accurate extraction of nucleus Region Of Interest (ROI) (the highest accuracy was 100%). Secondly, two parameters named estimated length and estimated width were defined based on MAXSection to describe morphological changes of abnormal nucleus. Finally, according to the characteristic of absolute enlargement of cervical nucleus when cervical cancer occurs, the classification of abnormal nucleus (at least one parameter of estimated length and width is greater than 65) and normal nucleus (estimated length and width are both less than 65) can be realized by using the above two parameters. Experimental results show that the proposed algorithm has screening accuracy of 98.89%, sensitivity of 98.18%, and specificity of 99.20%. The proposed algorithm can complete the total process from the input of whole Pap smear image to the output of final screening results, realizing the automation of abnormal cervical cell screening.
Key words: abnormal cervical cell screening; fine segmentation; Back Propagation (BP) neural network; Selective Search algorithm
0 引言
世界衛生组织国际癌症研究机构(International Agency for Research on Cancer)统计数据显示,全球范围内宫颈癌的发病率、患病率和死亡率在所有女性罹患的癌症中均位居前五[1]。2018年2月,国家癌症中心发布了最新的全国癌症统计数据:在我国,宫颈癌的发病率在所有女性罹患的恶性肿瘤中排名第六[2]。而宫颈癌的发生和发展有一个渐进的演变过程,早期的癌前病变的治愈率非常高,因此宫颈癌的预防与筛查显得尤为重要。基于巴氏涂片或液基细胞学涂片的细胞学筛查被认为是最常用且有效的方法,其操作简单、成本低廉,通过人工或者计算机辅助手段完成宫颈病变筛查。人工阅片方法受限于阅片人的临床经验及阅片人其他的主观意识等因素,与计算机辅助阅片相比,其工作效率较低。对计算机辅助细胞学检查的研究从20世纪开始,通过结合计算机技术与病理学知识,诊断由于细胞病变而引发的癌症。
计算机辅助宫颈细胞病变筛查的本质是通過提取并分析细胞或细胞核的形态学特征,来确定细胞是否发生癌变。大多数传统的宫颈细胞筛查方法往往是基于细胞的精确分割结果[3],从而提取到基于分割结果的细胞形态特征,如长轴、短轴、面积、形状等,对细胞的形态进行定量分析,结合阈值法[4]、聚类法[5]、支持向量机(Support Vector Machine, SVM)[6-8]、神经网络[9-12]或多分类器融合[13-15]等方法完成细胞识别。利用这种基于精细分割结果的特征对细胞进行分类,其分类准确率必然受到分割结果准确性的直接影响,尤其在出现欠分割问题时,细胞形态特征值不准确甚至错误,会对接下来的分类产生严重的负面影响。在未涉及分割算法的研究中,基于细胞形态学的定量特征可直接获取,即真实的分割数据默认存在[16-18]。由于宫颈涂片染色与制片技术的差异性、宫颈细胞形态的多样性等原因,宫颈细胞的精细分割结果鲁棒性不佳,其仍然是一个具有挑战性的研究课题。随着深度学习的发展,深度特征作为一种在大数据中自动学习而得到的特征在分类领域中取得了不错的成绩。深度特征不受分割精度影响,Zhang等[19-21]将其应用于宫颈细胞识别中。但是,由于医学图像样本数量往往不能满足深度学习的需求,数据扩增、迁移学习等策略普遍应用,增加了算法的复杂度。
为避免宫颈细胞分割对分类结果的影响,省略传统分割步骤的细胞核分类算法应运而生。Zhao等[22]通过对整幅图像进行平均分割,并根据各个分割块的图像特征完成细胞核的分类。受此文启发,本文提出一种基于最大截面(MAXimum Section, MAXSection)特征病变宫颈细胞核的自动筛查算法,旨在对包含细胞团簇的巴氏涂片进行病变细胞筛查,实现从输入整幅巴氏涂片图片到输出最终宫颈癌细胞的筛查结果的全部过程。首先从整幅巴氏涂片图像中提取感兴趣区域(Region Of Interest, ROI),并根据其中像素值的分布,定义了名为最大截面的特征,该特征结合反向传播(Back Propagation, BP)神经网络实现细胞核ROI筛选。为弥补省略细胞精细分割步骤而缺少的细胞核定量特征,利用基于最大截面特征的估计长与估计宽来描述细胞核的形态。该算法在避开宫颈细胞分割难题的同时,准确地实现了基于细胞核形态变化的宫颈癌细胞筛查。
1 病变宫颈细胞核筛查模型
宫颈细胞筛查的目的是识别出病变细胞,进而实现宫颈癌的预防与治疗。本文通过对宫颈细胞核形态变化的分析,提出了一种基于最大截面特征的病变宫颈细胞筛查算法。该算法可分为两个部分:1)基于BP神经网络的细胞核筛选;2)基于统计阈值的细胞核分类。首先利用Selective Search算法提取可能包含细胞核的ROI并构建数据库;之后,定义了一个名为最大截面的特征用于描述ROI像素的分布,并以此作为输入,训练和测试BP神经网络;进而,利用训练好的网络预测未分类ROI的类别(细胞核或非细胞核);最后,定义了两个基于最大截面特征的参数——估计长与估计宽用于描述细胞核的大小,统计分析正常细胞核与病变细胞核估计长度与估计宽度的值并确定阈值,并根据该阈值将细胞核分为病变细胞核与正常细胞核,实现对病变宫颈细胞的筛选。本文算法流程如图1所示,该算法完成了从输入未经处理的巴氏涂片到输出筛查结果的全部过程。
1.1 Selective Search算法
Selective Search算法[23]最初是由Uijlings等提出的,用于为目标识别提取ROI,即在图像中寻找并定位可能包含目标的区域。Selective Search将基于图的图像分割算法和分层算法相结合,基于初始分割域之间的相似性,一次完成多尺度多目标的提取,具体步骤如下:
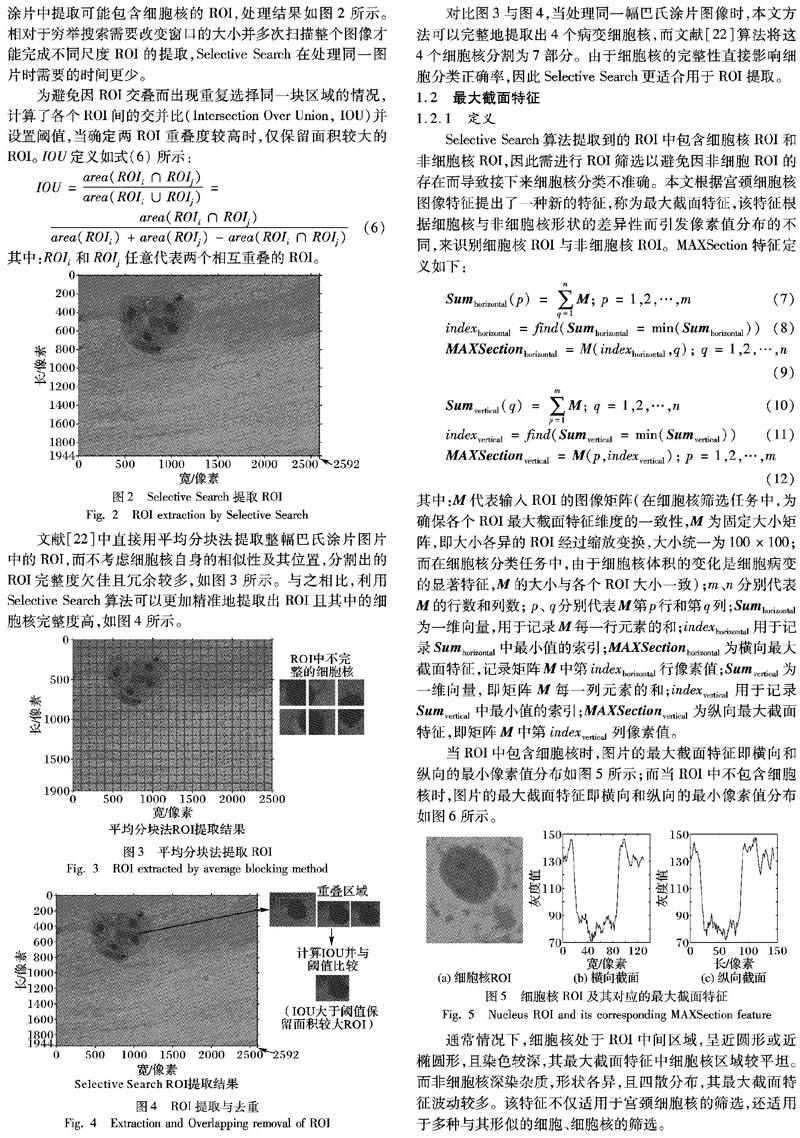
通常情况下,在整幅未处理的巴氏涂片图片中包含着大小各异、形状不规则且染色深浅不同的宫颈细胞核,为完成接下来的基于细胞核形态变化的宫颈癌细胞筛查,本文首先采用适合于多尺度图像处理的Selective Search算法从整幅巴氏涂片中提取可能包含细胞核的ROI,处理结果如图2所示。相对于穷举搜索需要改变窗口的大小并多次扫描整个图像才能完成不同尺度ROI的提取,Selective Search在处理同一图片时需要的时间更少。
为避免因ROI交叠而出现重复选择同一块区域的情况,计算了各个ROI间的交并比(Intersection Over Union, IOU)并设置阈值,当确定两ROI重叠度较高时,仅保留面积较大的ROI。IOU定义如式(6)所示:
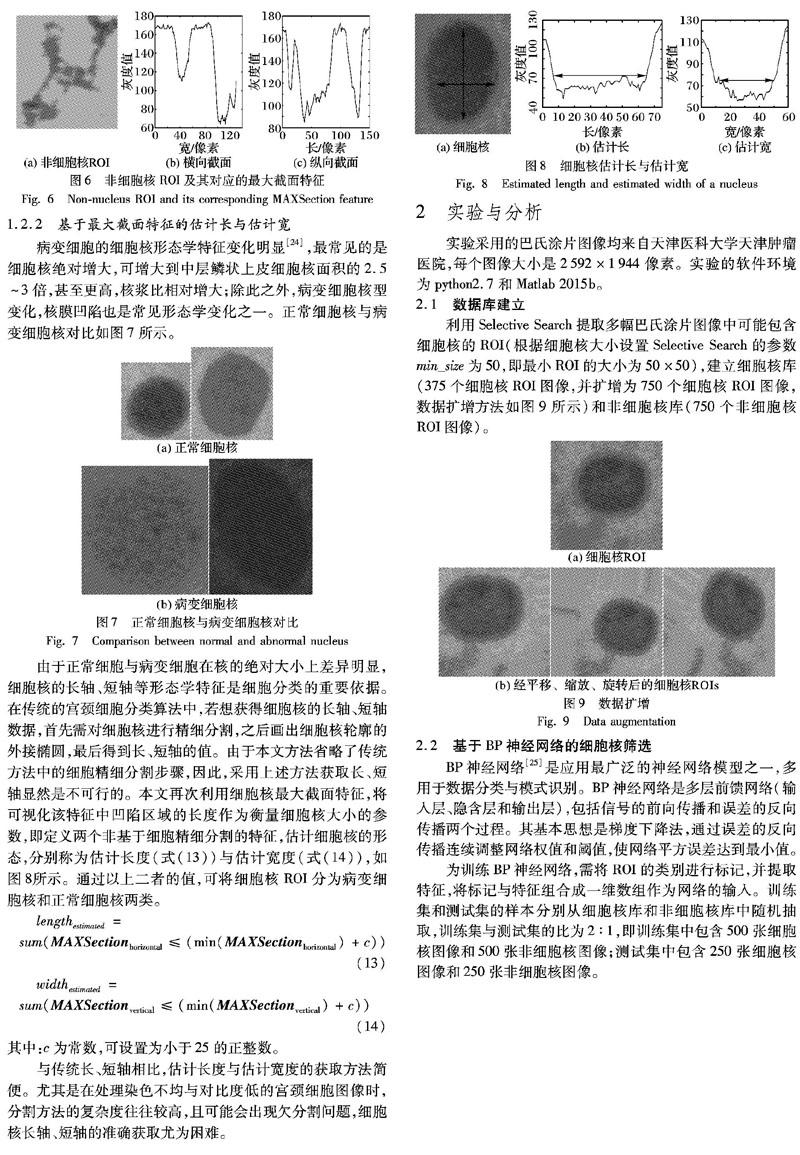
文献[22]中直接用平均分块法提取整幅巴氏涂片图片中的ROI,而不考虑细胞核自身的相似性及其位置,分割出的ROI完整度欠佳且冗余较多,如图3所示。与之相比,利用Selective Search算法可以更加精准地提取出ROI且其中的细胞核完整度高,如图4所示。
对比图3与图4,当处理同一幅巴氏涂片图像时,本文方法可以完整地提取出4个病变细胞核,而文献[22]算法将这4个细胞核分割为7部分。由于细胞核的完整性直接影响细胞分类正确率,因此Selective Search更适合用于ROI提取。
1.2 最大截面特征
1.2.1 定义
Selective Search算法提取到的ROI中包含细胞核ROI和非细胞核ROI,因此需进行ROI筛选以避免因非细胞ROI的存在而导致接下来细胞核分类不准确。本文根据宫颈细胞核图像特征提出了一种新的特征,称为最大截面特征,该特征根据细胞核与非细胞核形状的差异性而引发像素值分布的不同,来识别细胞核ROI与非细胞核ROI。MAXSection特征定义如下:
其中:M代表输入ROI的图像矩阵(在细胞核筛选任务中,为确保各个ROI最大截面特征维度的一致性,M为固定大小矩阵,即大小各异的ROI经过缩放变换,大小统一为100×100;而在细胞核分类任务中,由于细胞核体积的变化是细胞病变的显著特征,M的大小与各个ROI大小一致);m、n分别代表M的行数和列数; p、 q分别代表M第p行和第q列;Sumhorizontal为一维向量,用于记录M每一行元素的和;indexhorizontal用于记录Sumhorizontal中最小值的索引;MAXSectionhorizontal为横向最大截面特征,记录矩阵M中第indexhorizontal行像素值;Sumvertical为一维向量,即矩阵M每一列元素的和;indexvertical用于记录Sumvertical中最小值的索引;MAXSectionvertical为纵向最大截面特征,即矩阵M中第indexvertical列像素值。
当ROI中包含细胞核时,图片的最大截面特征即横向和纵向的最小像素值分布如图5所示;而当ROI中不包含细胞核时,图片的最大截面特征即横向和纵向的最小像素值分布如图6所示。
通常情况下,细胞核处于ROI中间区域,呈近圆形或近椭圆形,且染色较深,其最大截面特征中细胞核区域较平坦。而非细胞核深染杂质,形状各异,且四散分布,其最大截面特征波动较多。该特征不仅适用于宫颈细胞核的筛选,还适用于多种与其形似的细胞、细胞核的筛选。
1.2.2 基于最大截面特征的估计长与估计宽
病变细胞的细胞核形态学特征变化明显[24],最常见的是细胞核绝对增大,可增大到中层鳞状上皮细胞核面积的2.5~3倍,甚至更高,核浆比相对增大;除此之外,病变细胞核型变化,核膜凹陷也是常见形态学变化之一。正常细胞核与病变细胞核对比如图7所示。
由于正常细胞与病变细胞在核的绝对大小上差异明显,细胞核的长轴、短轴等形态学特征是细胞分类的重要依据。在传统的宫颈细胞分类算法中,若想获得细胞核的长轴、短轴数据,首先需对细胞核进行精细分割,之后画出细胞核轮廓的外接椭圆,最后得到长、短軸的值。由于本文方法省略了传统方法中的细胞精细分割步骤,因此,采用上述方法获取长、短轴显然是不可行的。本文再次利用细胞核最大截面特征,将可视化该特征中凹陷区域的长度作为衡量细胞核大小的参数,即定义两个非基于细胞精细分割的特征,估计细胞核的形态,分别称为估计长度(式(13))与估计宽度(式(14)),如图8所示。通过以上二者的值,可将细胞核ROI分为病变细胞核和正常细胞核两类。
与传统长、短轴相比,估计长度与估计宽度的获取方法简便。尤其是在处理染色不均与对比度低的宫颈细胞图像时,分割方法的复杂度往往较高,且可能会出现欠分割问题,细胞核长轴、短轴的准确获取尤为困难。
2 实验与分析
实验采用的巴氏涂片图像均来自天津医科大学天津肿瘤医院,每个图像大小是2592×1944像素。实验的软件环境为python2.7和Matlab 2015b。
2.1 数据库建立
利用Selective Search提取多幅巴氏涂片图像中可能包含细胞核的ROI(根据细胞核大小设置Selective Search的参数min_size为50,即最小ROI的大小为50×50),建立细胞核库(375个细胞核ROI图像,并扩增为750个细胞核ROI图像,数据扩增方法如图9所示)和非细胞核库(750个非细胞核ROI图像)。
2.2 基于BP神经网络的细胞核筛选BP神经网络[25]
是应用最广泛的神经网络模型之一,多用于数据分类与模式识别。BP神经网络是多层前馈网络(输入层、隐含层和输出层),包括信号的前向传播和误差的反向传播两个过程。其基本思想是梯度下降法,通过误差的反向传播连续调整网络权值和阈值,使网络平方误差达到最小值。
为训练BP神经网络,需将ROI的类别进行标记,并提取特征,将标记与特征组合成一维数组作为网络的输入。训练集和测试集的样本分别从细胞核库和非细胞核库中随机抽取,训练集与测试集的比为2∶1,即训练集中包含500张细胞核图像和500张非细胞核图像;测试集中包含250张细胞核图像和250张非细胞核图像。
为体现最大截面特征在细胞核筛选任务中的优越性本文利用准确率(式(15))、敏感度(式(16))和特异度(式(17))三个指标来衡量。分别将方向梯度直方图(Histogram of Oriented Gradient, HOG)特征(实验一)、局部二值模式(Local Binary Pattern, LBP)特征(实验二)、Gabor滤波特征(实验三)和最大截面特征(实验四)与样本标记组合为一维数组作为BP神经网络的输入,对网络进行训练和测试。HOG特征将图像局部区域的梯度方向直方图作为特征,而梯度信息主要存在于图像边缘。一般情况下,细胞核染色相对于胞浆深,细胞核边缘明显,适合提取HOG特征。LBP特征是一种用来描述图像局部特征的算子,具有灰度不变性和旋转不变性等显著优点。其中,灰度不变性即对灰度变化具有鲁棒性,适用于染色以及光照不均的巴氏涂片图片。Gabor滤波对图像的边缘敏感,能够提供良好的方向选择和尺度选择特性,而且对于光照变化不敏感,能够提供对光照变化良好的适应性,利用其提取到的纹理特征适合描述光照不均条件下的细胞核边缘信息。
准确率=分类正确样本个数样本总数(15)
敏感度=预测正确阳性样本个数真实阳性样本总数(16)
特异度=预测正确阴性样本个数真实阴性样本总数(17)
重复各个随机实验10次,并记录数据。采用预测值与类别标记值之差作为误差来衡量测试的精度,设置误差容忍度为±0.5,即当误差小于±0.5,判定识别正确,并统计准确率。实验1~4的数据记录于表1,准确率与鲁棒性比较如图10,实验数据对比如表2所示。
由实验数据可知,利用最大截面特征训练的BP神经网络,其测试结果的准确率与鲁棒性均优于HOG特征、LBP特征以及Gabor滤波特征,最高准确率为100%。当测试准确率最高时,保存BP神经网络的各项参数与权值,其中基于最大截面特征的BP神经网络分类器的具体设置如表3所示。基于最大截面特征的细胞核筛选优于文献[22]算法利用LBP特征中的一致性旋转不变模式(Rotation Invariant Uniform-LBP, RIU-LBP)完成的背景块与异常块筛选(背景去除准确率为99.97%,异常块筛选准确率为 99.29%)。
输入层神经元个数即为最大截面特征维度,由横向最大截面特征(100×1)与纵向最大截面特征(100×1)拼接而成;隐含层神经元个数计算方法如式(18)所示:
2.3 基于统计阈值的细胞核分类
由于正常细胞与病变细胞在核的绝对大小上差异明显,本文统计了细胞核数据集中195张(135张正常细胞核和60张病变细胞核)ROI估计长度与估计宽度的数值,正常细胞核的估计长与估计宽数值统计如图11,病变细胞核估计长与估计宽二者的最大值统计如图12。根据统计结果及实验可知,当阈值设置为65时(估计长与估计宽均小于65时,判定细胞核为正常细胞核,否则判定为病变细胞核),细胞核分类的准确度最高。利用该方法对180张细胞核图片进行筛查,其筛查准确率为98.89%。误判为正常细胞核的病变细胞核如图13(a)所示,误判为病变细胞核的正常细胞核如图13(b)所示。二者的误判原因均为细胞核染色不均,进而造成估计长与估计宽不准确。
根据BP神经网络的准确率与病变细胞核筛查准确率得出该算法的最高准确率为98.89%。该算法实现了基于宫颈细胞核的宫颈癌筛查,自动完成从整幅巴氏涂片到筛查结果的全部过程。采用准确率、敏感度度和特异度作为评价指标,对本文算法与其他宫颈细胞核二分类算法进行比较,结果列入表4。
从表4可知,在宫颈细胞二分类任务中,本文算法的准确度在5个算法的位列第二,仅低于文献[22]算法0.09个百分点。
而对于宫颈细胞筛查而言,将异常细胞判定为正常细胞导致的后果更为严重,因此,敏感度是一个十分重要的衡量指标。从这个角度而言,本文算法优于其他4种算法。
3 结语
本文提出了基于最大截面特征与BP神经网络的宫颈细胞病变细胞核自动筛查算法,该算法包括细胞核识别和病变细胞核筛查两个步骤。与传统的基于细胞精细分割结果的宫颈细胞分类算法相比,该算法实现了从输入整幅未经处理的巴氏涂片到输出最终筛查结果的全部过程。其优点在于:一方面,省略了传统算法中的细胞分割步骤,很大程度上降低了该算法的复杂度;另一方面,消除了分割结果对分类准确度的影响。实验结果表明,利用最大截面特征训练得到的BP神经网络的测试结果的准确性与鲁棒性均优于其他特征。对于
整幅巴氏涂片图像该算法能够自动且精确地筛选出细胞核,并有效地筛查出病变细胞核,实用性强。目前,算法仅能够将细胞核分为病变细胞核与正常细胞核,因此,对细胞核的多分类是本研究接下来要继续的工作。另外,在提取ROI时,Selective Search参数自适应也是值得研究的问题。
参考文献(References)
[1] CANCER TODAY. [EB/OL]. [2018-05-10]. http://gco.iarc.fr/today/explore.
[2] 陈万青, 孙可欣, 郑荣寿, 等. 2014年中国分地区恶性肿瘤发病和死亡分析[J]. 中国肿瘤, 2018, 27(1): 1-14. (CHEN W Q, SUN K X, ZHENG R S, et al. Report of cancer incidence and mortality in different areas of China, 2014[J]. China Cancer, 2018, 27(1): 1-14.)
[3] 刘一鸣, 张鹏程, 刘祎, 等.基于全卷积网络和条件随机场的宫颈癌细胞学图像的细胞核分割[J]. 计算机应用, 2018, 38(11): 3348-3354. (LIU Y M, ZHANG P C, LIU Y, et al. Segmentation of cervical nuclei based on fully convolutional network and conditional random field[J]. Journal of Computer Applications, 2018, 38(11): 3348-3354.)
[4] 張鑫. 一种基于图像内容的粗略分类方法研究[D]. 南昌: 南昌航空大学, 2015: 44-48. (ZHANG X. A method of research of general classification methods on image[D]. Nanchang: Nanchang Hangkong University, 2015: 44-48.)
[5] GENTAV A, AKSOY S, NDER S. Unsupervised segmentation and classification of cervical cell images[J]. Pattern Recognition, 2012, 45(12): 4151-4168.
[6] 鲁武警. 基于Snake分割和SVM的宫颈细胞识别研究[D]. 济南: 山东大学, 2015: 45-52. (LU W J. Study of cervical cell recognition based on Snake segmentation and SVM[D]. Jinan: Shandong University, 2015: 45-52.)
[7] CHEN Y F, HUANG P C, LIN K C, et al. Semi-automatic segmentation and classification of Pap smear cells[J]. IEEE Journal of Biomedical & Health Informatics, 2014, 18(1): 94-108.
[8] 赵理莉, 孙燎原, 殷建平, 等. 结合层次法与主成分分析特征变换的宫颈细胞识别[J]. 国防科技大学学报, 2017, 39(6): 45-50. (ZHAO L L, SUN L Y, YIN J P, et al. Cervical cell recognition based on hierarchical method and principal component analysis feature transformation[J]. Journal of National University of Defense Technology, 2017, 39(6): 45-50.)
[9] 吕绪洋. 宫颈细胞病理图像的分类识别方法研究[D]. 桂林: 广西师范学院, 2016: 22-33. (LYU X Y. The classification of cervical cell pathological image recognition method research[D]. Guilin: Guangxi Teachers Education University, 2016: 22-33.)
[10] 王爽. 宫颈细胞图像分割与识别算法研究[D]. 青岛: 山东科技大学, 2017: 40-47. (WANG S. Study on recognition and segmentation technology of cervical cell image[D]. Qingdao: Shandong University of Science and Technology, 2017: 40-47.)
[11] 关涛. 光学显微宫颈细胞图像的分割与识别方法研究[D]. 长沙: 国防科学技术大学, 2015: 103-116. (GUAN T. Segmentation and classification of optical microscopic cervical cell images[D]. Changsha: National University of Defense Technology, 2015: 103-116.)
[12] CHANKONG T, THEERA-UMPON N, AUEPHANWIRIYAKUL S. Automatic cervical cell segmentation and classification in Pap smears[J]. Computer Methods and Programs in Biomedicine, 2014, 113(2): 539-556.
[13] 李文杰. 一种多分类器融合的单个宫颈细胞图像分割、特征提取和分类识别方法研究[D]. 桂林: 广西师范大学, 2016: 47-58. (LI W J. Based on multiple fusion of single cervical cell image segmentation, feature extraction and classification recognition method research[D]. Guilin: Guangxi Normal University, 2016: 47-58.)
[14] LING Z, HUI K, CHIEN T C, et al. Automation-assisted cervical cancer screening in manual liquid-based cytology with hematoxylin and eosin staining[J]. Cytometry Part A, 2014, 85(3): 214-230.
[15] JIE S, XUAN X, HE Y, et al. Automatic detection of cervical cancer cells by a two-level cascade classification system[J]. Analytical Cellular Pathology, 2016, 2016(4): 9535027.
[16] ZHAO L, LI K, YIN J, et al. Complete three-phase detection framework for identifying abnormal cervical cells[J]. IET Image Processing, 2017, 11(4): 258-265.
[17] SARWAR A, SHARMA V, GUPTA R. Hybrid ensemble learning technique for screening of cervical cancer using Papanicolaou smear image analysis[J]. Personalized Medicine Universe, 2015, 4: 54-62.
[18] 刘艳红, 罗晓曙, 陈锦, 等. 宫颈细胞图像的特征提取与识别研究[J]. 广西师范大学学报(自然科学版), 2016, 34(2): 61-66. (LIU Y H, LUO X S, CHEN J, et al. Research on cervical cell image feature extraction an recognition[J]. Journal of Guangxi Normal University (Natural Science Edition), 2016, 34(2): 61-66.)
[19] ZHANG L, LU L, NOGUES I, et al. DeepPap: deep convolutional networks for cervical cell classification[J]. IEEE Journal of Biomedical and Health Informatics, 2017, 21(6): 1633-1643.
[20] 盧磊, 罗晓曙, 孙妤喆, 等. 基于联合特征PCANet的宫颈细胞图像识别方法: CN106778554A [P]. 2017-05-31. (LU L, LUO X S, SUN Y Z, et al. Research of cervical cell image classification based on feature-united PCANet: CN106778554A [P]. 2017-05-31.)
[21] 郝占龙, 罗晓曙, 赵书林.基于同层多尺度核CNN的单细胞图像分类[J]. 计算机工程与应用, 2018, 54(15): 181-184. (HAO Z L, LUO X S, ZHAO S L. Single cell image classification based on same layer multi scale kernel CNN[J]. Computer Engineering and Applications, 2018, 54(15): 181-184.)
[22] ZHAO M, WU A, SONG J, et al. Automatic screening of cervical cells using block image processing [EB/OL]. [2018-05-10]. https://doi.org/10.1186/s12938-016-0131-z.
[23] UIJLINGS J R, SANDE K E, GEVERS T, et al. Selective search for object recognition[J]. International Journal of Computer Vision, 2013, 104(2): 154-171.
[24] 彭振武.宮颈细胞学看细胞到底要看什么?[EB/OL]. [2018-06-13]. https://www.91360.com/201701/60/31313.html. (PENG Z W. What can be seen in the cell according to cervical cytology? [EB/OL]. [2018-06-13]. https://www.91360.com/201701/60/31313.html.)
[25] HECHT-NIELSEN R. Theory of the backpropagation neural network[C]// IJCNN 1989: Proceedings of the 1989 International Joint Conference on Neural Networks. Piscataway, NJ: IEEE, 1989: 593-605.
