下肢动脉覆膜支架边缘狭窄的血流动力学分析
2019-07-25洪泱程云章朱清刘祥坤
洪泱,程云章,朱清,刘祥坤
1.上海理工大学医疗器械与食品学院,上海200093;2.微创心脉医疗科技有限公司,上海201318;3.上海微创医疗器械有限公司研发部,上海201203
前言
下肢动脉硬化闭塞症是指由下肢动脉发生粥样硬化性改变导致动脉管腔狭窄或闭塞引起肢体缺血临床表现的慢性疾病,若治疗不当,需要截肢甚至有生命危险[1]。过去该病多以髂股动脉搭桥、腹双股动脉或腋股动脉搭桥手术进行治疗,创伤较大。近年来,介入式医疗器械的发展使得经皮血管腔内球囊扩张成形术结合支架置入成为治疗的一种选择,因其创伤小、并发症少、安全性高等特点,现已成为治疗下肢动脉狭窄的主要方法。有报告指出,对于闭塞性病变,传统的裸支架植入易引发病变部位再狭窄,而植入覆膜支架的通畅率显著优于裸支架[2]。
覆膜支架是指在金属支架的表面覆盖一层生物性聚合物膜或内支架性移植物,金属支架材料通常采用镍钛合金,因为其需具有优良的生物相容性与机械性能,覆膜的材料常为涤纶或膨体聚四氯乙烯。覆膜支架不但具有普通支架的支撑作用,还能通过膜的机械性阻隔和膜表面的特殊物质产生防治血栓形成和内膜过度增生的作用。然而,最新的临床数据表明,覆膜支架植入后仍然无法避免并发症的发生,在支架和动脉之间的近端和远端过渡处确实存在再狭窄(称为“边缘狭窄”)[3],造成其发生的原因主要是覆膜支架植入血管后支架滑移,支架发生弯曲或者变形后覆膜发生褶皱无法贴合血管壁导致内漏、支架顺应性不匹配等[4]。
以往关于覆膜支架植入后血流动力学研究的方法多采用通过CT扫描获得植入覆膜支架后血管的断层图片,通过三维重建获得血管的三维模型,并进行计算流体动力学(Computational Fluid Dynamic,CFD)仿真,得到流体的数据,这种方法仅仅重建了血管的模型,忽视了覆膜支架的变形可能对血流产生的影响。Al-Hakim等[5]将覆膜支架植入离体的猪动脉,以模拟其植入真实血管的情况,并将树脂注入模型,待树脂凝固后取出得到流场的模型,通过CT断层扫描获得三维模型,最后的CFD分析证实该模型中覆膜支架出现了覆膜贴壁性不佳的现象,并提出通过该方法指导外周动脉覆膜支架智能设计的展望。
针对上述问题,本研究建立了覆膜支架的三维模型。首先采用有限元的方法模拟支架植入长直血管,由于支架释放后依其弹性在血管扩张,而血管壁也有弹性进行回缩,这相当于支架受到了径向压握;然后再将有限元仿真后的变形模型提取出来进行CFD仿真,以探究植入支架后血管的血流动力学特性,并解释并发症发生的原因。
1 材料与方法
1.1 覆膜支架模型
镍钛合金的覆膜支架的结构及其参数见图1。下肢动脉血管的直径约为7 mm,临床上为了覆膜支架能更好地固定于血管中,一般选择大于植入血管内径10%~20%的外径[6],故本研究在支架建模时的外径选为8 mm(大于血管内径11.4%),支架的横截面是宽度与厚度均为0.25 mm的矩形,支架环与环之间的距离为5.4mm,整个覆膜支架模型长度为15mm。模型见图2。支架呈轴对称结构,为节约时间与计算成本,建模时选择支架单环进行建模。通过Solidworks建立支架的三维模型,导入前处理工具进行网格划分,再导入Abaqus中进行有限元仿真。覆膜的三维模型为一个圆柱型的壳单元,直径为8.5 mm,与支架的外表面贴合,厚度为0.1 mm,仿真时通过绑定约束,在覆膜的内表面与支架的外表面设置为没有相对移动与分离的强连接。由于支架环设计的重复与连续,独立的支架环与环之间的力学环境相同[7]。为简化模型,本研究将原本19环的支架模型简化为3环进行压握的模拟,这样的简化并不会改变覆膜支架受压握之后的形变。

图1 支架几何尺寸Fig 1 Geometric parameters of stent graft

图2 覆膜支架模型Fig 2 Stent graft model
1.2 网格划分
为了优化运算的精度与时间,本研究使用Hypermesh 14.0前处理软件将覆膜支架模型划分为8节点结构化网格,并采用C3D81单元,综合考虑计算成本及计算精度,在支架厚度与宽度上分别划分4层单元,覆膜划分为4节点线性四边形网格,整个模型划分约为3万个单元。
1.3 材料属性
本研究选用的支架材料为镍钛合金材料。根据文献[8],使用用户自定义程序设定支架的材料属性,赋予镍钛合金的奥氏体和马氏体弹性模量、泊松比、抗拉强度、延伸率等材料参数。覆膜的材料选择高分子膨体聚四氯乙烯材料,根据文献[9],设定材料属性为:弹性模量55.2 Mpa,泊松比0.46,极限应变0.200~0.477,屈服应力6.6 Mpa。
1.4 边界条件
选择压握工具为可变形刚性圆管,压握模拟时,为了不让模型在轴向方向上产生位移以及其他方向的转动,轴向的自由度以及旋转的自由度被限制固定不动,压握工具约束轴向位移,与覆膜无摩擦接触,建立对应的柱坐标系,对压握工具实施径向位移载荷,位移载荷量为0.5 mm,即把外径为8 mm的覆膜支架压握至7 mm。
1.5 CFD模型建立
图3为覆膜支架完成有限元压握之后的结果,由于变型后的模型以网格的数据形式存在,没有流体域,无法直接用于流体分析,故需使用Hypermesh 14.0软件进行曲面重建,将有限元模型转化为实体模型。将提取出来的变形后的实体模型导入SolidWorks,建立的血管模型为长直圆管。为保证流体充分发展,设血管长度为35.0 mm,厚度为0.5 mm,内径为7.0 mm,与支架变形后的模型外径匹配(图4)。由于流场的模型相对不规则,考虑时间成本,采用自动化的非结构网格划分,并对支架以及覆膜变形区域附近网格细化,最终网格总数约为165万。

图3 压握变形后的有限元模型Fig 3 Finite element model after crimping deformation

图4 覆膜支架与血管装配Fig 4 Assembly of stent graft and blood vessel
1.6 CFD边界条件
当血管直径大于0.5 mm时,用牛顿流体代替非牛顿流体所产生的误差不会超过2%[10]。本研究中模型血管直径为7 mm,故假设血液为不可压缩的牛顿流体,以简化模型,流动设为定常的层流,密度为1 050 kg/m3,动力粘度0.005 Pa·s,入口的血液流速参考远端股动脉血液流速设为4 mL/s,设定出口的流已经稳定,出口条件设为0出口压力。血管壁的径向速度很小,对流场分布基本没有影响,因此壁面条件设为无滑移条件。
2 结果
2.1 覆膜支架压握
图5为覆膜支架受到压握变形后的截面图。由于金属支架受到挤压,同一支架环上的支架筋之间的距离缩短,支架筋之间的覆膜发生褶皱向内收缩,导致覆膜与血管壁分离,血液在覆膜的外侧与血管壁之间流动。支架的模型为单环9个波峰,故支架的一端在压握后产生了9个分离区域,支架前端的分离区域与支架单环波峰的数量为1:1,支架后端与前端的情况一致,一共产生了18个分离区域。测量覆膜离血管壁最远距离约为0.7 mm,径向变化率为10%。
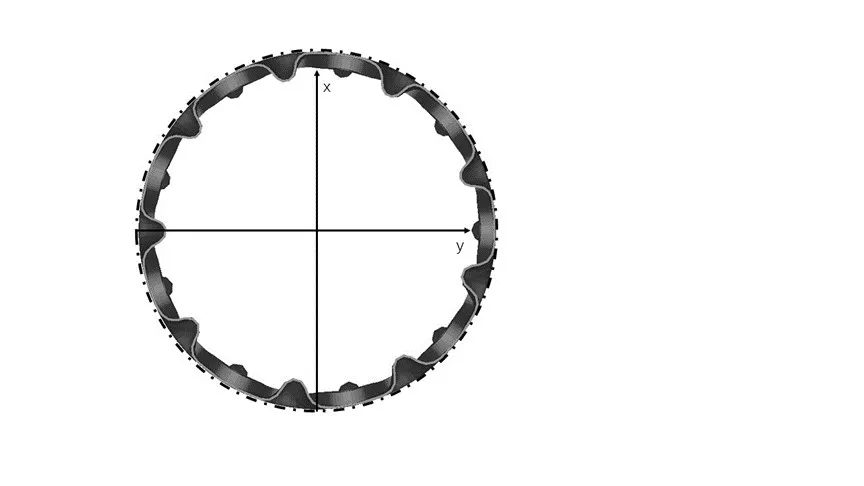
图5 覆膜支架截面变形图Fig 5 Cross-sectional deformation diagram of stent graft
2.2 壁面切应力分布
血流的壁面切应力是血液在动脉壁内皮表面上流动的摩擦力的结果,以力/面积为单位,根据文献[11]定义:小于0.5 Pa的壁面切应力与内膜增厚相关。大量文献(不论是基于尸检的结果、体内动态模型还是人体体内的研究中)都描述了血流低壁面切应力与内膜增生和动脉粥样硬化的关系[12-14]。
图6显示了模型中段的壁面切应力分布,可以观察到金属支架筋附近存在低壁面切应力区域(<0.5 Pa),这也与其他血管支架CFD分析结果相吻合[15],支架前后两端部由于覆膜受压发生褶皱内陷而导致血液内渗的区域同样存在着明显的低壁面切应力区域(<0.5 Pa)。模型中低壁面切应力区域达到壁面总面积的27.1%,血液内渗区域的低壁面切应力占总低壁面切应力区域的28.5%。
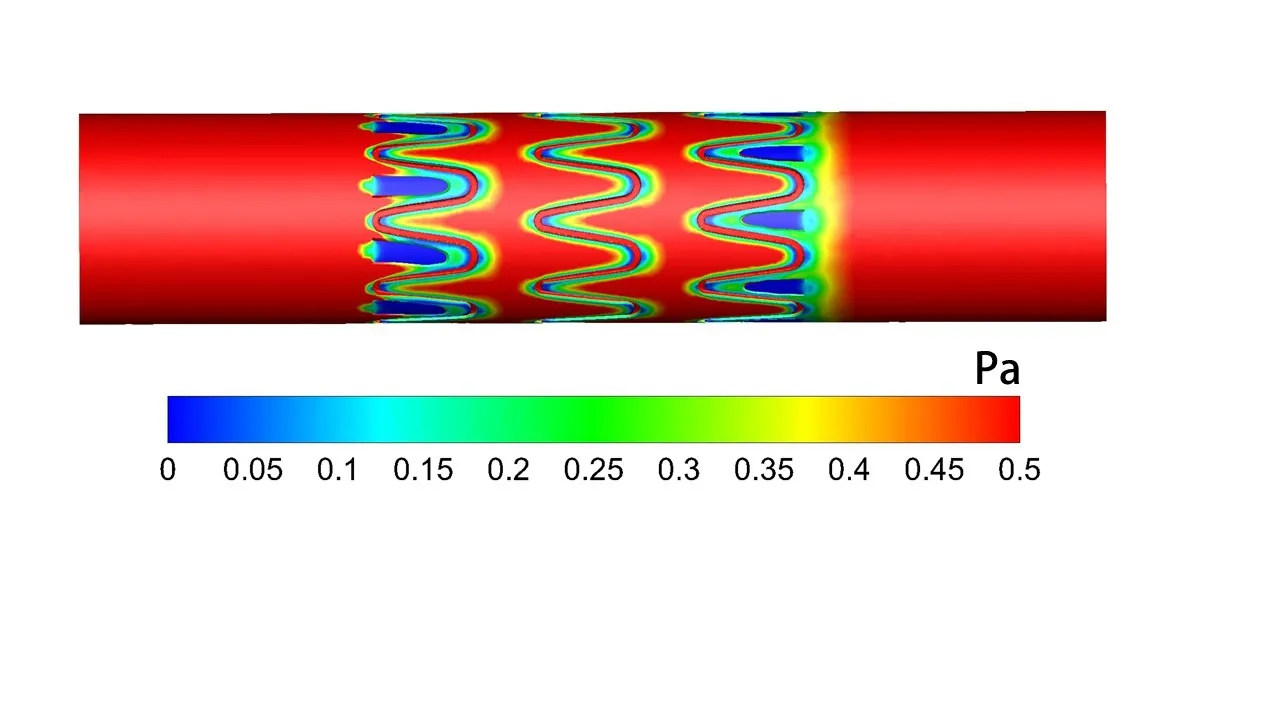
图6 模型的壁面切应力云图Fig 6 Nephogram of wall shear stress of the model
2.3 流动分析
第二个重要的心血管血液动力学因素是血流再循环区,可以定义为低血液流速和粒子停留时间的静止涡流[16]。有关支架的体外实验已经证明:在预计为再循环区域的支架筋处,血液中的血小板会显著地堆积于此[17]。图7为覆膜支架前端血液内渗区域的速度剖面云图与流线图,可以观察到血管壁和覆膜之间的血液速度流动很低,流速小于0.02 m/s。根据定量分析,小于0.02 m/s的低流速区域占模型总体积的4%,血液内渗的区域的低流速区域占总低流速区域的30.1%。从血液内渗区域的流线图可以观察到在这个区域内血液存在两个再循环区域,该区域的深处(白色箭头)与区域的中段位置(黑色箭头)各存在一个再循环区。
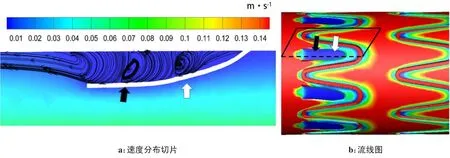
图7 覆膜支架近端的速度分布切片及其流线图Fig 7 Velocity profile and streamlines of the proximal stent graft
3 讨论
Ballyk[18]表明只有将计算分析的结果与临床实验数据的发现联系起来才是最重要的。覆膜支架的覆膜有低摩擦系数且能阻止平滑肌生长,支架植入血管后存在着较低的壁面切应力区域及血液回流区,这可能有助于解释临床覆膜支架植入术后血管内再狭窄的发生,有实验结果表明,造成外周动脉覆膜支架植入术的有效性显著下降的一种临床现象是动脉与支架间的再狭窄,称为“边缘狭窄”[19]。虽然研究表明血管成形术和支架再植入术能作为边缘狭窄的有效治疗手段,但之前的研究大都没有利用CFD来分析与探究引起边缘狭窄的血流动力学效应[20-21]。
本研究的仿真结果表明血液在覆膜与血管壁的间隙中会产生低速流动,产生较大面积的回流区域和低壁面切应力。基于先前的研究,这种现象可能会导致血小板聚集并延伸至覆膜边缘,随后在覆膜和血管壁之间形成血栓。血小板聚集和血栓形成会在支架边缘进一步改变血流动力学,这是产生边缘狭窄的重要因素。
本研究的模拟方法存在一定局限性,覆膜支架植入真实血管后的形态是非常复杂且不确定的。本研究简化了模型,假设覆膜支架植入长直理想模型血管,此外为了计算简便,血流的模型也采用了简化的定长流与牛顿流体。同时,本研究旨在探究覆膜支架植入后发生边缘性再狭窄的血流动力学因素,故在查阅文献以及试验之后的基础上再进行了简化,今后可以通过CT图像扫描建立真实的人体病变血管模型,并使用有限元方法模拟覆膜支架在血管的扩张与回弹的情况,并以病人真实的血管脉动流数据作为流体仿真的入口条件,但是该方法对于计算机的计算能力有着很高的要求。
4 结论
本研究使用有限元方法与计算流动力学方法分析了覆膜支架植入血管后的血流动力学情况,结果发现覆膜支架在发生压握后支架端部发生褶皱,且在该区域为低壁面切应力区域,同时在该区域也出现了血液回流情况,结合现有关于血管再狭窄理论,这可能是临床中发生支架植入后发生边缘再狭窄的原因,未来的支架设计需要改善覆膜支架边缘与血管壁的附着问题。
