外源水杨酸对镉污染下酸枣幼苗生长及镉积累的影响
2019-07-24邓群仙林立金彭静文毛茂桔
李 雷,刘 彤,邓群仙*,林立金,王 茜,彭静文,毛茂桔
(1.四川农业大学园艺学院,成都 611130;2.四川农业大学果蔬研究所,成都 611130)
日益严重的土壤污染问题已成为水果安全生产的严峻考验。《全国土壤污染状况调查公报》的数据显示重金属是土壤最主要的污染物,其中全国土壤总的镉(cadmium,Cd)点位超标率高达7%,位居所有重金属之首[1];镉污染土地面积超过l.3 万hm2[2],污水灌溉和化学肥料,尤其是磷肥的过度施用,导致果园土壤镉污染持续加重[3]。镉是植物生长发育的非必需元素,具有极强的生物毒性和转移性,易在植物摄取水分和养分时被吸收与富集[4],进而通过多种途径进入食物链累积放大,严重威胁人体健康[5]。生理上,镉对植物的毒害主要表现为抑制光合作用[6]、破坏活性氧代谢平衡[7]、干扰水分[8]及矿质元素吸收与转运[9]等,形态上则引起植物叶片萎黄、器官坏死[10]等。土壤镉浓度过高对植物也是一种逆境胁迫[11]。有学者认为通过施用外源化学物质调控植物生理生化特性,是解决镉胁迫引起植物损伤的可行方法[12-13]。
水杨酸(salicylic acid,SA)是一种广泛存在于植物体的信号小分子酚类物质[14],不仅影响植物发芽、生长、开花、光合作用等生理生化过程[15],还参与诱导植物对非生物和生物胁迫的许多特异性反应[16]。普遍认为水杨酸可以通过激活、加强与抗性相关的代谢来提高植物抗性,缓解逆境对植物造成的损伤[17]。但也有研究报道SA 会加重逆境胁迫对植物的伤害,王丹华[18]研究发现SA 预处理降低了水稻幼苗的抗冷性,且SA 浓度越高水稻受到的冷害越严重;而张凤银等[19]研究发现高浓度SA 处理严重抑制了盐胁迫下蕹菜种子萌发和幼苗生长。Q.Hayat 等[20]发现,SA 对不同植物在镉胁迫下的作用不尽相同。E.Ali 等[21]发现SA 缓解油菜镉毒害的有效作用主要是降低镉的吸收与改善光合活性。Gu C.S.等[22]研究表明SA 预处理能够通过降低睡莲镉含量与提高抗氧化酶活性来减轻镉的毒害作用。而Guo B.等[23]研究发现SA 预处理不但能增强水稻抗氧化酶活性与提高非酶抗氧化物质含量,同时还能通过调节水稻对镉的吸收、运输来减轻镉对水稻生长的抑制。但也有研究发现,SA 缓解植物镉毒害是通过间接或直接增加植物对镉的抗性与耐性[24-25],而非通过降低植物对镉的吸收。A.Metwally 等[26]发现SA 预处理对大麦镉毒害的缓解不是通过提高抗氧化水平,而是通过影响镉的其他解毒机制来实现的。目前,SA用于缓解镉毒害的研究主要集中在一、二年生植物中,在多年生植物尤其是木本果树中鲜有报道。酸枣(Ziziphus acidojujuba)是多年生灌木,为优良的蜜源植物、药用植物和重要的砧木,具有较高的经济价值[27-28],如果其长期生长在镉污染土壤中,全株会比一、二年生草本植物积累更多的重金属。镉对酸枣生长的影响已有报道[29],而镉污染下外源SA 对酸枣生长和镉积累的影响还不清楚。鉴于此,本试验以酸枣为试材,在盆栽条件下,研究根际浇灌SA对镉污染下酸枣生长、生理特性及镉积累的影响,探讨SA 对酸枣耐镉响应的生理机制。
1 材料和方法
1.1 试验材料
试验土壤取自四川农业大学成都校区周边无污染农田的沙壤土(30°42' N,103°51' E),土壤基本理化性质见文献[30],酸枣种子购买于河北省邢台市。选取大小均一、饱满的酸枣种子,在清水中浸泡5 h,之后用10%次氯酸钠消毒10 min,再用蒸馏水冲洗5 次,以消毒后的河沙为基质,于32 孔穴盘内进行发芽培养,培养期间保持河沙湿度为河沙最大持水量的 50%~55%,(25±2)℃下于光照培养箱育苗培养。待酸枣长出一对真叶后,将育苗盘移至透明遮雨棚。
1.2 试验设计
本试验土壤镉污染值的设定参照《土壤环境质量农用地土壤污染风险管控标准(试行)》(GB 15618-2018),即土壤(6.5<pH≤7.5)Cd 含量高于 3 mg/kg时农用地土壤污染风险高,禁止种植食用农产品;同时也参考木本果树镉积累相关文献[31]。SA 浓度的设置参考文献[11]。将所取土壤经自然风干研磨后过 5.00 mm 筛,以 CdCl2·2.5H2O 形式加入镉,使土壤镉含量为5.0 mg/kg,充分混匀后装入直径21 cm、高18 cm 的塑料花盆,每盆装土3.0 kg,不定期翻土混合,保持湿润平衡30 d 以上。待酸枣长出8 片真叶后,选长势一致且无病虫害的幼苗移栽至塑料花盆,每盆种植4 株。根据土壤实际水分情况不定期浇水保持盆中土壤田间持水量为70%~75%,移栽15 d 后分别用浓度为 0(CK,蒸馏水)、50、100、150、200 μmol/L SA 溶液浇灌酸枣幼苗,浇灌量为100 mL/盆,每个处理 3 盆,重复 3 次。每 7 d 浇灌 SA 溶液 1 次,共浇灌6 次,于最后一次SA 处理6 d 后采样测定各指标。
1.3 指标及测定方法
在整株收获酸枣幼苗之前,从下往上取植株第6~10 节位的叶片进行光合色素与抗氧化酶活性测定[32],光合色素(叶绿素a、叶绿素b、类胡萝卜素)含量测定采用80%丙酮提取法,超氧化物歧化酶(SOD)活性测定采用氮蓝四唑(NBT)法,过氧化物酶(POD)活性测定采用愈创木酚法,过氧化氢酶(CAT)活性测定采用高锰酸钾滴定法。整株采收后,将植株用清水冲洗干净,再用去离子水冲洗3 次,用数显游标卡尺测量株高;然后将根系、茎杆、叶片分别封装,于110 ℃杀青15 min,75 ℃烘干至恒重,用电子天平称重,粉碎,过0.15 mm 筛,在硝酸-高氯酸(体积比 4:1)消化后,用 iCAP 6300 型 ICP 光谱仪(Thermo scientific,USA)测定酸枣根系、茎杆、叶片镉含量[33]。
在植株与土壤分离后,将土壤自然风干粉碎过1.00 mm 筛,用于土壤酶活性与有效态镉含量测定[34]。土壤脲酶活性采用苯酚钠比色法测定,其活性以在37 ℃培养24 h 后每克土壤释放的NH3-N 毫克数表示。蔗糖酶活性采用3,5-二硝基水杨酸比色法测定,其活性以每克土壤在24 h 内生成的葡萄糖毫克数表示。过氧化氢酶活性采用高锰酸钾滴定法测定,其活性以每克土壤在20 min 内消耗的0.1 mol/L 高锰酸钾毫升数表示。土壤有效态镉含量测定采用DTPATEA 浸提法,使用 iCAP 6300 型 ICP 光谱仪测定[35]。
1.4 数据处理方法
使用Microsoft Excel 2010 处理数据,IBM SPSS 22.0 进行Duncan 新复极差法多重比较,数据以“平均值±标准误”表示。根冠比=根系生物量/地上部分生物量,转运系数(TF)=地上部分镉含量/根系镉含量[33]。
2 结果与分析
2.1 外源水杨酸对镉污染下土壤酶活性与有效态镉含量的影响
从表1数据可知,镉污染下,SA 处理后土壤酶活性变化各异。SA 处理显著提高了土壤过氧化氢酶活性,50~200 μmol/L SA 处理的土壤过氧化氢酶活性分别较对照升高了 60.6%(P<0.05)、50.0%(P<0.05)、42.4%(P<0.05)和 47.0%(P<0.05)。SA 处理后,土壤脲酶和蔗糖酶活性随SA 浓度的升高呈下降趋势,与未喷施SA 相比,在200 μmol/L SA 处理时分别降低了 34.2%(P<0.05)和 45.3%(P<0.05)。SA 处理提高了土壤有效态镉含量,且随着SA 浓度的升高,土壤有效态镉含量呈上升趋势,仅在200 μmol/L SA处理时差异显著(P<0.05),增幅达15.2%。
2.2 外源水杨酸对镉污染下酸枣幼苗生长的影响
由表2可知,镉污染下,SA 处理降低了酸枣幼苗根系、茎杆、叶片、地上部分生物量及株高,提高了根冠比。与未浇灌 SA 相比,50 μmol/L SA 处理后酸枣幼苗各器官生物量及株高均有所下降,但差异不显著(P>0.05);而 100~200 μmol/L SA 处理后(150 μmol/L 除外)根系、茎杆、叶片、地上部分生物量均显著下降(P<0.05),但处理间彼此差异不显著(P>0.05)。与对照相比,50~200 μmol/L SA 处理后根系生物量分别下降了 2.9%(P>0.05)、15.3%(P<0.05)、12.2%(P<0.05)和 16.2%(P<0.05),地上部分生物量分别下降了 5.8%(P>0.05)、25.9%(P<0.05)、25.4%(P<0.05)和 30.0%(P<0.05),这表明浇灌 SA后酸枣幼苗根冠比的升高,主要是由地上部分生物量的降低幅度大于根系所致。

表1 土壤酶活性与有效态镉含量Table 1 Soil enzyme activity and available cadmium content

表2 酸枣生物量和株高Table 2 Biomass and plant height of Z.acidojujuba
2.3 外源水杨酸对镉污染下酸枣幼苗光合色素含量的影响
由表3可知,镉污染下,外源SA 处理降低了酸枣幼苗叶绿素a、叶绿素a+b、叶绿素a/b 及类胡萝卜素含量,且随SA 浓度的升高叶绿素a、叶绿素a+b 及类胡萝卜素含量均呈下降趋势。与未浇灌SA 相比,50~200 μmol/L SA 处理后叶绿素 a 含量分别降低 了 12.2%(P<0.05)、25.0%(P<0.05)、25.5%(P <0.05)和 41.5%(P<0.05),叶绿素 a+b 含量分别降低了 5.3%(P>0.05)、14.5%(P<0.05)、19.3%(P<0.05)和37.3%(P<0.05),类胡萝卜素含量分别降低了25.50%(P<0.05)、27.5%(P<0.05)、29.4%(P<0.05)和 31.4%(P<0.05)。整体来看,类胡萝卜素含量的下降幅度高于叶绿素 a 及叶绿素 a+b(200 μmol/L 处理除外)。与叶绿素a 不同,100 μmol/L SA 处理显著提高了叶绿素 b 含量(P<0.05),其余处理叶绿素 b 含量无明显变化(P>0.05),这说明 SA 处理后叶绿素 a/b 的降低主要是由叶绿素a 含量降低所致。
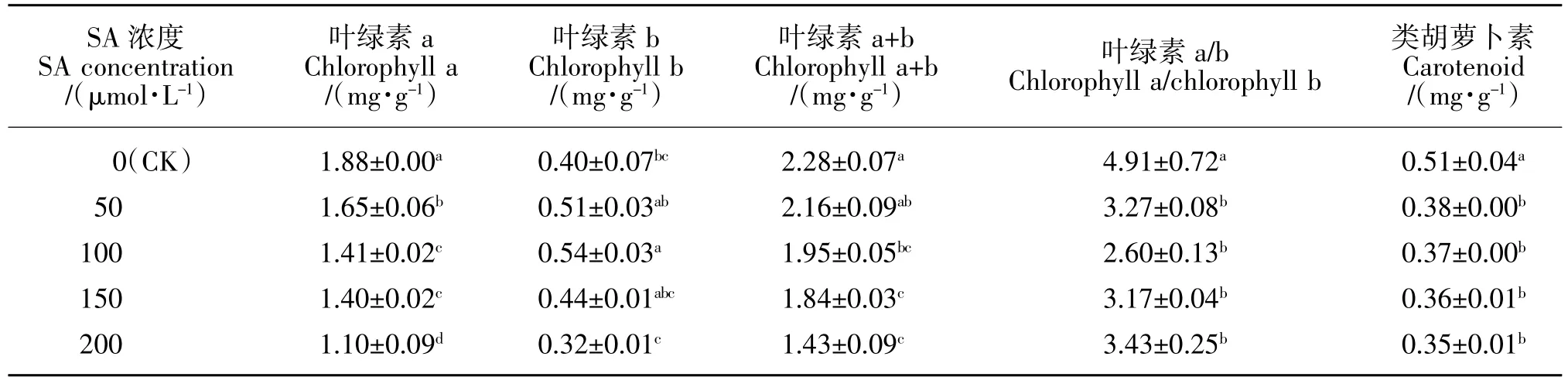
表3 酸枣叶片光合色素含量Table 3 Photosynthetic pigment content in leaf of Z.acidojujuba
2.4 外源水杨酸对镉污染下酸枣幼苗抗氧化酶活性的影响
镉污染下,不同浓度SA 处理后酸枣幼苗叶片SOD、POD 及CAT 活性变化趋势基本一致,相比于对照,SOD、POD 和CAT 活性均显著降低(见图1)。随着SA浓度升高,酸枣幼苗叶片SOD、POD 和CAT 活性均呈下降趋势,200 μmol/L SA 处理时 SOD、POD 和 CAT活性分别比对照降低了 24.6%(P<0.05)、38.0%(P<0.05)和 29.8%(P<0.05)。这表明镉污染下外源 SA 处理抑制了酸枣幼苗抗氧化酶系统的活性。
2.5 外源水杨酸对酸枣幼苗镉含量的影响
由表4可知,与对照相比,除 150、200 μmol/L SA 处理后酸枣幼苗茎杆镉含量升高不显著外(P>0.05),50~200 μmol/L SA 处理均显著提高了根系、茎杆、叶片、地上部分镉含量及转运系数(P<0.05),但 100~200 μmol/L SA 处理间根系、茎杆、叶片、地上部分镉含量及转运系数彼此差异均不显著(P>0.05)。与未浇灌 SA 相比,50~200 μmol/L SA 处理后根系镉含量分别增加了 14.8%(P<0.05)、32.7%(P<0.05)、22.9%(P<0.05)和 22.8%(P<0.05),茎杆镉含量分别增加了 20.6%(P<0.05)、17.0%(P<0.05)、7.7%(P>0.05)和 12.3%(P>0.05),叶片镉含量分别增加了 91.9%(P<0.05)、99.5%(P<0.05)、97.3%(P<0.05)和 104.6%(P<0.05),地上部分镉含量分别增加了 47.1%(P<0.05)、48.0%(P<0.05)、42.3%(P<0.05)和 45.5%(P<0.05);综合来看,SA 处理后酸枣幼苗各器官镉含量升高幅度依次为:叶片>地上部分>根系>茎杆。

图1 酸枣叶片抗氧化酶活性Figure 1 Antioxidant enzyme activity in leaf of Z.acidojujuba
3 讨论与结论
酶是土壤的重要组成部分,其活性与土壤各组成成分、理化性质密切相关,土壤脲酶和蔗糖酶在土壤物质循环中发挥着重要作用,其活性大小在一定程度上反映了土壤生物学肥力与土壤环境质量,是探讨重金属污染生态效应的重要指标之一[36]。有报道认为低浓度的镉对土壤过氧化氢酶有激活作用[37],而土壤脲酶和蔗糖酶则对镉十分敏感[38]。本试验中,SA 处理后土壤脲酶活性与蔗糖酶活性均显著下降,而土壤过氧化氢酶活性和有效态镉含量均有一定程度的升高。结合前人的研究结果来看,土壤有效态镉含量升高可能是导致土壤脲酶与蔗糖酶活性降低及过氧化氢酶活性升高的主要原因[38-39]。综合来看,SA 处理降低了镉污染下酸枣幼苗根系微环境中的土壤质量,而这也在一定程度上抑制了酸枣植株的生长。
生物量的大小是植物在逆境胁迫下生长势的直接体现。土壤镉胁迫会导致酸枣幼苗生长缓慢,植株生物量降低[29]。不少研究报道了SA 具有减轻镉对植物生长抑制的作用[40-41]。本试验中,50 μmol/L SA 处理的酸枣幼苗根系、地上部分生物量及株高降低幅度最小,而在200 μmol/L SA 处理时降幅最大,这表明镉污染下SA 对酸枣幼苗生长的抑制可能存在剂量效应,且高浓度SA 对酸枣幼苗生长的抑制效果强于低浓度;地上部分生物量的降低幅度大于根系,说明镉污染下水杨酸处理对酸枣幼苗地上部生长的影响大于根系。邵小杰等[11]发现SA 在缓解镉胁迫对葡萄根系损伤时存在明显的剂量效应,缓解作用随SA 浓度的升高而逐渐降低。对于镉胁迫下外源SA 对不同植物效用的差异,有学者认为这些差异可能是由于植物种类、SA 及镉的处理方式等因素不同造成的[41],这也显示出SA 对植物生长影响的复杂性。
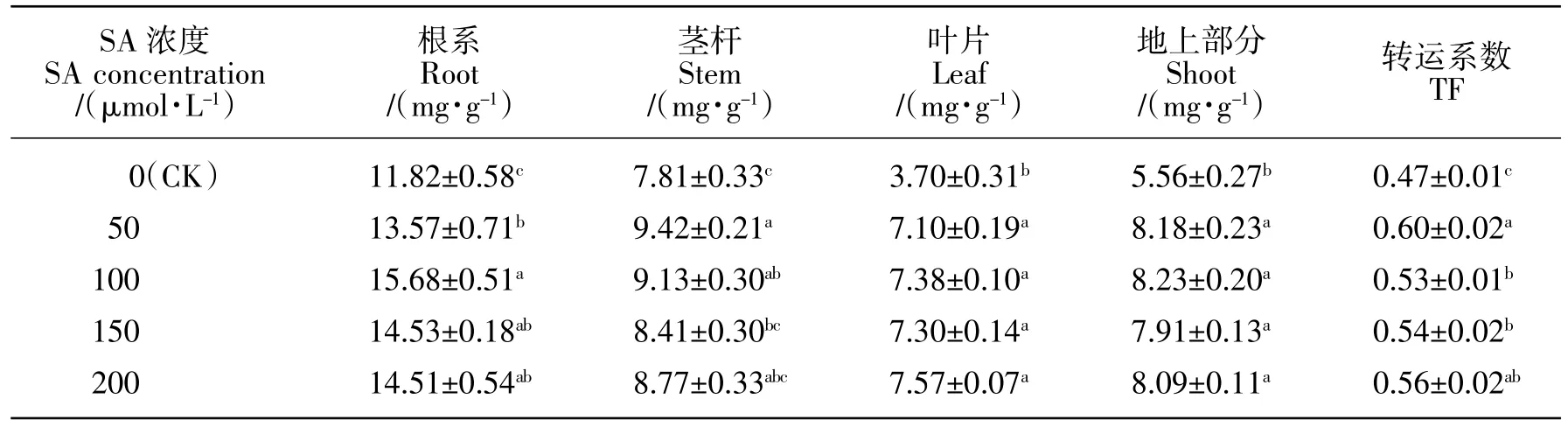
表4 酸枣镉含量Table 4 Cadmium content in Z.acidojujuba
光合色素含量是衡量绿色植物光合能力强弱的重要指标,叶绿素和类胡萝卜素能与叶绿体类囊体膜上的蛋白质形成色素蛋白复合物,完成对光能的吸收、传递和光化学反应,是植物进行光合作用的重要物质基础。本研究表明,SA 处理降低了酸枣幼苗叶片叶绿素a、叶绿素a+b 及类胡萝卜素含量,这与A.Belkhadi 等[42]在亚麻上的部分研究结果一致,而与张永平等[43]在甜瓜上的研究结果差异较大;其中200 μmol/L SA 处理后酸枣幼苗叶绿素a、叶绿素a+b 及类胡萝卜素含量远低于50 μmol/L,这与SA 处理后酸枣幼苗生物量变化基本一致。有研究报道镉胁迫会破坏叶绿体膜的结构和功能[44-45],抑制枇杷[46]、草莓[47]叶绿素的合成和光合速率。尽管低浓度的镉对枣叶绿素的合成有一定程度的刺激效应,但随着镉浓度的增加则会逐渐抑制叶绿素的合成[48]。可见,SA 处理引起的植株镉含量上升,可能是导致酸枣幼苗光合色素含量降低的主要原因。
SOD、POD 和 CAT 是植物重要的抗氧化酶,在维持植物活性氧代谢平衡中发挥着重要作用;SOD是植物应答于逆境最先产生的抗性蛋白[49],可以催化超氧阴离子自由基形成过氧化氢和氧气,而CAT和POD 在清除过氧化氢等活性氧自由基过程中起着重要作用。A.Krantev 等[40]发现镉胁迫下SA 预处理诱导玉米幼苗CAT 活性下降,SOD 活性显著升高,而POD 活性变化不明显。本研究结果表明,SA处理抑制了酸枣幼苗叶片SOD 和POD 活性,这与铝胁迫下SA 处理后葡萄叶片SOD 和POD 活性变化一致[50],此外酸枣叶片CAT 活性的变化趋势也与Guo Q.等[51]在早熟禾幼苗上的研究结果相似。镉胁迫诱导植物产生大量的活性氧(ROS),SA 处理后酸枣幼苗抗氧化酶活性急剧下降,导致过多的活性氧不能被有效地清除,致使酸枣幼苗受到更为严重的氧化胁迫伤害,这也为酸枣幼苗生物量及叶绿素含量的降低提供了旁证。
SA 对植物镉积累具有广泛而不同的影响,因施用方式与植物种类的不同,研究结果也不尽一致,甚至完全相反。韩鹰等[24]研究发现外源SA 处理对镉胁迫下路易斯安娜莺尾根系和叶片镉含量无显著影响。镉胁迫下叶面喷施SA 后芥菜茎秆与根系镉含量变化不一致[39]。SA 预处理降低了15 μmol/L和25 μmol/L 镉胁迫下玉米根系镉含量,但增加了10 μmol/L 镉胁迫下的玉米根系镉含量[40]。SA 通过改变铝在葡萄各器官的分布,使铝更多的积累在根系,降低地上部分的镉含量来缓解铝对葡萄的毒害[52],SA 诱导植物各器官对重金属的差异积累被认为是SA 对植物的潜在生理作用之一[53]。本研究结果显示,SA 处理前后,酸枣幼苗各器官的镉含量大小均为:根系>茎杆>地上部分>叶片,这与枇杷[31]、桃[54]对镉的吸收积累基本一致;但SA 处理促进了酸枣对镉的吸收,提高了酸枣各器官的镉含量,这与G.razic等[25]在大豆上的研究结果部分一致;酸枣幼苗各器官镉含量的增幅为:叶片>地上部分>根系>茎杆,地上部分镉含量上升幅度远高于根系,这说明SA 促进了镉向地上部的转移,这可能也是引起酸枣幼苗地上部分生物量降低幅度高于根系的主要原因。SA处理后酸枣幼苗镉含量显著升高,镉积累过高必然加剧氧化胁迫,这与SA 处理后酸枣幼苗抗氧化酶系统的反应基本一致。
外源SA 不仅不能缓解镉对酸枣幼苗生长的抑制,反而加重了镉对酸枣的毒害。镉污染下,外源SA处理提高了土壤有效态镉含量,降低了土壤脲酶和蔗糖酶活性;促进了酸枣幼苗对镉的吸收与转运,增加了镉含量,抑制了抗氧化酶系统活性,从而使光合色素含量降低,进而导致生物量下降;综合来看,高浓度(200 μmol/L)SA 处理对酸枣幼苗生长的抑制作用强于低浓度(50 μmol/L)。
