小麦产量对中后期氮素胁迫的响应及品种间差异
2019-07-23李朝苏吴晓丽汤永禄马孝玲李式昭黄明波
李朝苏 吴晓丽 汤永禄,* 李 俊 马孝玲 李式昭 黄明波 刘 淼
小麦产量对中后期氮素胁迫的响应及品种间差异
李朝苏1吴晓丽1汤永禄1,*李 俊1马孝玲1李式昭1黄明波2刘 淼1
1四川省农业科学院作物研究所 / 作物生理生态及栽培四川省重点实验室, 四川成都 610066;2四川省广汉市生产力促进中心, 四川广汉 618300
生育中后期土壤供氮不足是导致小麦减产的重要原因之一。2015—2017年连续2个生长季, 选择人工合成六倍体小麦衍生品种(synthetic hexaploid wheat-derived cultivar, SDC)和非人工合成小麦衍生品种(Non-synthetic hexaploid wheat-derived cultivar, NSC)各3个, 设置2个施氮水平, 研究其产量及相关生理参数对中后期氮素胁迫的响应。SDC包括川麦42、川麦104和绵麦367, NSC包括绵麦37、川农16和川麦30。2个施氮水平为正常施氮处理(Nn, 150 kg N hm–2, 底肥40%、拔节肥60%)和中后期氮胁迫处理(Ns, 60 kg N hm–2, 全部作底肥)。结果表明, 氮胁迫下, 两类品种产量均值降幅接近(SDC 19.6%, NSC 20.4%), 但正常供氮下SDC产量高于NSC (高14.4%), 其氮胁迫下的产量也较高(高15.9%)。氮胁迫下, SDC的生物产量、单位面积粒数均高于NSC。开花期, 两类品种在2个氮素水平下的叶面积指数(LAI)接近, 但在灌浆中后期的降幅SDC小于NSC, 花后22 d, SDC在高、低施氮水平下的LAI较NSC分别高25.1%和16.0%。开花灌浆阶段, 2个施氮水平下SDC旗叶和倒二叶SPAD始终高于NSC, 氮胁迫下二者的差距增大。两类品种的净光合速率(NPR)和群体光合速率(CAP)的差异也主要出现在灌浆中后期, 氮胁迫下SDC以上2个参数较NSC均有优势。氮胁迫下, 花后功能叶片的硝态氮、铵态氮、可溶性糖含量SDC也高于NSC。SDC较NSC有更高的氮素利用效率(NUtE), 氮胁迫下, 二者NUtE的差距增加。以上结果表明, 低氮胁迫下SDC的生产力高于NSC, 这与其较高的库容、较长叶片功能期有关。
人工合成小麦衍生品种; 氮胁迫; 产量; 光合特性; 氮素利用效率
小麦(L)作为世界主要粮食作物之一, 其产量潜力和氮素利用效率的提升是解决全球粮食安全的重要手段[1]。氮素是作物生长发育的必要元素, 也是叶绿素和色素蛋白复合体的主要成分, 在促进作物增产方面起到了关键支撑作用[2]。适量增施氮肥能调节作物生长, 提高碳氮同化能力, 改善源库关系, 从而增加产量[2-4]。对于小麦而言, 生育前期对氮素需求较少, 而拔节后随着温度上升和群体快速增长, 氮素需求逐渐增加, 籽粒积累的氮素约80%来源于开花期[5]。然而, 大田生产中, 由于地力不均或施肥不合理, 易造成生育中后期脱肥即氮胁迫。氮胁迫严重影响叶面积发展、光合效率[3]、干物质生产及分配[6]、氮同化及氮素利用效率[4], 最终造成源库失衡, 产量下降[3-6]。Madani等[7]也报道, 中后期施氮有利于减轻源限制、增加库容、提高产量。
遗传改良是提高小麦对低氮环境适应性的主要途径[1]。然而, 多年的品种间杂交育种方式导致了小麦遗传多样性下降, 生物和非生物胁迫耐受力降低[8-9]。人工合成六倍体小麦(synthetic hexaploid wheat, SHW)资源具有诸多突出优势, 许多国家的小麦育种家用其改良提升小麦产量潜力[9-10]。四川自引入SHW种质资源后, 选育出一系列SHW衍生品种(SHW-derived cultivar, SDC), 使得四川小麦产量潜力得到大幅提升, 近十年区试平均产量较20年前提高15%~20%[10]。研究证实, SDC产量的提升与SHW的遗传贡献密切相关[11]。汤永禄等就SDC的高产潜力及其生理机制进行了系统研究, 并探讨了适宜生产条件下的高产特征[10,12]。环境条件如温度、水氮胁迫常影响小麦正常生长发育, 造成小麦结实性和产量下降。目前, 针对SHW衍生高产品种对这些逆境的反应还没有深入研究。本文以SDC和非SHW衍生品种(non-SHW-derived cultivar, NSC)为材料, 研究中后期低氮胁迫对两类品种产量及相关生理性状的影响, 拟为不同类型小麦育种改良和高产栽培管理提供理论依据。
1 材料与方法
1.1 试验设计及田间管理
试验于2015—2016 (2016)和2016—2017 (2017) 2个生长季, 在四川盆地西部的广汉市连山镇(31°00′ N, 104°39′ E, 海拔450 m)进行。试验地土壤为黏壤, 前作水稻, pH 7.0, 前后2年播前0~20 cm土壤养分含量分别为有机质62.3 g kg–1和49.0 g kg–1、全氮3.1 g kg–1和3.0 g kg–1、全磷1.4 g kg–1和2.0 g kg–1、全钾16.2 g kg–1和24.6 g kg–1、有效氮146.3 mg kg–1和236.9 mg kg–1、有效磷18.2 mg kg–1和19.8 mg kg–1、有效钾203.5 mg kg–1和173.3 mg kg–1。小麦生育期间最高温和最低温从距试验田30 m的气象站获取(图1)。
采用二因素裂区设计, 施氮量为主区, 设正常施氮(Nn)和氮胁迫处理(Ns) 2个水平, 品种为副区, 6个品种, 重复3次。正常施氮处理, 即全生育期施N 150 kg hm–2, 其中底肥占40%, 拔节期追肥占60%; 氮胁迫处理, 全生育期施氮60 kg hm–2, 仅作为底肥。施氮水平的确定基于前期研究结果, 150 kg N hm–2即可发挥品种产量潜力, 又不会导致贪青迟熟和严重倒伏, 60 kg N hm–2可以满足小麦苗期的养分需求[13]。供试的6个品种分为两类, SDC 3个, 分别为川麦42、川麦104和绵麦367; NSC 3个, 分别为绵麦37、川农16和川麦30 (表1)。品种选择的依据是, SDC品种均入选过农业部主推品种名单, 在西南麦区已广泛种植, 其高产潜力已得到证实[10,12]; NSC品种中, 绵麦37为川麦104审定时的对照品种, 也是绵麦367的亲本之一, 川农16为绵麦367审定时的对照品种, 也是川麦104的亲本之一, 川麦30为川麦42的亲本之一。
所有处理磷(P2O5)、钾肥(K2O)全部作底肥一次性施用, 均为75 kg hm–2。N、P2O5和K2O分别由尿素、过磷酸钙和氯化钾提供, 每小区单独称量撒施。小区面积3 m × 4 m, 行距20 cm。2015年的播种期为10月30日至31日; 2016年绵麦37播种期是10月28日, 其余品种10月30日至31日, 绵麦37常年开花期较其他品种迟2~3 d, 为方便同天测试各品种开花期光合生理性状, 故2016年绵麦37提前2 d播种。为控制播种出苗质量, 采用免耕撬窝点播方式, 播后覆盖水稻秸秆。具体操作是, 9月下旬人工收获前茬水稻, 10月中旬将田间秸秆移除田外, 喷施灭生性除草剂, 10月下旬划好小区后, 在免耕条件下用撬窝器按照行距20 cm、窝距10 cm制作播种小窝, 小窝直径4.9 cm, 深度约2.5 cm。之后, 每窝人工播7颗挑选后的种子, 撒施底肥, 覆盖用铡刀粉碎的水稻秸秆。
2015年播种后即降雨, 不需浇水; 2016年播种后分小区喷水灌溉, 每小区灌溉量约120 kg。三叶期匀苗, 每窝留5株苗, 基本苗约250株 m–2。匀苗后防治1次苗期杂草。于次年的1月6日(小麦拔节始期)对Nn处理追肥(90 kg N hm–2), 将每小区所需的尿素溶入70 kg水中, 均匀泼洒在小区内, Ns处理也泼洒同样质量的清水。拔节孕穗期防治2次蚜虫、白粉病和条锈病, 在齐穗期和开花初期采用“一喷多防”方法防治蚜虫、赤霉病、白粉病和条锈病。小麦全生育期没有出现病虫草危害。
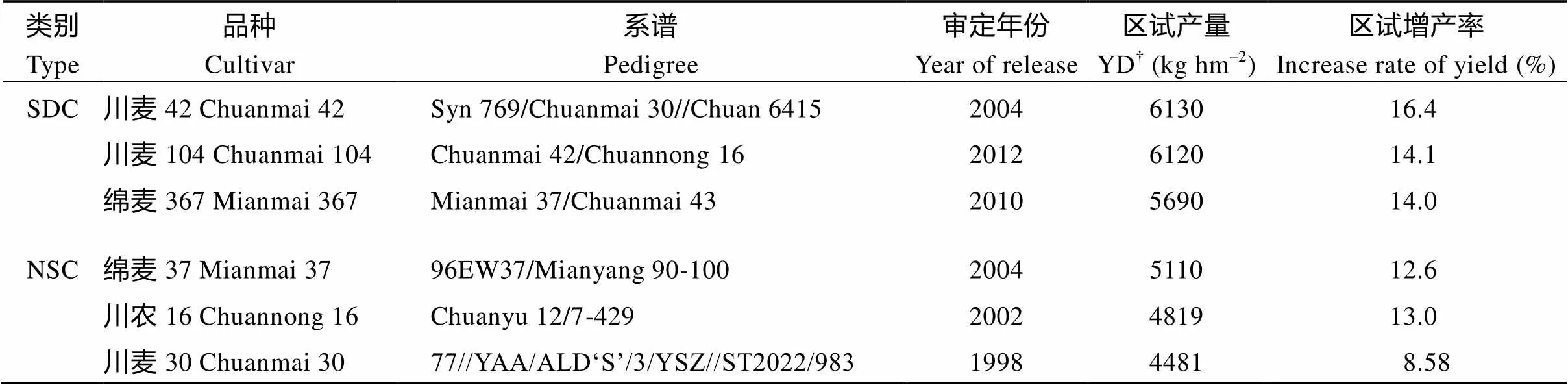
表1 参试品种相关信息
SDC: 人工合成六倍体小麦衍生品种; NSC: 非人工合成六倍体小麦衍生品种。†国家或四川省小麦区试平均产量。
SDC: synthetic hexaploid wheat-derived cultivar; NSC: non-synthetic hexaploid wheat-derived cultivar.†YD: the average yield in the national or Sichuan provincial wheat trails.
1.2 测试指标及方法
1.2.1 叶面积指数(leaf area index, LAI) 2017年,分别于开花期(花后0 d)和最大灌浆速率出现期(花后22 d)[14], 从每小区取3窝代表性植株, 剪除根系后, 数出总茎数, 将绿色叶片摘下于105℃杀青30 min, 70℃下烘干称重。同时另取每个处理15片代表性绿叶, 在叶片中间偏基部位置剪取边长为5 cm长方形, 测定每片小长方形的宽度, 之后烘干称重, 根据重量换算法估算取样绿叶总面积, 根据3窝植株占据的土地面积(0.06 m2)计算LAI, LAI = 取样绿叶面积/取样土地面积。
1.2.2 叶片叶绿素含量(SPAD) 于2016年和2017年开花期用蓝色毛线在每个小区标记开花时间、长势基本一致的15个单茎, 在花后0、7、12、17、22、27、32和37 d采用SPAD-502叶绿素计(Konica Minolta Sensing, Osaka, Japan), 测定顶三叶的SPAD值, 测定每个叶片上、中、下3个部位, 取平均值。
1.2.3 旗叶净光合速率(net photosynthetic rate, NPR)
于2016年和2017年开花期用红色毛线标记开花时间、长势基本一致的6个单茎, 在花后 0、22、32 d, 选择相对晴朗天气, 采用GFS3000光合分析系统(Walz, 德国)测试旗叶NPR。使用红蓝光源, 光量子通量密度为1000 μmol m–2s–1, 并将通气管放入一缓冲箱中以维持CO2浓度(约380 μmol CO2mol–1)稳定, 其他温湿度条件不加人为控制。2016年测定每个处理3个重复, 2017年测定2个重复, 测每个小区3~4个叶片, 取平均值。
1.2.4 群体光合速率(canopy photosynthetic rate, CAP) 2016年小麦播种时, 每个小区安装1个CAP测试底座, 底座长宽均为46 cm (内有2行、每行5窝小麦), 埋深10 cm, 于2017年花后0、22、32 d, 选择相对晴朗天气的10:00—12:00, 采用北京雨根科技有限公司设计生产的RR-8320移动式群体光合自动测定系统测定CAP。每个处理测定2个重复。参照Tang等[10]的测试和计算方法。
1.2.5 叶片硝态氮、铵态氮和可溶性糖含量 于2016年和2017年开花期用黑色毛线标记开花时间、长势基本一致的30个单茎, 于花后0 d和22 d各取10个茎的旗叶和倒2叶, 去除大叶脉后剪碎混合放入储存管, 经液氮速冻后, 置于–80℃冰箱保存, 用于硝态氮、铵态氮和可溶性糖含量测定, 以上指标均采用南京建成生物工程研究所生产试剂盒测试。
1.2.6 产量及构成 各小区实收测产, 扣除取样损失后计算标准水分(13%)的籽粒产量。收获前, 从每小区取代表性的4窝植株, 剪掉根系, 记录有效茎数, 并随机取25个有效茎调查穗粒数。考种结束后, 将取样植株分为籽粒和非籽粒两部分, 分别烘干称重, 计算收获指数、生物产量和千粒重(调整至13%含水量)。
1.2.7 氮素利用效率(nitrogen utilization efficiency, NUtE) 植株样本烘干称重后, 用凯氏定氮法分别测定植株和籽粒全氮含量, NUtE = 籽粒产量/成熟期植株氮素积累量[2]。
1.3 统计分析
采用Microsoft Excel 2007绘图, Statistical Analysis System (SAS) Version 8.0 进行方差分析和Pearson 线性相关分析, 同一年同一氮水平下品种的产量及产量构成先用最小显著极差(Least Significant Difference, LSD)法进行多重比较(α=0.05), 之后将每个氮处理下同类品种调查指标分别平均, 用测验法比较两类品种的差异。
2 结果与分析
2.1 气候参数
2016年全生育期平均气温、平均最高、最低气温分别为13.2、17.8和9.4℃, 2017年分别为13.2、17.5和9.2℃ (图1)。2016年12月中下旬和1月下旬遭遇极端低温, 1月下旬平均温度3.9℃, 显著低于常年水平(5℃), 不同品种此时已拔3~5 cm, 低温导致主茎大量死亡, 穗数低于2017年。2017年, 3月上中旬多数日期平均温度低于10℃, 低温持续时间超过20 d, 此时正处于小麦孕穗期, 造成了小穗基部可孕小花败育, 尤其是低温敏感型品种川麦42, 穗粒数降幅明显。

图1 小麦生育期间(11月至翌年5月)的日最高温和最低温
2.2 籽粒产量、产量构成和生物产量
由表2可知, 2个供氮水平下, SDC较NSC产量均有优势。在正常供氮条件下(Nn), SDC较NSC两年平均增产14.4%, 氮胁迫下(Nd) 2年平均增产15.9%。2种氮水平下, SDC的单位面积粒数、生物量均值均高于NSC, 除2016年氮胁迫处理外, 其他环境下SDC的千粒重也高于NSC。
和正常供氮相比, 氮胁迫下, SDC两年产量降幅分别为19.1%和20.0%, NSC降幅分别为22.9%和17.8%; 单位面积粒数、收获指数的降幅NSC均大于SDC, 而千粒重和生物产量的变幅2年趋势不一致。同一类型品种对氮胁迫的反应也有变异, 和川麦42、川麦104相比, 绵麦367在氮胁迫下的产量、单位面积粒数降幅相对较小; 而和绵麦37、川农16相比, 川麦30在氮胁迫下的产量、单位面积粒数和收获指数的降幅较大。
所有的数据Pearson相关分析表明, 籽粒产量与单位面积粒数(2=0.63**)、生物产量(2=0.84**)及收获指数(2=0.49**)均呈极显著正相关。其中对于SDC类型, 各参数与产量的相关性依次为生物产量(2=0.76**)、单位面积粒数(2=0.65**)和收获指数(2=0.45*); 对于NSC类型, 依次为生物产量(2=0.82**)、收获指数(2=0.52**)和单位面积粒数(2=0.48**)。说明稳定氮胁迫下的生物产量对于两类品种产量建成均有重要意义。
2.3 光合生理特性
2.3.1 叶面积指数(LAI) 干物质积累量与作物光合面积和光合强度密切相关。开花期两类品种在2种氮素水平下的LAI均值接近, 且氮胁迫下NSC略高于SDC (图2)。花后22 d, 两类品种的LAI均下降, NSC在2个供氮水平下的降幅(39.1%、63.1%)均大于SDC (25.3%、55.0%)。说明氮胁迫下, 灌浆中后期SDC的光合面积大于NSC, 尤其是绵麦367, 而对照品种川麦30的LAI在花后22 d接近于0。
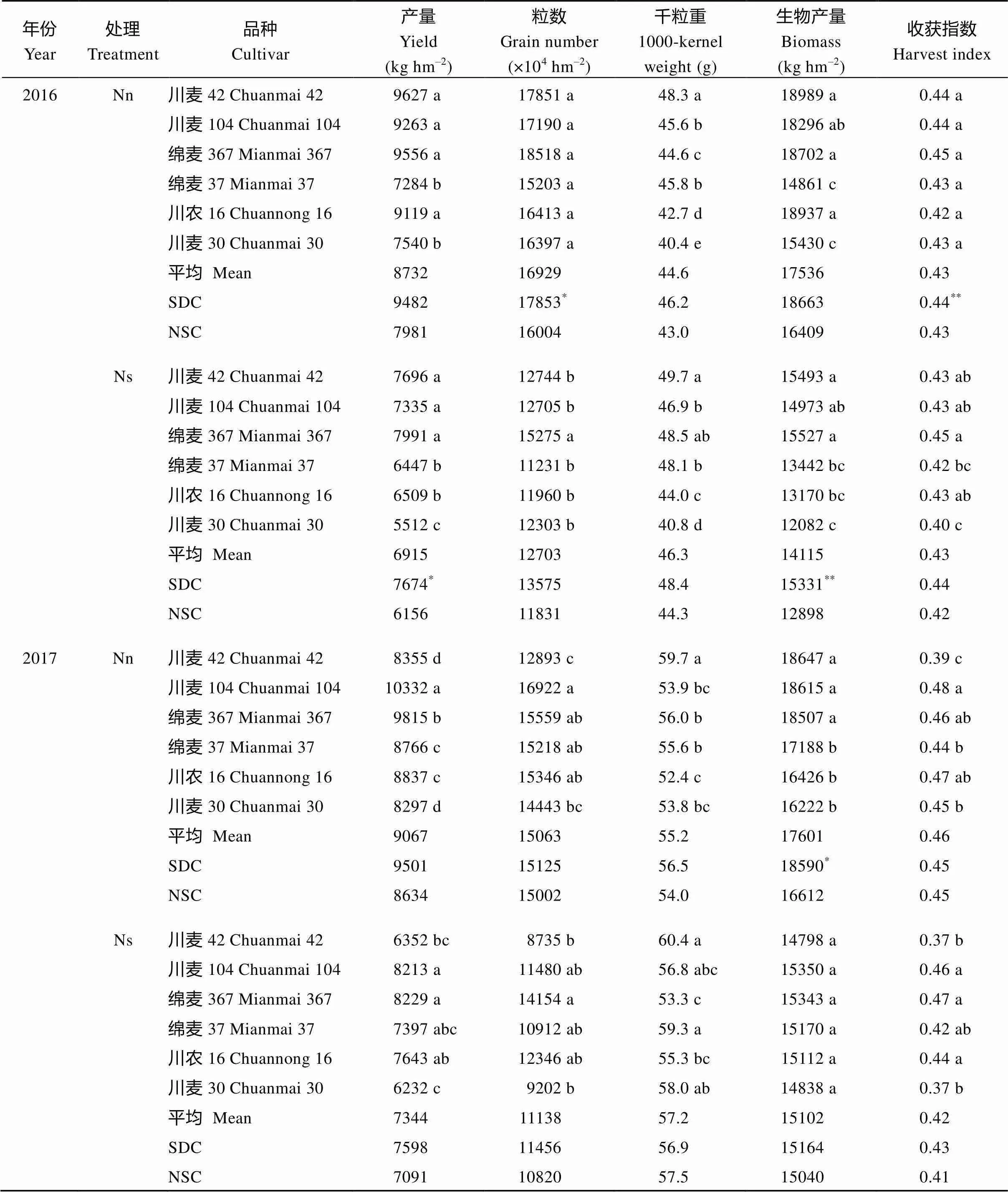
表2 不同小麦品种产量、产量构成及生物产量对中后期氮胁迫的响应
Nn: 正常施氮处理, Ns: 氮胁迫处理。同列标明不同字母的值在同一年同一施氮量下品种间差异显著(< 0.05)。*和**分别代表SDC和NSC间差异达显著和极显著水平(*< 0.05,**< 0.01)。其他缩写同表1。
Nn: Normal nitrogen application; Ns: Nitrogen stress treatment. Values followed by different letters in the same column are significantly different between cultivars for each nitrogen treatment in the same year (< 0.05).*and**mean significant and highly significant difference between SDC and NSC (*< 0.05,**< 0.01), respectively. Other abbreviations are the same as those given in Table 1.
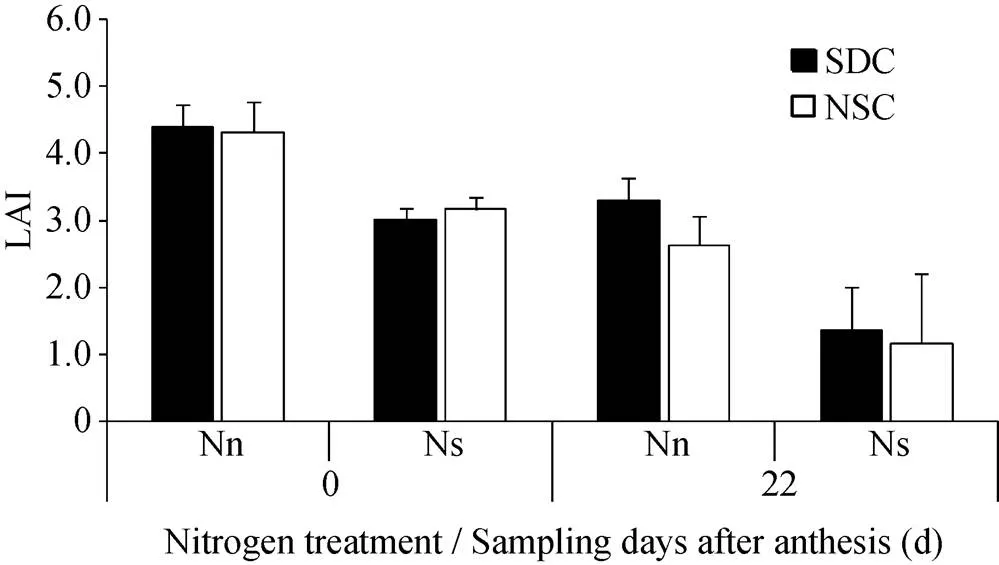
图2 SDC和NSC叶面积指数对中后期氮胁迫的响应(2017)
Nn: 正常施氮处理; Ns: 氮胁迫处理。误差线为标准差。图中数据为同一施氮水平下的同一类3个品种的平均值。其他缩写同表1。
Nn: Normal nitrogen application; Ns: Nitrogen stress treatment. The error bar is standard deviation. The data in the figure are the average values of three cultivars in the same category under the same nitrogen application level. Other abbreviations are the same as those given in Table 1.
2.3.2 SPAD值 开花灌浆阶段, 2个施氮水平下SDC旗叶和倒二叶的SPAD始终高于NSC, 在氮胁迫下, 二者的差距增加(图3)。正常供氮条件下, 两类品种倒3叶的SPAD差异较小, 但氮胁迫下SDC多数测试时间内高于NSC。对于旗叶, 氮胁迫下, SDC在花后27 d SPAD出现大幅下降, 绝对值降至30以下, 而NSC在花后22 d的绝对值已不足30。
2.3.3 光合效率 旗叶净光合速率(NPR)和群体光合速率(CAP)分别反映了植株个体和群体光合效率。图4表明, 开花期, 2016年两类品种的NPR差异较小, 2017年NSC在2个氮水平的NPR略高于SDC。花后22 d, 2个氮水平下NSC的NPR均值均不及SDC, 花后32 d二者差距进一步加大, 2年趋势基本一致。

图3 SDC和NSC上三叶SPAD值对中后期氮胁迫的响应
Nn: 正常施氮处理; Ns: 氮胁迫处理。图中数据为同一施氮水平下的同一类3个品种的平均值。其他缩写同表1。
Nn: normal nitrogen application; Ns: nitrogen stress treatment. The data in the figure are the average values of three cultivars in the same category under the same nitrogen application level. Other abbreviations are the same as those given in Table 1.

图4 SDC和NSC旗叶净光合速率(NPR)对中后期氮胁迫的响应
缩写同表1和图2。误差线为标准差。图中数据为同一施氮水平下的同一类3个品种的平均值。
Abbreviations are the same as those given in Table 1 and Fig. 2. The error bar is standard deviation. The data in the figure are the average values of three cultivars in the same category under the same nitrogen application level.
2个施氮水平下, 两类品种开花期CAP接近(图5)。在花后22 d, NSC不同施氮水平下的CAP均有大幅下降, 降幅分别为47.2%和50.4%, 其中川麦30的降幅又大于其他2个NSC品种; 而SDC仅在氮胁迫处理下才有大幅下降, 且降幅小于NSC。
2.4 旗叶硝态氮、铵态氮和可溶性糖含量
表3表明, 硝态氮2年变化趋势基本一致, 正常供氮条件下, SDC叶片低于NSC, 2017年二者的差异缩小。但在氮胁迫下, SDC叶片积累更多的硝态氮, 2个取样时期趋势一致, 2017年开花期, 两类品种的差异达显著水平。和硝态氮的变化趋势不同, 2个施氮水平下多数取样时期SDC的铵态氮含量均高于NSC。
两类品种在2个氮素水平下叶片可溶性糖含量也有差异(表3), 2年趋势基本一致, 在正常供氮条件下, SDC的可溶性糖含量低于NSC, 而在氮胁迫下SDC的可溶性糖含量高于NSC。2017年氮胁迫处理的开花期, 二者差异达显著水平。

图5 SDC和NSC群体光合速率(CAP)对中后期氮胁迫的响应(2017)
缩写同表1和图2。误差线为标准差。图中数据为同一施氮水平下的同一类3个品种的平均值。
Abbreviations are the same as those given in Table 1 and Fig. 2. The error bar is standard deviation. The data in the figure are the average values of three cultivars in the same category under the same nitrogen application level.
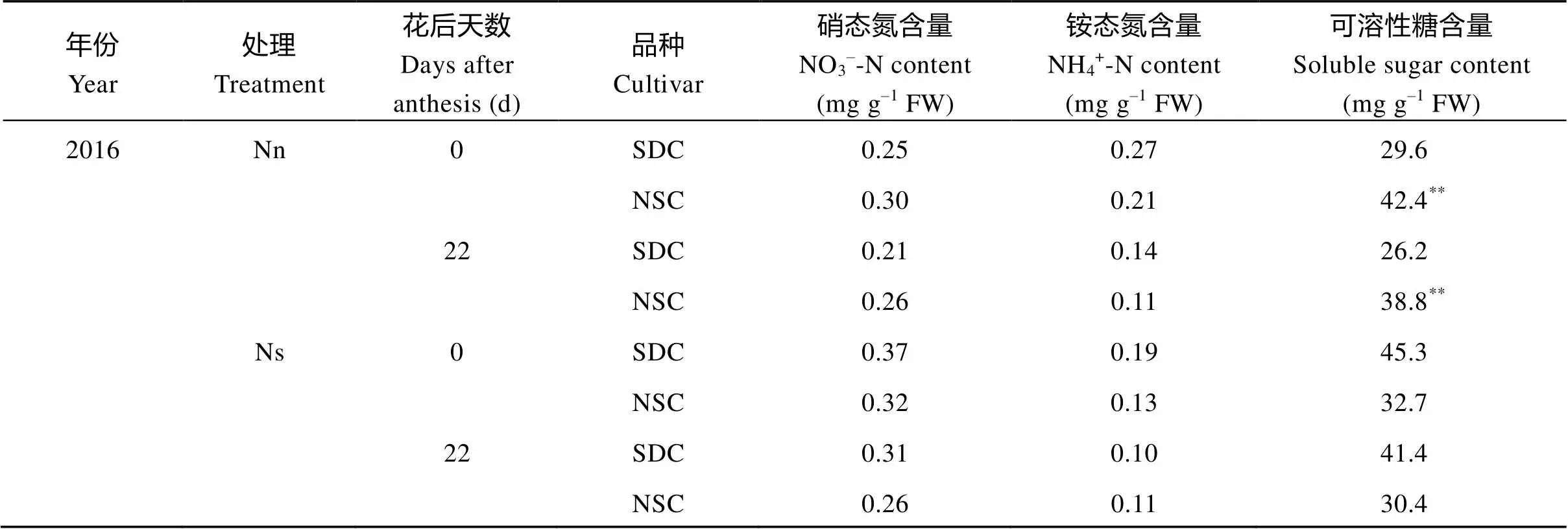
表3 SDC和NSC旗叶和倒2叶硝态氮、铵态氮和可溶性糖含量对中后期氮胁迫的响应
(续表3)

年份Year处理 Treatment花后天数Days after anthesis (d)品种Cultivar硝态氮含量NO3–-N content(mg g–1 FW)铵态氮含量NH4+-N content(mg g–1 FW)可溶性糖含量Soluble sugar content(mg g–1 FW) 2017Nn0SDC0.080.1230.6 NSC0.090.1131.9 22SDC0.100.18**21.1 NSC0.100.1124.2 Ns0SDC0.11*0.1038.5* NSC0.090.1129.5 22SDC0.100.1231.9 NSC0.100.0932.7
Nn: 正常施氮处理; Ns: 氮胁迫处理。表中数据为同一施氮水平下的同一类3个品种的平均值。*和**分别代表SDC和NSC间差异达显著和极显著水平(*< 0.05,**< 0.01)。其他缩写同表1。
Nn: Normal nitrogen application; Ns: Nitrogen stress treatment. The data in the table are the average values of three cultivars in the same category under the same nitrogen application level.*and**mean significant and highly significant difference between SDC and NSC (*< 0.05,**< 0.01), respectively. Other abbreviations are the same as those given in Table 1.
2.5 氮素利用效率(NUtE)
NUtE是反应作物氮素利用的综合指标, 从图6可以看出, 低氮处理的NUtE高于正常施氮处理, SDC较NSC有更高的NUtE, 尤其是在氮胁迫下。

图6 SDC和NSC氮素利用效率(NUtE)对中后期氮胁迫的响应
缩写同表1和图2。误差线为标准差。图中数据为同一施氮水平下的同一类3个品种的平均值。
Abbreviations are the same as those given in Table 1 and Fig. 2. The Error bar is standard deviation. The data in the figure are the average values of three cultivars in the same category under the same nitrogen application level.
3 讨论
引入近源基因、拓展遗传多样性已在小麦抗逆育种中得到广泛应用[9]。和普通小麦相比, 以川麦42、川麦104为代表的SDC在西南麦区多个生态点都有更好的产量表现[10,12], 其优异的产量性状与导入的SHW基因有关, 尤其是单位面积粒数、籽粒生产率[11,15]。本研究中, 和正常施氮处理(150 kg N hm–2)相比, 氮胁迫下两类品种的产量均有大幅下降, 2年平均降幅接近(19.6% vs. 20.4%), 但氮胁迫下SDC的绝对产量高于NSC。Hawkesford等[16]指出, 提升小麦的产量潜力可以提高其在逆境下的产量表现, 英国小麦品种灌溉条件下与干旱胁迫下的产量间极显著正相关。Nehe等[17]的研究也证实, 在高氮下产量有优势的印度小麦品种在低氮胁迫下产量也较高。由此推测, SDC优异的产量建成特性在氮胁迫下仍能发挥。
本研究中, 两类品种的产量与单位面积粒数、生物产量均呈显著正相关, 单位面积粒数反应了库的容量, 而生物产量反映了作物的生产能力。引入SHW基因后, SDC的单位面积粒数有了大幅增加[11], 较高的库容为SDC氮胁迫下的产量形成奠定了基础。产量的建成最终决定于作物光合能力, 而光合能力与光合面积(LAI)和SPAD都有关系[18-19]。在氮胁迫下, SDC在花后22 d LAI降幅小于NSC, 功能叶衰老速度慢, 功能持续期长, 这一方面可能与高产品种对土壤营养的高效吸收能力有关[17], 另一方面可能与库的反馈调节有关, 较大的库容可以促进叶片光合潜力的发挥和光合产物的运转[20]。SDC功能叶较高的SPAD为氮胁迫下光合能力提升奠定了基础。得益于LAI和SPAD的优势, 氮胁迫下, 灌浆中后期SDC的NPR和CAP均高于NSC, 干物质积累量更大、籽粒灌浆充实度更高, 这是SDC收获更高的产量的重要原因。
氮素亏缺下叶片碳氮比失衡, 从而诱导和加速叶片衰老, 低氮下耐衰品种(缺氮不敏感品种)叶片氮含量高、维持碳氮代谢平衡的能力强[21]。本研究中, 氮胁迫下, SDC花期功能叶硝态氮含量高于NSC, 这可能是SDC维持灌浆中后期较强叶片功能原因之一。可溶性糖是逆境下植物主要的渗透调节物质[22], 氮胁迫下SDC功能叶可溶性糖含量高, 对于稳定细胞功能也有重要意义。其他研究也证实, 持绿期长的小麦品种灌浆中后期叶片、茎鞘中的可溶性糖含量较高, 光合作用强, 灌浆速率高[23], 且作为氮同化产物的铵态氮, SDC也高于NSC, 这些证据都表明在氮胁迫下SDC仍然维持较高的代谢能力, 与其叶片的光合生理表现一致。
4 结论
氮胁迫下, SDC和NSC产量降幅接近, 但绝对产量是SDC高于NSC。SDC耐低氮胁迫一方面与其较高的库容有关, 另一方面与其通过调节碳氮代谢延缓叶片衰老、维持较高的物质生产能力有关, 这些有益的性状可在未来小麦遗传改良中加以利用。
[1] Zörb C, Ludewig U, Hawkesford M J. Perspective on wheat yield and quality with reduced nitrogen supply., 2018, 23: 1029–1037.
[2] 吴晓丽, 李朝苏, 汤永禄, 刘于斌, 李伯群, 樊高琼, 熊涛. 氮肥运筹对小麦产量、氮素利用效率和光能利用率的影响. 应用生态学报, 2017, 28: 1889–1898. Wu X L, Li C S, Tang Y L, Liu Y B, Li B Q, Fan G Q, Xiong T. Effect of nitrogen management modes on grain yield, nitrogen use efficiency and light use efficiency of wheat., 2017, 28: 1889–1898 (in Chinese with English abstract).
[3] Tian Z W, Liu X X, Gu S L, Yu J H, Zhang L, Zhang W W, Jiang D, Cao W X, Dai T B. Postponed and reduced basal nitrogen application improves nitrogen use efficiency and plant growth of winter wheat., 2018, 17: 2648–2661.
[4] 张士昌, 史占良, 李孟军, 李亚青, 底瑞耀, 李雁鸣. 长期定位氮胁迫对小麦碳氮代谢氮素利用及产量的影响. 河南农业科学, 2016, 45(12): 13–19. Zhang S C, Shi Z L, Li M J, Li Y Q, Di R Y, Li Y M. Effect of long-term nitrogen stress on carbon and nitrogen metabolism nitrogen use efficiency and yield of wheat., 2016, 45(12): 13–19 (in Chinese with English abstract).
[5] Papakosta D K, Gagianas A A. Nitrogen and dry matter accumulation, remobilization, and losses for Mediterranean wheat during grain filling., 1991, 83: 864–870.
[6] Prystupa P, Savin R, Slafer G A. Grain number and its relationship with dry matter, N and P in the spikes at heading in response to N×P fertilization in barley., 2004, 90: 245–254.
[7] Madani A, Shirani–Rad A, Pazoki A, Nourmohammadi G, Zarghami R, Mokhtassi-Bidgol A. The impact of source or sink limitations on yield formation of winter wheat (L.) due to post–anthesis water and nitrogen deficiencies.on, 2010, 56: 218–227.
[8] 杨慧勇, 林凡云, 陆琼娴, 徐剑宏, 史建荣. 中国冬、春性小麦品种遗传多样性的微卫星标记分析. 麦类作物学报, 2007, 27: 555–559. Yang H Y, Lin F Y, Lu Q X, Xu J H, Shi J R. Genetic diversity of Chinese winter and spring wheat varieties detected by microsatellite markers., 2007, 27: 555–559 (in Chinese with English abstract).
[9] Li A L, Liu D C, Yang W Y, Kishii M, Mao L. Synthetic hexaploid wheat: yesterday, today, and tomorrow., 2018, 4: 552–558.
[10] Tang Y L, Rosemarne G M, Li C S, Wu X L, Yang W Y, Wu C. Physiological factors under pinning grain yield improvement of synthetic derived wheat in southeastern China., 2015, 55: 98–112.
[11] 李俊, 魏会廷, 胡晓蓉, 李朝苏, 汤永禄, 刘登才, 杨武云. 川麦42中源于人工合成小麦的一个高产位点鉴定. 作物学报, 2011, 37: 255–262. Li J, Wei H T, Hu X R, Li C S, Tang Y L, Liu D C, Yang W Y. Identification of a high-yield introgression locus from synthetic hexaploid wheat in Chuanmai 42., 2011, 37: 255−262 (in Chinese with English abstract).
[12] 汤永禄, 李朝苏, 吴晓丽, 吴春, 杨武云, 黄钢, 马孝玲. 人工合成小麦衍生品种的物质积累、冠层结构及群体光合特性. 中国农业科学, 2014, 47: 844−855. Tang Y L, Li C S, Wu X L, Wu C, Yang W Y, Huang G, Ma X L. Accumulation of dry matter, canopy structure and photosynthesis of synthetic hexaploid wheat-derived high-yielding varieties grown in Sichuan Basin, China., 2014, 47: 844−855 (in Chinese with English abstract).
[13] 李朝苏, 汤永禄, 吴春, 吴晓丽, 黄钢, 何刚, 郭大明. 施氮量对四川盆地小麦生长及灌浆的影响. 植物营养与肥料学报, 2015, 21: 873−883. Li C S, Tang Y L, Wu C, Wu X L, Huang G, He G, Guo D M. Effect of N rate on growth and grain filling of wheat in Sichuan Basin., 2015, 21: 873−883 (in Chinese with English abstract).
[14] 汤永禄, 吴晓丽, 吴元奇, 李朝苏, 吴春, 郭大明. 小麦籽粒灌浆参数的基因型差异及其稳定性分析. 中国农业大学学报, 2014, 19(1): 9−20. Tang Y L, Wu X L, Wu Y Q, Li C S, Wu C, Guo D M. Analysis of the genotypic variation and stability of grain filling parameters of wheat., 2014, 19(1): 9−20 (in Chinese with English abstract).
[15] 李俊, 魏会廷, 杨粟洁, 李朝苏, 汤永禄, 胡晓蓉, 杨武云. 川麦42的1BS染色体臂对小麦主要农艺性状的遗传效应. 作物学报, 2009, 35: 2167−2173. Li J, Wei H T, Yang S J, Li C S, Tang Y L, Hu X R, Yang W Y. Genetic effects of 1BS chromosome arm on the main agronomic traits in Chuanmai 42., 2009, 35: 2167−2173 (in Chinese with English abstract).
[16] Hawkesford M J, Araus J L, Park R, Calderini D, Miralles D, Shen T M, Zhang J P, Parry M A J. Prospects of doubling global wheat yields., 2013, 2: 34−48.
[17] Nehe A S, Misra S, Murchie E H, Chinnathambi K, Foulkes M J. Genetic variation in N-use efficiency and associated traits in Indian wheat cultivars., 2018, 225: 152−162.
[18] 剧成欣, 周著彪, 赵步洪, 王志琴, 杨建昌. 不同氮敏感性粳稻品种的氮代谢与光合特性比较. 作物学报, 2018, 44: 405–413.Ju C X, Zhou Z B, Zhao B H, Wang Z Q, Yang J C. Comparison in nitrogen metabolism and photosynthetic characteristics betweenrice varieties differing in nitrogen sensitivity., 2018, 44: 405–413 (in Chinese with English abstract).
[19] 韩胜芳, 李淑文, 文宏达, 李雁鸣, 肖凯. 不同氮效率小麦品种的光合碳同化特性. 植物营养与肥料学报, 2006, 12: 797–804. Han S F, Li S W, Wen H D, Li Y M, Xiao K. Characterization of photosynthetic carbon assimilation in wheat varieties with different N efficiency., 2006, 12: 797–804 (in Chinese with English abstract).
[20] 郭文善, 封超年, 严六零, 彭永欣, 朱新开, 宗爱国. 小麦开花后源库关系分析. 作物学报, 1995, 21: 334–340. Guo W S, Feng C N, Yan L L, Peng Y X, Zhu X K, Zong A G. Analysis of source-sink relationship after anthesis in wheat., 1995, 21: 334–340 (in Chinese with English abstract).
[21] 曹蓓蓓, 王仕稳, 齐凌云, 陈道钳, 殷俐娜, 邓西平. 小麦苗期叶片碳氮平衡与低氮诱导的叶片衰老之间的关系. 麦类作物学报, 2017, 37: 673–679. Cao B B, Wang S W, Qi L Y, Chen D Q, Yin L N, Deng X P. Carbon/nitrogen balance involved in nitrogen deficiency induced leaf senescence in wheat seedling., 2017, 37: 673–679 (in Chinese with English abstract).
[22] 李春燕, 陈思思, 徐雯, 李东升, 顾骁, 朱新开, 郭文善, 封超年. 苗期低温胁迫对扬麦16叶片抗氧化酶和渗透调节物质的影响. 作物学报, 2011, 37: 2293–2298. Li C Y, Chen S S, Xu W, Li D S, G X, Zhu X K, Guo W S, Feng C N. Effect of low temperature at seedling stage on antioxidation enzymes and cytoplasmic osmoticum of leaves in wheat cultivar Yangmai 16., 2011, 37: 2293–2298 (in Chinese with English abstract).
[23] 龚月桦. 持绿小麦的筛选及同化物的积累与转运. 西北农林科技大学硕士论文, 陕西杨凌, 2008. pp 12–22.Gong Y H. The Filtration of Stay Green Wheat and Study on the Accumulation and Transportation of Assimilates in Stay Green Wheat. MS Thesis of Northwest A&F University, Yangling, Shaanxi, China, 2008. pp 12–22 (in Chinese with English abstract).
Response of yield and associated physiological characteristics for different wheat cultivars to nitrogen stress at mid–late growth stage
LI Chao-Su1, WU Xiao-Li1, TANG Yong-Lu1,*, LI Jun1, MA Xiao-Ling1, LI Shi-Zhao1, HUANG Ming-Bo2, and LIU Miao1
1Crop Research Institute, Sichuan Academy of Agricultural Sciences / Crop Ecophysiology and Cultivation Key Laboratory of Sichuan Province, Chengdu 610066, Sichuan, China;2Guanghan Productivity Promotion Center, Guanghan 618300, Sichuan, China
Soil nitrogen (N) deficiency at mid-late growth stage is one of the serious factors leading to lowered grain yield of wheat. The high yield potential of synthetic hexaploid wheat-derived cultivar (SDC) has been well documented, however, its responses to N deficiency at mid-late growth stage need further study. Six cultivars were grown under two fertilizer-N applied conditions over two consecutive growing seasons (2015–2017). The cultivars consisted of three typical SDC (Chuanmai 42, Chuanmai 104 and Mianmai 367) and three non–synthetic hexaploid wheat–derived cultivar (NSC; Mianmai 37, Chuannong 16, and Chuanmai 30). Two N treatments consisted of normal N application (Nn, 150 kg hm–2, basal fertilizer 40%, top dressing 60%) and N stress (Ns, 60 kg hm–2, basal fertilizer only), and grain yield and associated physiological traits of these wheat cultivars in response to N deficiency at mid–late growth stage were studied. It turned out that the mean yield reduction of SDC (19.6%) and NSC (20.4%) was close under N stress, while SDC showed 14.4% (Nn) and 15.9% (Ns) advantages on yield than NSC at both N treatments. Besides, the biomass and grain number per unit area of SDC were higher than those of NSC. At anthesis, SDC and NSC had roughly the same leaf area index (LAI) values, whereas the LAI decline in SDC was less than that in NSC at mid–late grain–filling stage. Compared with NSC, the LAI of SDC was 25.1% (Nn) and 16.0% (Ns) higher at 22 days after anthesis, respectively. The SPAD values of flag and penultimate leaves in SDC were always higher than those in NSC at both N treatments during grain filling period, and the gap between them was increased under N stress. The differences in net photosynthetic rate (NPR) and canopy photosynthetic rate (CAP) between the two types of wheat also mainly appeared at mid–late grain–filling stage, and SDC still had advantages compared with NSC under Ns. In addition, the nitrate N, ammonium N and soluble sugar content in flag and penultimate leaves in SDC were higher than those in NSC under N stress condition. At last, SDC had higher N utilization efficiency (NUtE) than NSC, which difference between SDC and NSC was further increased by N stress. Overall, the above results indicate that the productivity of SDC is stronger than that of NSC at low N condition, which might be related to the higher sink capacity and longer leaf function period in SDC.
synthetic hexaploid wheat-derived cultivar; nitrogen stress; grain yield; photosynthetic characteristics; nitrogen utilization efficiency
2018-11-20;
2019-04-15;
2019-04-23.
10.3724/SP.J.1006.2019.81083
汤永禄, E-mail: ttyycc88@163.com, Tel: 028-84504601
E-mail: xiaoli1755@163.com, Tel: 028-84504560
本研究由国家自然科学基金项目(31571590), 国家重点研发计划项目(2016YFD0300406)和四川省农作物育种攻关项目(2016NYZ0051)资助。
This study was supported by the National Natural Science Foundation of China (31571590), the National Key R&D Program of China (2016YFD0300406), and the Crops Breeding Project in Sichuan Province (2016NYZ0051) .
URL:http://kns.cnki.net/kcms/detail/11.1809.s.20190422.2150.004.html
