臭氧浓度升高和干旱对紫丁香光合生理特性的影响
2019-07-22陶汉成徐胜付伟
陶汉成 徐胜 付伟


摘要:在全球变化背景下,近地面臭氧浓度和干旱不断加剧,共同威胁着城市树木的生长。以我国北方常见灌木紫丁香(Syringa oblata Lindl.)为研究对象,利用开顶箱(OTC)熏蒸,研究干旱(田间持水量为30%~35%)和O3(浓度为80 nmol/mol)对紫丁香的光合作用和生理生态的影响。结果表明,干旱和O3处理降低了叶片净光合速率(Pn)、气孔导度(Gs)和蒸腾速率(Tr),光合作用受抑制的主要原因是气孔限制。在O3、干旱、复合处理下,紫丁香叶片脱落酸(ABA)含量在处理90 d时分别较对照显著升高了6.0%、38.9%、35.1%(P<0.05),可溶性蛋白含量在处理60 d时分别较对照降低了15.7%、8.8%、13.1%(P<0.05),SOD活性上升,干旱提高了ABA含量,诱导气孔闭合,与O3的交互作用使得可溶性蛋白含量的降幅减缓。在O3、干旱和复合处理下,紫丁香叶片叶绿素含量、类胡萝卜素含量无显著变化,但是处理60 d时复合处理明显低于单因子处理。适度干旱减缓了臭氧对紫丁香光合作用的不利影响。
关键词:O3;干旱;紫丁香;生理指标;复合胁迫
中图分类号: S685.260.1 文献标志码: A 文章编号:1002-1302(2019)11-0186-05
近地层臭氧(O3)具有强氧化性,过高的浓度往往会影响植物生长、农作物产量及人类健康[1]。随着城市化和工业化的发展,O3前体物(氮氧化物、挥发性有机化合物等)的排放量增加,导致近地层O3浓度急剧上升[2]。沈阳市是北方典型的重工业城市,夏季的平均O3浓度已经超过了 80 nmol/mol[3],超出了O3对植物造成影响的临界浓度[4]。自1950年以来,我国北方地区干旱灾害的严重程度、持续时间和旱灾发生范围都呈现出增加的趋势[5]。在全球变暖大背景下,O3浓度升高和干旱经常同时期出现,共同威胁着植物的生长[6]。
研究表明,高浓度O3会使叶片褪绿变黄,衰老加速,破坏植物叶片结构[7];诱导植物体活性氧(ROS)的累积,降解叶绿素,降低植物净光合速率[8-9];加快气孔闭合,限制CO2的吸收,植物生物量显著降低,地下部分生长被抑制[10]。干旱也会对植物产生负面效果,减小气孔开度,使CO2供应受阻,降低净光合速率[11];破坏ROS代谢平衡,伤害细胞结构,使植物加速衰老甚至死亡[12]。关于高浓度O3和干旱复合作用对植物的影响,主要观点如下:O3作用下乙烯合成量增加,降低了脱落酸(ABA)调控气孔的敏感性[13],加重了植物在干旱胁迫下的水分散失,造成伤害加深的协同作用[14-15];干旱诱导气孔关闭,减少了O3吸收剂量,起到保护植物的拮抗作用[16];也有结果表明,O3和干旱之间没有交互作用[17]。
紫丁香(Syringa oblata Lindl.)为木犀科丁香属落叶灌木,其树形优美,花色艳丽,香味浓烈,具有耐寒、耐阴、耐干旱等特性,是北方常见的园林绿化树种。目前,关于紫丁香逆境生理方面的研究多集中在冷害、盐碱、涝害、SO2等方面[18-21],尚未见O3与干旱复合胁迫对其生理影响的报道。本试验以紫丁香幼苗为例,利用开顶式气室(OTCs)熏蒸,研究O3浓度升高和干旱对于紫丁香的光合作用及生理指标的影响,揭示在干旱和O3浓度升高条件下紫丁香的生理变化规律,验证干旱是否减缓了臭氧对植物光合作用的不利影响,尤其在高污染城市环境下对绿化树种如紫丁香一类常用灌木的引种栽培养护等提供参考。
1 材料与方法
1.1 材料与方法
试验地点在中国科学院沈阳树木园(41°46′N、123°26′E),属温带半湿润大陆性气候。本试验在开顶箱(open top chamber,OTC)内进行。OTC(直径4 m、高3 m的正八边形玻璃气室)内有配套的通气、通风设备和发生传感装置,包括XH-2000高频O3发生器(广州鑫弘智能环保设备有限公司)、Series-900固定式气体检测仪(新西兰Aeroqual有限责任公司)、温湿度传感器以及数据分析与自控式充气系统。
试验以紫丁香为研究对象,于2016年3月在沈阳苗圃购买一年生苗木并且栽种于塑料盆(口径20 cm、高25 cm)中,培养基质为含园土、草炭土、炉灰(体积比为1 ∶ 1 ∶ 1)的匀质混合土。6月1日选取生长状况良好、长势一致的苗木移入开顶箱,每个处理放置3盆作为重复,在开顶箱内的位置随机分布。本试验设置了4个处理,分别是CK(自然O3浓度和正常供水)处理、EO(高浓度O3和正常供水)处理、DT(自然O3浓度和干旱)处理和EO+DT(高浓度O3和干旱)处理。正常供水的土壤水分含量为75%~80%的饱和田间持水量,干旱胁迫设置为30%~35%的饱和田间持水量,通过土壤水分速測仪监测,定量浇水来控制干旱。自然O3浓度约为 40 nmol/mol,高浓度O3设置为80 nmol/mol。于2016年6月16日至8月30日开始O3熏蒸,熏蒸时间为10 h/d(08:00—18:00)。于30、60 d后测定光合气体交换参数并采集叶片进行生理指标的测定。
1.2 测定指标
光合气体交换参数的测定:于晴朗天气的09:00—11:00选择位于植株冠层的成熟健康叶片(3张/株),在光合有效辐射(PAR)=1 000 μmol/(m2·s)下采用LI-6400便携式光合测定仪测定植物叶片的净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)。
叶片色素(总叶绿素和类胡萝卜素)含量的测定参考乙醇混合液法[22],取各处理植株的成熟叶片,去主脉后剪碎,称取0.2 g,加入95%乙醇,暗处浸提48 h,以95%乙醇为对照,测定663、645、470 nm波长下的光密度(D)值。超氧化物歧化酶(SOD)活性参考抑制氮蓝四唑(NBT)光还原法测定[23],以单位时间内抑制光化还原50%的NBT为1个酶活单位(U)。采用考马斯亮蓝试剂测定可溶性蛋白含量[24]。脱落酸含量采用植物激素脱落酸酶联免疫吸附实验(ELISA)检测试剂盒测定。
1.3 数据分析
采用Excel 2016和SPSS 16.0软件进行统计分析,以O3和干旱分别作为影响因子对各指标的作用以及交互作用进行双因素方差分析。所有数据在处理前均进行了方差齐性和正态分布检验。处理组间采用Duncans多重比较法检验。
2 结果与分析
2.1 对紫丁香叶片光合气体交换参数的影响
由图1可知,紫丁香叶片净光合速率(Pn)的EO处理与CK处理相比随时间呈下降趋势,在60 d比CK处理显著降低了32%(P<0.05);DT、EO+DT处理的叶片净光合速率与CK相比先升后降,60 d时分别比CK处理显著降低了46.5%和35.6%(P<0.05),EO+DT处理的Pn低于EO处理而略高于DT处理。气孔导度(Gs)在EO处理下随时间呈下降趋势,60 d时比CK处理显著下降了51.4%(P<0.05);在DT、EO+DT处理下,30 d时分别比CK处理显著下降56.22%和43.16%,60 d时分别比CK处理显著下降55.6%和55.2%。蒸腾速率的变化趋势与气孔导度一致。
2.2 对紫丁香叶片逆境生理的影响
由图2可知,与对照相比,紫丁香总叶绿素含量在EO、DT处理下呈上升趋势,60 d时分别比CK处理上升了25.5%和14.6%;EO+DT处理下在60 d时显著低于EO、DT单因子处理(P<0.05),较CK处理呈先升后降趋势,但无显著性差异。类胡萝卜素含量在30 d时各胁迫处理组比CK处理有所上升,但差异不显著;在60 d时,DT处理比CK处理升高了19.2%,EO+DT处理比CK组下降了13.5%,其中,EO+DT处理较DT处理显著降低了27.5%(P<0.05)。
在30 d时,与对照相比,紫丁香可溶性蛋白含量在DT处理下显著升高了39.4%(P<0.05),在EO、EO+DT处理下与CK处理相比呈下降趋势,但无显著差异;在60 d时,EO、DT、EO+DT处理的可溶性蛋白含量分别比CK处理显著下降了15.7%、8.8%、13.1%(P<0.05),其中EO处理比DT处理显著降低了7.6%(P<0.05),EO+DT处理下的可溶性蛋白含量介于EO、DT单因子处理之间。
在30 d时,紫丁香SOD活性在EO、DT、EO+DT处理下较CK组有所升高,但差异不显著;在60 d时,DT处理较CK组上升了22.8%,较EO处理显著上升了99.6%(P<0.05),EO+DT处理与CK组接近,介于二者的单因子处理之间。
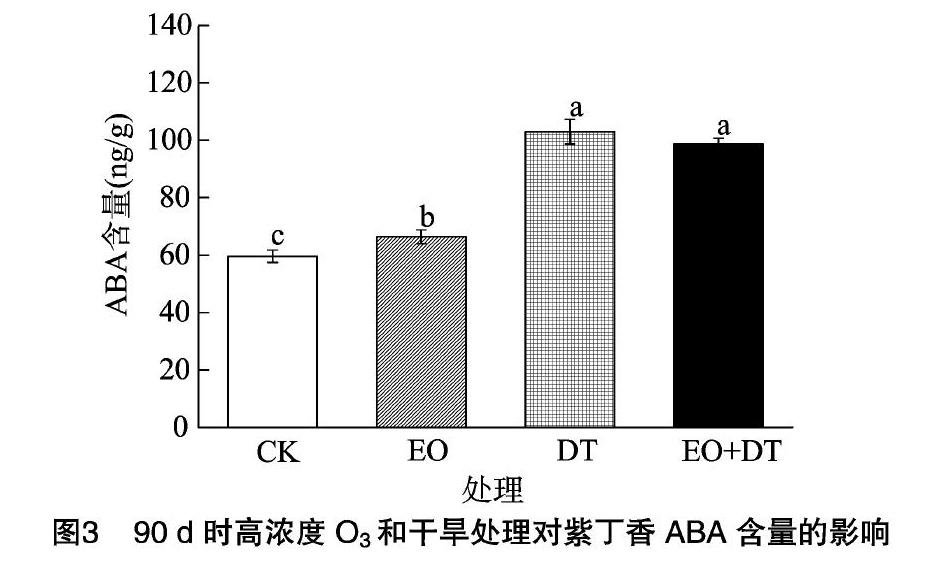
2.3 对紫丁香ABA含量的影响
由图3可知,紫丁香ABA含量在EO、DT单因子处理后均显著升高,较CK处理分别升高了6.0%和38.9%。EO+
DT处理对ABA含量产生显著交互作用,使得紫丁香ABA含量比CK处理显著升高了35.1%(P<0.05),略低于DT处理,显著高于EO处理。
3 讨论
光合作用是植物生长发育中最基本、重要的生理过程。研究表明,O3和干旱会显著降低植物净光合速率。付伟等发现,白桦和银中杨在用浓度为160 nmol/mol O3熏蒸后,2种树叶片的净光合速率分别显著下降了52.8%和24.3%[25];王海珍等发现,胡杨叶片净光合速率在干旱处理下下降,并且随着干旱程度加剧和处理时间增长,下降幅度变大[26]。一般来说,植物光合效率下降通常分为气孔限制因素和非气孔限制因素[27]。气孔限制是由于植物气孔导度和胞间CO2浓度降低,碳吸收量的不足导致植物净光合速率下降[28]。非气孔限制是由于植物的光合系统结构被破坏导致净光合速率下降[29]。本试验中,30 d时净光合速率在O3处理下有所下降,而蒸腾速率和气孔导度变化不明显,非气孔限制因素抑制了紫丁香的光合作用;而在复合处理下,干旱通过调控气孔闭合,减少了O3吸收剂量,缓解了O3对紫丁香的伤害[30]。在O3、干旱和复合处理60 d时,紫丁香净光合速率、氣孔导度显著下降,与Alonso等的研究结论[17]一致,CO2吸收量减少、气孔限制是紫丁香净光合速率下降的主要原因。
光合色素具有吸收和传递光能的作用,干旱和干旱胁迫都会导致光合色素合成速度降低、分解速度加快[31-32]。但本试验中,O3和干旱单因子处理下叶绿素含量没有显著下降。李芳兰等研究表明,干旱条件下,叶片含水量降低,单位质量叶绿素含量增加,缓解了干旱对叶绿素的降解作用[33]。而O3处理下叶绿素含量变化不明显,可能是因为紫丁香本身具有较强的抗氧化系统,能够保护叶绿体结构不被破坏[34]。而
复合处理产生交互作用,使得叶绿素含量低于单因子处理,有可能是由于复合胁迫压力大于植物体自身的调节能力上限。此外,类胡萝卜素含量在各组处理下无太大变化,因为类胡萝卜素除了传递光合能量外,还能保护受光激发的叶绿体免受氧化作用,对逆境有一定的抵抗能力[35]。
可溶性蛋白是具有亲水性的胶体,它是植物重要的渗透调节物质,能影响植物细胞的保水力;可溶性蛋白大多是参与代谢循环的酶类,因此,植物的生理生化状态可通过叶片可溶蛋白含量的高低得到反映。王晶英等发现,银中杨可溶性蛋白含量在干旱胁迫下显著下降[36];张越等发现,山杜英幼苗可溶性蛋白含量随着O3浓度升高逐步下降,在160 nmol/mol时显著降低37.21%[37]。本试验结果表明,干旱和O3都在一定程度上降低了可溶性蛋白含量。而在60 d时,复合处理下的可溶性蛋白含量介于O3和干旱单因子处理中间,说明干旱和O3有拮抗作用,干旱处理有效缓解了O3对蛋白质的降解作用。
植物在进行光合作用的过程中,叶绿体产生的氧气通过接受光系统的电子形成活性氧(ROS),在稳态条件下,ROS被各种抗氧化防御机制清除。而O3进入植物体内会直接转化为ROS[38],而干旱使得ROS代谢平衡紊乱,从而破坏植物抗氧化系统,致使植物对活性氧的清除能力下降,产生破坏作用[39]。Xu等研究发现,金银忍冬在O3和干旱单因子处理下SOD活性显著提高,复合处理下显著高于单因子处理,SOD在复合胁迫下表现出更高的抗氧化水平[40]。在本试验中,紫丁香叶片SOD活性在O3处理下随着时间先升后降,在干旱处理下上升,说明紫丁香SOD在干旱条件下能维持较高活性,但对于O3的忍耐性较差。干旱处理能够提高O3处理下紫丁香叶片的SOD活性,缓解O3对植物的氧化伤害。
脱落酸是重要的植物内源激素,不仅能够控制植物生长、抑制种子发育和促进衰老等,而且在植物逆境时发挥重要作用[41]。有研究表明,干旱胁迫和O3会使植物体ROS水平上升,促进ABA的产生,驱动植物气孔关闭[42-43],从而起到保护植物的作用。本试验中,O3和干旱处理下紫丁香ABA含量都显著上升,ABA与保卫细胞受体结合,保卫细胞的K+、Ca2+等外流通道被激活,内流通道被抑制,保卫细胞膨胀程度降低,导致气孔关闭,减少了植物体的O3吸收剂量和水分蒸散[44]。而在复合处理下,干旱显著提高了O3处理下的紫丁香ABA含量,研究结果与李丽等对于元宝枫早生叶和晚生叶的结论[45]一致,说明干旱通过提高ABA含量,调控气孔闭合,减少了O3对植物的氧化伤害[46]。但是,也有研究发现,O3处理下日本水青冈的乙烯合成量会增加,降低了ABA调控气孔闭合的能力,气孔关闭滞后,加深了干旱对植物水分蒸散的伤害[47]。O3和干旱交互作用对于植物ABA含量的变化情况较为复杂,这主要取决于O3和干旱发生的先后顺序、强度以及植物敏感性等[48]。
4 结论
干旱和O3处理均对紫丁香产生了伤害,使净光合速率、气孔导度和蒸腾速率下降,光合作用受抑制的主要原因是气孔限制因素。
O3和干旱处理下紫丁香可溶性蛋白含量减少,脱落酸含量增加,SOD活性上升,复合处理有明显的拮抗作用,干旱通过脱落酸诱导气孔关闭从而缓解了O3对紫丁香的伤害。
复合胁迫对于紫丁香光合色素含量具有协同作用,60 d时复合胁迫降低了叶绿素、类胡萝卜素含量,但与对照间差异不显著。
参考文献:
[1]Feng Z Z,Sun J S,Wan W X,et al. Evidence of widespread ozone-induced visible injury on plants in Beijing,China[J]. Environmental Pollution,2014,193(1):296-301.
[2]Agathokleous E,Mouzaki-Paxinou A C,Saitanis C J,et al. The first toxicological study of the antiozonant and research tool ethylene diurea (EDU) using a Lemna minor L. bioassay:hints to its mode of action[J]. Environmental Pollution,2016,213:996-1006.
[3]刘 闽,王 闯,侯 乐,等. 沈阳臭氧污染时空分布特征及变化趋势[J]. 中国环境监测,2017,33(4):126-131.
[4]Sherwood S,Fu Q. A drier future?[J]. Science,2014,343(6172):737-739.
[5]顾 颖,刘静楠,林 锦. 近60年来我国干旱灾害特点和情势分析[J]. 水利水电技术,2010,41(1):71-74.
[6]Ainsworth E A. Rice production in a changing climate:a meta-analysis of responses to elevated carbon dioxide and elevated ozone concentration[J]. Global Change Biology,2008,14(7):1642-1650.
[7]付 伟,邓莉兰,徐 胜,等. 臭氧对黄檗幼苗叶片可见伤害及气孔特征的影响[J]. 东北林业大学学报,2015,43(2):14-18.
[8]Li P,Calatayud V,Gao F,et al. Differences in ozone sensitivity among woody species are related to leaf morphology and antioxidant levels[J]. Tree Physiology,2016,36(9):1105-1116.
[9]Xu S,Chen W,Huang Y,et al. Responses of growth,photosynthesis and VOC emissions of pinus tabulaeformis Carr. exposure to elevated CO2 and/or elevated O3 in an urban area[J]. Bulletin of Environmental Contamination & Toxicology,2012,88(3):443-448.
[10]Shang B,Feng Z Z,Li P,et al. Ozone exposure- and flux-based response relationships with photosynthesis,leaf morphology and biomass in two poplar clones[J]. Science of the Total Environment,2017,603/604:185-195.
[11]裴 斌,張光灿,张淑勇,等. 土壤干旱胁迫对沙棘叶片光合作用和抗氧化酶活性的影响[J]. 生态学报,2013,33(5):1386-1396.
[12]蒋明义,郭绍川. 水分亏缺诱导的氧化胁迫和植物的抗氧化作用[J]. 植物生理学通讯,1996,32(2):144-150.
[13]Wilkinson S,Davies W J. Ozone suppresses soil drying- and abscisic acid (ABA)-induced stomatal closure via an ethylene-dependent mechanism[J]. Plant Cell and Environment,2009,32(8):949-959.
[14]Pollastrini M,Desotgiu R,Camin F A,et al. Severe drought events increase the sensitivity to ozone on poplar clones[J]. Environmental and Experimental Botany,2014,100(2):94-104.
[15]Wilkinson S,Davies W J. Drought,ozone,ABA and ethylene:new insights from cell to plant to community[J]. Plant Cell and Environment,2010,33(4):510-525.
[16]Panek J A,Kurpius M R,Goldstein A H. An evaluation of ozone exposure metrics for a seasonally drought-stressed ponderosa pine ecosystem[J]. Environmental Pollution,2002,117(1):93-100.
[17]Alonso R,Elvira S,González-Fernández I,et al. Drought stress does not protect Quercus ilex L. from ozone effects:results from a comparative study of two subspecies differing in ozone sensitivity[J]. Plant Biology,2014,16(2):375-384.
[18]冯汉青,李翡翡,贾凌云,等. 盐胁迫对杨树和紫丁香叶片叶绿素荧光特性的影响[J]. 西北农林科技大学学报(自然科学版),2013,41(7):157-161,171.
[19]许小妍. 淹水胁迫对紫丁香和暴马丁香酶活性及同工酶谱的影响[D]. 哈尔滨:东北林业大学,2013.
[20]马艳丽,王 鹏. 低温胁迫对2种丁香属植物抗寒生理指标的影响[J]. 河北农业大学学报,2013,36(2):54-59.
[21]赵晓丽,于 艳,孙文静,等. SO2胁迫对紫丁香和连翘叶片生理生化指标的影响[J]. 甘肃农业大学学报,2008,43(6):81-85,93.
[22]李合生. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社,2000.
[23]高俊凤. 植物生理学实验指导[M]. 北京:高等教育出版社,2006.
[24]Bradford M. A rapid method for the quantification of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry,1976,72(1/2):248-254.
[25]付 伟,高江艳,徐 胜,等. 高浓度臭氧对城市白桦和银中杨光合作用的影响[J]. 生态学杂志,2014,33(12):3184-3190.
[26]王海珍,韩 路,徐雅丽,等. 干旱胁迫下胡杨光合光响应过程模拟与模型比较[J]. 生态学报,2017,37(7):2315-2324.
[27]许大全.光合作用气孔限制分析中的一些问题[J]. 植物生理学通讯,1997,33(4):241-244.
[28]Xu S,He X Y,Chen W,et al. Differential sensitivity of four urban tree species to elevated O3[J]. Urban Forestry & Urban Greening,2015,14(4):1166-1173.
[29]Feng Z Z,Kobayashi K,Ainsworth E A. Impact of elevated ozone concentration on growth,physiology,and yield of wheat (Triticum aestivum L.):a meta-analysis[J]. Global Change Biology,2008,14(11):2696-2708.
[30]郝云亭,林 敏,薛 立,等. 臭氧与干旱胁迫对海南蒲桃和盆架子幼苗光合生理的影响[J]. 安徽农业大学学报,2014,41(2):193-197.
[31]尹智宇,肖关丽. 干旱胁迫对冬马铃薯苗期生理指标及光合特性的影响[J]. 云南农业大学学报(自然科学版),2017,32(6):992-998.
[32]Bohler S,Sergeant K,Jolivet Y,et al. A physiological and proteomic study of poplar leaves during ozone exposure combined with mild drought[J]. Proteomics,2013,13(10/11):1737-1754.
[33]李芳兰,包维楷,吴 宁. 白刺花幼苗对不同强度干旱胁迫的形态与生理响应[J]. 生态学报,2009,29(10):5406-5416.
[34]郭雄飞,许炼烽,路光超,等. 地表臭氧增加對4种植物光合作用的影响[J]. 环境科学与技术,2014(12):6-10.
[35]秦天才,阮 捷,王腊娇. 镉对植物光合作用的影响[J]. 环境科学与技术,2000(增刊1):33-35,44.
[36]王晶英,赵雨森,王 臻,等. 干旱胁迫对银中杨生理生化特性的影响[J]. 水土保持学报,2006,20(1):197-200.
[37]张 越,董喜光,薛 立,等. 臭氧胁迫对山杜英幼苗生理的影响[J]. 中南林业科技大学学报,2015,35(9):97-103.
[38]Biswas D K,Jiang G M. Differential drought-induced modulation of ozone tolerance in winter wheat species[J]. Journal of Experimental Botany,2011,62(12):4153-4162.
[39]Ernst D,Jürgensen M,Bahnweg G,et al. Common links of molecular biology with biochemistry and physiology in plants under ozone and pathogen attack[M]. Berlin:Springer,2012.
[40]Xu S,Fu W,He X Y,et al. Drought alleviated the negative effects of elevated O3 on Lonicera maackii in urban area[J]. Bulletin of Environmental Contamination & Toxicology,2017(2):1-6.
[41]郝格格,孫忠富,张录强,等. 脱落酸在植物逆境胁迫研究中的进展[J]. 中国农学通报,2009,25(18):212-215.
[42]吴丽君,李志辉. 不同种源赤皮青冈幼苗生长和生理特性对干旱胁迫的响应[J]. 生态学杂志,2014,33(4):996-1003.
[43]Mcadam E L,Brodribb T J,Mcadam S A. Does ozone increase ABA levels by non-enzymatic synthesis causing stomata to close?[J]. Plant Cell and Environment,2017,40(5):741-747.
[44]Desikan R,Cheung M K,Bright J,et al. ABA,Hydrogen peroxide and nitric oxide signaling in stomatal guard cells[J]. Journal of Experimental Botany,2004,55(395):205-212.
[45]李 丽,牛俊峰,文 志,等. 干旱和臭氧浓度升高对元宝枫早生和晚生叶片色素和脱落酸含量的影响[J]. 生态学报,2016,36(21):6804-6811.
[46]Paoletti E,Grulke N E. Ozone exposure and stomatal sluggishness in different plant physiognomic classes[J]. Environmental Pollution,2010,158(8):2664-2671.
[47]Hoshika Y,Watanabe M,Inada N,et al. Ozone-induced stomatal sluggishness develops progressively in Siebolds beech (Fagus crenata)[J]. Environmental Pollution,2012,166:152-156.
[48]高 峰,李 品,冯兆忠. 臭氧与干旱对植物复合影响的研究进展[J]. 植物生态学报,2017,41(2):252-268.
