类乌齐牦牛ACTA1基因克隆、分子特性及差异表达分析
2019-07-18柴志欣王吉坤信金伟姬秋梅张成福钟金城罗晓林
杨 勤,柴志欣,王 会,王吉坤,信金伟,姬秋梅,张成福,钟金城*,罗晓林
(1.西南民族大学 青藏高原动物遗传资源保护与利用教育部重点实验室,四川 成都 610041;2.西藏自治区农牧科学院省部共建青稞和牦牛种质资源与遗传改良国家重点实验室,西藏 拉萨 850009;3.四川省草原科学研究院,四川 成都 611731)
【研究意义】随着社会发展和人民生活水平的提高,人们的膳食结构也在不断发生变化,绿色食品日渐成为消费热点。其中牛肉营养丰富,含有人体所需的必需氨基酸,且具有高蛋白、低脂肪、低胆固醇等特点,成为消费者日常生活主要的肉质来源之一;同时,人们对“优质牛肉”、“高档牛肉”的需求越来越高。牦牛是分布于青藏高原及其毗邻的高山、亚高山地区的主要畜种,因主产区特有的生态环境和地理位置形成了许多地方品种或类群。类乌齐牦牛主要分布于西藏自治区东部昌都市类乌齐县境内海拔4500 m以上的草甸草原地区,因气候宜人,水草丰茂,俗称西藏“小瑞士”,并以其肥膘体壮、肉质鲜嫩、口感好、遗传多样性丰富等特点,于2017年通过国家农业资源委员会审定,成为国家优良牦牛遗传资源[1]。且因其形成历史悠久,经长期自群繁育,具有基本一致的外貌特征、繁殖性能和生产性能,在遗传上是一个宝贵的基因库,可作为培育牦牛新品种或品系的重要遗传资源[2]。肌动蛋白(Actin)是真核细胞中含量最丰富的蛋白质之一,主要分布于细胞质,参与肌小节和细胞骨架主要成分—微丝的组成,细胞骨架之所以能够形成稳定结构及动态结构,是由于微丝特别是肌动蛋白微丝和微管的共同作用。微丝可与肌球蛋白相互作用产生滑动效应,是细胞运动及肌肉收缩的生理基础。肌动蛋白除参与肌球蛋白介导的肌肉收缩运动外还参与细胞黏附、信号转导、离子通道调控等相关调控机制[3]。α肌动蛋白1(actin alpha 1, ACTA1)是肌动蛋白的一类异构形式,以收缩蛋白在骨骼肌的活动中发挥重要作用,是骨骼肌中一种收缩装置的主要组成部分,并广泛参与肌细丝组装、骨骼肌纤维发育以及细胞和细胞器的运动[4]。研究表明,ACTA1基因突变会导致多种肌肉疾病发生,如人类骨骼肌先天性肌病、横纹肌疾病、杆状体肌病与盖肌病等[5-9]。【前人研究进展】近年来,国内外许多研究已对畜禽ACTA1基因进行了研究报道。Sewry等[10]研究发现,ACTA1基因突变与斑马的肌无力相关。Venturini等[11]研究显示,ACTA1基因多态性与肉鸡的生产性能及胴体性状显著相关。Lee等[12]研究表明,12月龄韩牛背最长肌中ACTA1基因表达水平显著高于27月龄韩牛,ACTA1基因可能是调控韩牛肉质性状的重要的基因。Shin等[13]研究发现ACTA1基因在韩牛低等级大理石花纹牛肉中表达量显著高于高等级大理石花纹个体,ACTA1基因可能是影响肉质性状的重要基因。田万年等[14-15]研究报道,延边黄牛ACTA1基因与体长、体重、平均日增重和胸围上显著相关。张斌等[16]研究发现,槟榔江水牛ACTA1基因存在2个SNPs多态位点,多态类型与其体重、管围等性状存在关联。以上研究表明,ACTA1基因是影响畜禽肉质及生长性状的主要候选基因,但有关牦牛ACTA1基因生物学功能及其表达规律的研究尚未见报道。【本研究切入点】本研究以类乌齐牦牛臀肌为试验材料,通过RT-PCR方法获得牦牛ACTA1基因全长cDNA序列并进行生物信息学分析;同时运用RT-qPCR法检测牦牛ACTA1基因在不同组织中mRNA水平的表达规律。【拟解决的关键问题】为进一步研究该基因对牦牛肌肉发育的调控作用及其与肉质性状的相关性等奠定理论依据。
1 材料与方法
1.1 样品采集
于西藏类乌齐县选取3头4.5岁健康西藏类乌齐牦牛,采集心脏、臀肌、臀脂、脾脏、大脑、肺脏、肝脏和乳腺8种组织,DEPC水清洗干净,锡箔纸包装好迅速置于液氮中保存备用。
1.2 主要试剂
Trizol RNA提取试剂盒(Thermo);琼脂糖(Amresco);RNase-Free ddH2O;DNA纯化试剂盒(TIANGEN);反转录试剂盒(Takara);DL2000 DNA Ladder(Takara);pMD19-T载体(TaKaRa);DH5α感受态细胞(TIANGEN)等。
1.3 总RNA的提取及cDNA的合成
称取80~110 mg组织样品于研钵中,边研磨边倒液氮,将研磨好的组织迅速转移到含Trizol裂解液的离心管,提取总RNA。采用分光光度计测定RNA样品的浓度及OD260nm/280nm值,并通过琼脂糖凝胶电泳检验RNA质量,置于-80 ℃保存备用。用反转录试剂盒PrimerScript®1stStrand cDNA Synthesis kit将提取的总RNA反转录为cDNA。
1.4 引物设计与合成
根据GenBank公布的普通牛ACTA1基因mRNA参考序列(XM_005226192)设计1对引物(表1)。

表1 ACTA1-PCR引物Table 1 ACTA1-PCR primer
同时根据克隆得到类乌齐牦牛ACTA1基因cDNA序列设计实时荧光定量qPCR引物,选用β-actin作为内参基因。引物均由Thermo公司合成。
1.5 类乌齐牦牛ACTA1基因TA克隆与鉴定
以类乌齐牦牛臀肌组织cDNA为模板,以ACTA1-PCR 引物扩增牦牛ACTA1基因CDS区。体系(25 μl):TaqGreen PCR Master Mix(2×, 1.25 mL)12.5 μl;上下游引物F/R各1 μl;cDNA 1μl,ddH2O 9.5 μl。PCR反应程序:94 ℃预变性5 min;94 ℃变性30 s,57.2 ℃退火30 s,72 ℃延伸1 min,32个循环;72 ℃终延伸5 min;4 ℃保存。PCR产物经1 %琼脂糖凝胶电泳检测,利用DNA纯化试剂盒回收PCR产物,4 ℃保存备用。
将回收纯化后的PCR产物与载体pMD19-T 16 ℃过夜连接,将连接载体转化至DH5α感受态细胞,经复苏后,均匀涂布在制备好的Amp+-LB固体培养基平板上,37 ℃恒温过夜培养10~12 h,挑取白色大小合适的单菌落,筛选阳性质粒DNA送生工生物工程(上海)股份有限公司双向测序。
1.6 qPCR分析
将3头类乌齐牦牛的心脏、臀肌、臀脂、脾脏、大脑、肺脏、肝脏和乳腺共24种组织的RNA稀释成100 ng·μl-1,分别取5 μl RNA 进行反转录反应,得到的cDNA 产物采用实时荧光定量 PCR(RT-qPCR) 检测ACTA1基因和β-actin基因的表达。反应体系(10 μl) : SYBR premix Dimer Eraser(2×)5 μl,ddH2O 3.2 μl,的上下游引物(10 μmol·L-1)各 0.4 μl,cDNA 1 μl。qPCR 反应条件:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,39个循环。
1.7 生物信息学分析
对类乌齐牦牛ACTA1基因CDS区进行序列分析和蛋白结构、功能预测:利用NCBI-BLAST对所测序列进行比对校正;ORF finder程序分析ACTA1基因开放阅读框并获得氨基酸序列;利用DNAStar进行物种间序列的同源性分析;利用MEGA7.0软件构建系统进化树;利用在线工具Protparam(https://web.expasy.org/protparam/)和Protscale(https://web.expasy.org/protscale/)分别分析ACTA1氨基酸的理化性质和亲水性;利用在线软件预测Netphos(http://www.cbs.dtu.dk/services/NetPhos/)ACTA1蛋白潜在磷酸化位点;利用在线软件NetOGlyc(http://www.cbs.dtu.dk/services/NetOGlyc)和NetNGlyc(http://www.cbs.dtu.dk/services/NetNGlyc/)进行潜在O、N糖基化位点预测;利用在线软件TMHMM(http://www.cbs.dtu.dk/services/TMHMM/)预测ACTA1蛋白跨膜结构域和跨膜方向;利用在线软件Sopma(https://npsa-prabi.ibcp.fr/cgibin/secpred sopma.pl)预测ACTA1蛋白二级结构;利用NCBI工具Conserved Domain Search Service (CD Search)预测ACTA1蛋白保守结构域;利用在线软件SWISSMODEL(https://www.swissmodel.expasy.org/)预测ACTA1蛋白质三级结构。
1.8 qPCR数据搜集与分析
RT-qPCR结果采用 2-△△CT法分别计算每个样品ACTA1和 β-actin基因表达量相对值,用软件GraphPad Prism 5绘制ACTA1在不同组织中 mRNA 表达量的柱状图,采用SPSS22.0软件分析各组织间差异显著性。
2 结果与分析
2.1 类乌齐牦牛ACTA1基因RT-PCR
由图1所示,以类乌齐牦牛臀肌总RNA为模板,反转录获得cDNA,PCR扩增序列长1239 bp与目的片段大小一致。
2.2 ACTA1基因的序列分析
如图2可知,经ORF finder分析显示类乌齐牦牛ACTA1基因CDS区全长1134 bp,起始密码子为ATG,终止密码子为TAG,共编码377个氨基酸。

图1 ACTA1基因PCR扩增Fig.1 PCR amplification products of ACTA1 gene
2.3 同源性及进化树分析
从NCBI数据库搜集12个物种ACTA1基因编码区mRNA序列和对应氨基酸序列,利用MegAlign软件对类乌齐牦牛、黄牛、水牛等13个物种ACTA1基因编码区核苷酸序列及氨基酸序列进行比对,结果表明ACTA1基因编码区序列在哺乳动物间高度保守(表2)。利用NJ法构建系统进化树,结果显示,类乌齐牦牛与水牛、黄牛、绵羊及山羊遗传距离较近,而与热带爪蟾较远(图3)。
2.4 氨基酸序列理化特性预测与分析
运用ExPASy中 ProtParam程序对ACTA1蛋白氨基酸序列的理化性质进行预测,ACTA1蛋白分子式为C1860H2917N495O568S23,理论分子质量为42.03 ku,理论等电点(PI)为5.23,为酸性蛋白,共有50个负电荷氨基酸残基(Asp + Glu)和37个正电荷氨基酸残基(Arg + Lys)。ACTA1蛋白含有20种标准氨基酸,由氨基酸组成可知(表3),Ala(A)和Ile(I)分别占比7.7 %,含量最多,Trp(W)含量最低,仅占1.1%。ACTA1蛋白的不稳定系数为36.14,低于阈值40,属稳定蛋白。估测其在体外哺乳动物网织红细胞内的半衰期为30 h,脂肪系数为80.74,总平均亲水系数为(GRAVY)为-0.246,为亲水性蛋白。
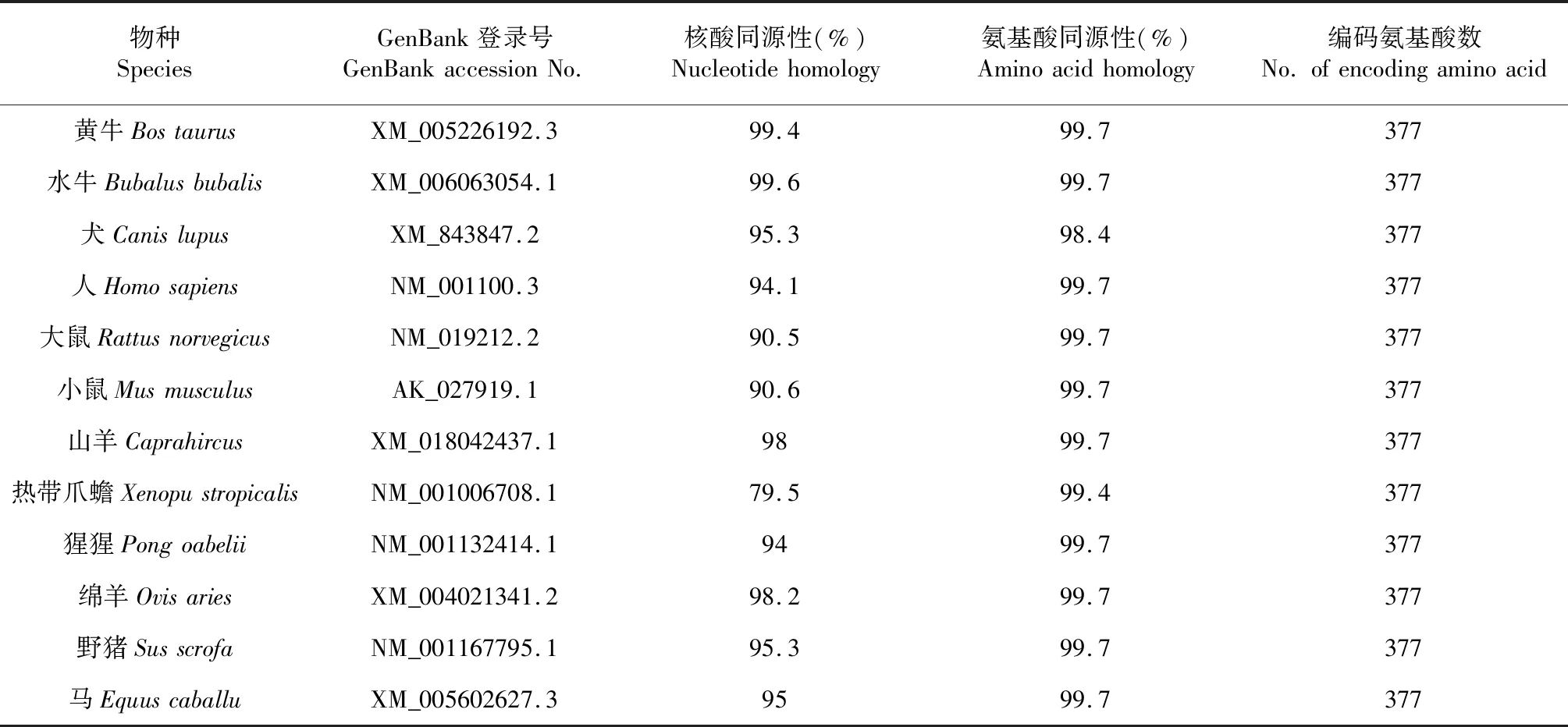
表2 类乌齐牦牛与其他物种ACTA1基因编码区同源性比较Table 2 Homology comparison of ACTA1 gene CDS between Leiwuqi yak and other species
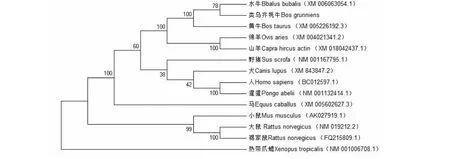
图3 类乌齐牦牛与其他物种的ACTA1基因系统进化树分析Fig.3 Phylogenetic relationship of ACTA1 genes based on Leiwuqi yak and other species
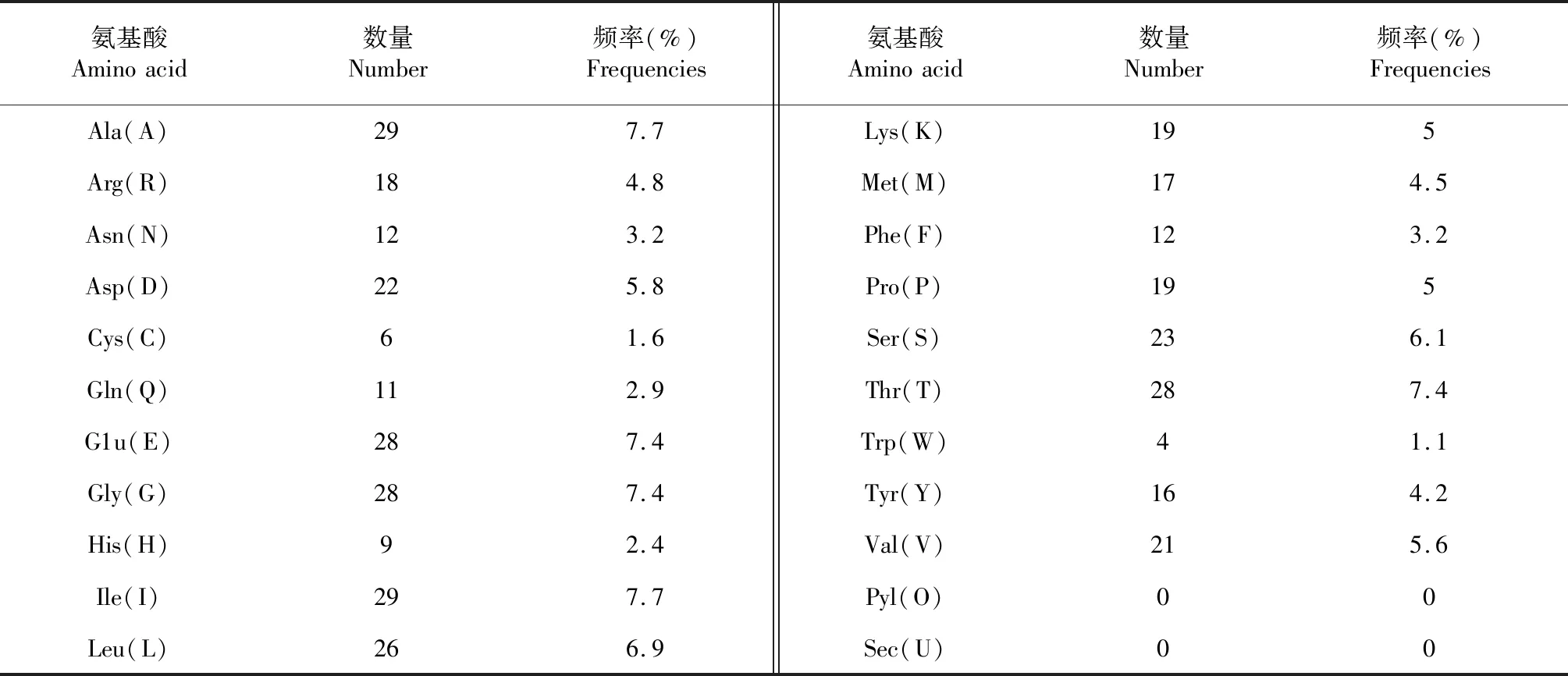
表3 类乌齐牦牛ACTA1基因编码蛋白氨基酸组成Table 3 Composition of amino acid coded by Leiwuqi yak ACTA1 gene
2.5 ACTA1蛋白亲疏水性预测与分析
根据蛋白质亲水性/疏水性分析原理,利用ExPASy在线工具ProtScale程序对ACTA1基因编码产物进行亲/疏水性分析。由图4可知,纵坐标0值以上为疏水区,其分值越高,疏水性越强;0值以下为亲水区。整个多肽链包含2个较明显疏水区和2个较明显亲水区,第1疏水区为第137~142位氨基酸,第2疏水区为第344~347位氨基酸;第1亲水区为第115~119位氨基酸,第2亲水区为362~366位氨基酸。该氨基酸多肽链的第140位Ala(A)分值最高(2.200),疏水性最强;第117位Asn(N)分值最低(-2.300),亲水性最强。分析数据显示,该氨基酸序列内超过半数为亲水性残基,整条多肽链表现为亲水性。
2.6 ACTA1蛋白结构功能预测与分析
2.6.1 ACTA1蛋白结构预测与分析 使用在线软件SOPMA预测类乌齐牦牛ACTA1的蛋白质二级结构,发现该蛋白由无规则卷曲(Random coil)、α-螺旋(Alpha helix)和β-转角(Beta turn)以及延伸链(Extended strand)构成(表4),为其三级结构预测提供参考。利用SWISS-MODEL在线软件基于PDB数据库对类乌齐牦牛ACTA1蛋白进行同源建模,获得ACTA1蛋白三级结构模型(图5)。由三级结构可知,α-螺旋占主导地位,与二级结构预测结果一致。
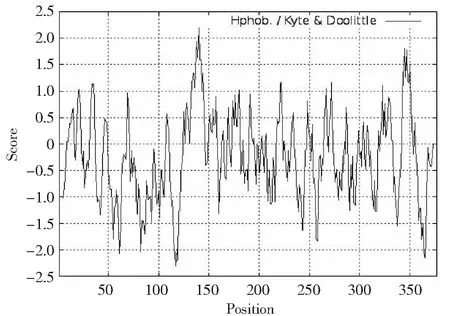
正值表示疏水,负值表示亲水窗口大小为n=9Positive value indicates hydrophobicity, negative value indicates hydrophilicity; The window size is n=9图4 类乌齐牦牛ACTA1基因编码蛋白疏水性预测Fig.4 Hydrophobicity prediction of Leiwuqi yak ACTA1 gene encoding protein

表4 类乌齐牦牛ACTA1基因编码蛋白二级结构预测Table 4 Secondary structure prediction of Leiwuqi yak ACTA1 gene encoding protein
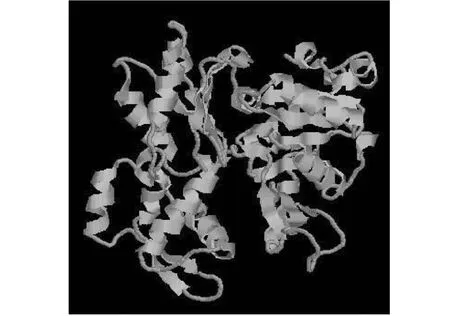
图5 类乌齐牦牛ACTA1基因编码蛋白三级结构预测Fig.5 Tertiary structure prediction of Leiwuqi yak ACTA1 gene encoding protein

图6 类乌齐牦牛ACTA1基因编码蛋白跨膜结构域分析Fig.6 Analysis of transmembrane domain of Leiwuqi yak ACTA1 gene encoding protein
2.6.2 跨膜区结构预测与分析 利用软件TMHMM2.0软件预测ACTA1蛋白跨膜结构域。由图6可知,该蛋白含有2个跨膜螺旋结构,即为二次跨膜蛋白,在第131~148、339~357位氨基酸处分别存在1个跨膜螺旋,该蛋白所有氨基酸均为胞内区,属胞内蛋白,这是因为肌动蛋白主要存在于肌肉细胞细胞质内,与肌球蛋白结合参与肌小节收缩。
2.6.3 信号肽预测与分析 如图7所示,在线工具SignalP4.1Server预测ACTA1蛋白信号肽,表明ACTA1蛋白无信号肽序列,说明该蛋白为非分泌型蛋白,进一步说明该蛋白为胞内蛋白,主要在骨骼肌细胞内发挥作用。
2.6.4 保守结构域预测与分析 利用NCBI工具Conserved Domain Search Service (CD Search)预测ACTA1蛋白保守结构域。如图8所示,ACTIN蛋白家族为糖激酶/HSP70/肌动蛋白超家族成员之一,其中ACTA1蛋白多肽链第7~377位氨基酸为肌动蛋白保守结构域,第10~183位为肌动蛋白NBD(Nucleotide binding site)区域,肌动蛋白在生物进化过程中高度保守。
2.6.5 磷酸化位点预测与分析 利用NetPhos3.1 Server预测潜在磷酸化位点,由图9可知,阈值为0.5时,ACTA1蛋白存在38个潜在的磷酸化位点,其中包括16处丝氨酸(Serine)磷酸化位点、13处苏氨酸(Thronine)磷酸化位点和9处酪氨酸(Tyrosine)磷酸化位点。
图7 类乌齐牦牛ACTA1基因编码蛋白信号肽预测Fig.7 Signal peptide prediction of Leiwuqi yak ACTA1 gene encoding protein

图8 类乌齐牦牛ACTA1基因编码蛋白保守位点预测Fig.8 Conserved sites prediction of Leiwuqi yak ACTA1 gene encoding protein
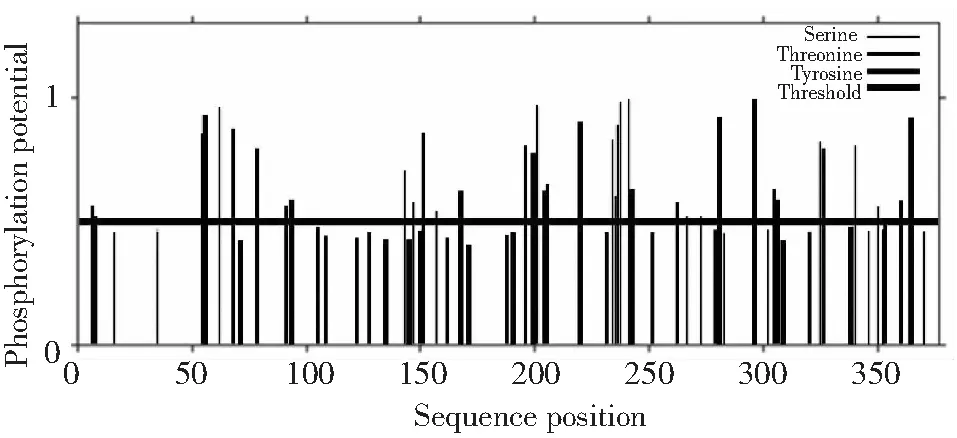
图9 类乌齐牦牛ACTA1基因编码蛋白磷酸化位点预测Fig.9 Phosphorylation sites prediction of Leiwuqi yak ACTA1 gene encoding protein
2.6.6 O/N-糖基化位点预测与分析 利用软件NetOGlyc4.0 Server和NetNGlyc1.0 Server进行潜在O、N糖基化位点预测。分析结果显示,ACTA1蛋白仅存在1处潜在O-糖基化修饰位点,其概率为0.50365;而在第14位对应天冬酰胺残基的酰胺氮原子存在1处潜在N-糖基化修饰位点,其概率为0.6867(图10)。
2.7 类乌齐牦牛ACTA1 mRNA组织表达
实时荧光定量PCR结果显示,ACTA1基因在检测的3头类乌齐牦牛臀肌、大脑、心脏等8种组织中均有表达;利用Spass 22.0进行单因素方差分析,P<0.05为差异显著,P<0.01为差异极显著,结果发现ACTA1mRNA在臀肌中表达水平极显著高于大脑和心脏(P<0.01),大脑和心脏ACTA1mRNA表达差异不显著(P>0.05),而在肝脏及臀脂中表达量极低(图11)。
3 讨 论
目前,对人类ACTA1基因的研究主要集中于疾病方面,如基因突变与人骨骼先天性疾病、横纹肌疾病相关性等,而畜禽方面则主要分析ACTA1基因突变与肌无力、肉质性状及生长性状相关性等方面。本试验成功克隆类乌齐牦牛ACTA1基因CDS区,并通过生物信息学分析详细阐释ACTA1蛋白理化性质、结构功能。类乌齐牦牛ACTA1基因CDS区全长1134 bp,共编码377个氨基酸。

图10 类乌齐牦牛ACTA1基因编码蛋白N-糖基化位点分析Fig.10 N-glycosylation site analysis of Leiwuqi yak ACTA1 gene encoding protein

**表示差异极显著(P<0.01)**mean significant difference at 0.01 level图11 类乌齐牦牛ACTA1基因在不同组织中的表达量(内参基因: β-actin; n= 3)Fig.11 Expression of Leiwuqi yak ACTA1 gene in various tissues
类乌齐牦牛肉质鲜美,口味独特,可能与肉中氨基酸含量显著相关,罗毅皓等[16]研究报道,鲜味氨基酸天门冬氨酸(Asp)和谷氨酸(Glu)决定了牦牛肉鲜味优于黄牛肉,而本研究显示ACTA1蛋白天门冬氨酸与谷氨酸含量分别高达5.8 %、7.4 %,谷氨酸含量越高,肉品质越好,且易消化吸收,属于优质牛肉。胶原是人体结缔组织的主要组成,肉质中精氨酸(Arg)和丙氨酸(Ala)含量高有利于人体胶原的合成,特别是对儿童生长发育有重要促进作用,本研究发现类乌齐牦牛肉中精氨酸和丙氨酸含量分别高达5.8 %、7.7 %,有利于胶原的合成,老人、儿童皆宜食用。另亲水性/疏水性分析显示,类乌齐牦牛ACTA1蛋白多肽链所含疏水性氨基酸多于亲水性氨基酸,但多肽链经过二、三级结构在空间上的盘绕、折叠后,表现为较强亲水性,易与水分子结合,同时其总平均亲水系数(GRAVY)预测也表明该蛋白属亲水性蛋白,因此,ACTA1蛋白在其执行功能上表现为亲水性蛋白。跨膜区预测显示,ACTA1蛋白所有氨基酸均为胞内区,存在两个较明显的跨膜螺旋区域;类乌齐牦牛ACTA1蛋白无信号肽,属非分泌蛋白,表明该蛋白是由细胞质内游离的核糖体合成,不经过内质网、高尔基体的加工和细胞膜的胞吐,只在细胞内产生影响,为胞内蛋白[17],而胞内蛋白一般为亲水性蛋白[18],这与预测结果一致。且ACTA1蛋白在肌肉收缩及兴奋偶联过程中,促进肌动蛋白微丝与横桥间的相互作用,产生收缩,推测该蛋白跨膜螺旋区域可能与肌动蛋白微丝与横桥间存在信号转导有关[20]。ACTA1蛋白二级和三级结构显示,多肽链在空间上的螺旋、折叠均以α-螺旋占主导,有助于肌纤维肥大,从而有助于动物躯体肌肉块增大增粗[21]。
序列同源性和系统进化树分析在一定程度上反应出物种间的亲缘关系[22]。本研究发现,类乌齐牦牛ACTA1基因与水牛的亲缘关系最近,CDS区序列同源性可达99.6 %,其次是黄牛(99.4 %)和绵羊(98.6 %),与马、大鼠,小鼠等同源性较低,该结果与NJ法构建的ACTA1基因系统进化树分析结果基本吻合。虽然热带爪蟾与类乌齐牦牛的基因序列同源性仅79.5 %,但其编码的氨基酸序列同源性却高达99.4 %,这说明在各物种的ACTA1基因氨基酸在长期生物进化中具有较强的保守性[23];同时也反映了ACTA1基因编码产物结构和功能的稳定性遗传。
在不同组织器官、不同发育阶段肌动蛋白mRNA相对表达量均不同。α肌动蛋白2(ACTA2)蛋白是ACTA1蛋白的异构形式,黄京书等[24]研究了骨骼肌ACTA2蛋白在猪的不同发育阶段呈差异表达,且ACTA2mRNA表达量随日龄增加而降低。田万年等[14]对延边黄牛8个组织器官表达水平的研究表明,ACTA1mRNA在不同组织器官呈差异表达,且主要集中在心脏和背最长肌,在其他组织器官不表达。本研究分析了类乌齐牦牛8个不同组织器官之间的差异表达,结果发现ACTA1基因在8个组织中均有表达,且呈现一定差异性,具体表现为臀肌>大脑>心脏>肺脏>脾脏>乳腺>肝脏>臀脂。结果与田万年等[14]报道的延边黄牛ACTA1基因仅在心脏和背最长肌中表达的结论存在差异,可能类乌齐牦牛常年生活在平均海拔4000 m的草甸草原地区,是世界上生活在海拔最高处的(除人类外)哺乳动物,且善走陡坡险路、雪山沼泽,能游渡江河激流,其骨骼肌为适应代谢及高强度运动需求,臀肌等骨骼肌肌纤维含量非常丰富且发达。已有研究证实[25],在小鼠胚胎发育过程中,低氧环境可诱导其胚胎干细胞分化成心肌细胞及神经纤维细胞,以适应低氧环境;因此,本研究中类乌齐牦牛ACTA1基因在心脏和大脑组织中均有表达,且表达量仅次于臀肌,是其对高原低氧环境具有很好适应性的另一有力证明。
4 结 论
成功克隆了类乌齐牦牛ACTA1基因编码区,系统阐述了ACTA1蛋白理化性质、结构功能,以及其在长期生物进化过程中高度保守;通过组织表达阐释了ACTA1基因编码蛋白是骨骼肌肌纤维的重要组成部分。为进一步研究牦牛ACTA1基因在调控牦牛肌肉发育及其分子机制等方面奠定基础,也为西藏类乌齐牦牛相关研究提供数据资料。
