卒中后抑郁患者丘脑代谢物变化特点的磁共振波谱分析
2019-07-14潘才钰王永盛王苹莉薛思源赵元琛
潘才钰 王永盛 王苹莉 薛思源 赵元琛


[摘要] 目的 利用磁共振波譜技术,分析卒中后抑郁患者丘脑的脑代谢物变化特点,寻找卒中后抑郁特异性的影像标志物。 方法 前瞻性收集2015年8月~2018年2月于我院就诊的卒中后抑郁患者(n=31)和健康者(n=32),选择丘脑为感兴趣区,行磁共振波谱检查,收集数据,测定N-乙酰天冬氨酸(NAA)、胆碱(Cho)、肌酸(Cr)值,计算NAA/Cr、Cho/Cr值。并使用SAS 9.4软件包对数据进行统计分析。 结果 共有31例卒中后抑郁患者和32例健康人群进入本研究,两组对比发现,卒中后抑郁组PSD组左侧丘脑NAA/Cr值(1.11±0.33),右侧(1.30±0.40),显著低于对照组,左侧Cho/Cr值(1.51±0.42),显著高于对照组,PSD组组内对患者自身双侧丘脑各指标进行比较发现,左侧NAA/Cr值显著低于右侧。PSD组双侧丘脑NAA/Cr值与汉密尔顿抑郁量表评分呈显著性负相关,左侧-0.382,右侧-0.287,差异均具有统计学意义(P<0.05)。 结论 相比健康人群,卒中后抑郁患者的丘脑代谢出现了明显变化,并且与抑郁的程度有关,对卒中患者早期进行丘脑磁共振波谱检测,结合量表的评价,有可能能够早期发现卒中后抑郁的患者,并给进一步对发病机制的研究提供方向。
[关键词] 卒中后抑郁;丘脑;磁共振波谱;汉密尔顿抑郁量表
[中图分类号] R743.3 [文献标识码] A [文章编号] 1673-9701(2019)15-0020-04
Magnetic resonance spectroscopy analysis of metabolic changes of thalamus in patients with post-stroke depression
PAN Caiyu WANG Yongsheng WANG Pingli XUE Siyuan ZHAO Yuanchen
Department of Neurology, Wenzhou Hospital of Integrated Traditional Chinese and Western Medicine in Zhejiang Province,Wenzhou 325000,China
[Abstract] Objective To analyze the changes of brain metabolites in the thalamus of post-stroke depression patients by magnetic resonance spectroscopy, and to find specific imaging markers of post-stroke depression. Methods The post-stroke depression patients(n=31) and healthy controls(n=32) admitted in our hospital from August 2015 to February 2018 were prospectively collected. The thalamus was selected as the region of interest. The magnetic resonance spectroscopy was performed and the data were collected. N-acetylaspartate(NAA), Choline and creatine(Cr) values were collected. NAA/Cr and Cho/Cr values were calculated. The data was statistically analyzed using the SAS 9.4 software package. Results A total of 31 post-stroke depression patients and 32 healthy people were enrolled in the study. The left-stage hypothalamic NAA/Cr values in the PSD group were (1.11±0.33), and the right side was(1.30±0.40), which was significantly lower than that of the control group. The Cho/Cr value on the left side was(1.51±0.42), which was significantly higher than that in the control group.The indicators of the bilateral thalamus in the patient of the PSD group were compared, and the left NAA/Cr value was significantly lower than that of the right side. The NAA/Cr values of the bilateral thalamus in the PSD group were significantly negatively correlated with the Hamilton Depression Scale score, with -0.382 on the left side and-0.287 on the right side, and the difference was statistically significant(P<0.05). Conclusion Compared with healthy people, the metabolism of thalamus in patients with post-stroke depression has changed significantly, and it is related to the degree of depression. Early detection of thalamic magnetic resonance spectroscopy in stroke patients, combined with the evaluation of the scale, may be able to detect post-stroke depression patients early and can provide directions for further research on pathogenesis.
[Key words] Post-stroke depression;Thalamus;Magnetic resonance spectroscopy;Hamilton depression scale
卒中后抑郁(post-stroke depression,PSD)是脑卒中的常见并发症,给患者本人及家属带来极大的痛苦,成为影响患者功能恢复和卒中复发的独立危险因素。丘脑是情感体验和情感表达的关键部位[1,2],结构和(或)功能异常可能与PSD发生发展密切相关[3],研究丘脑的代谢情况,能够发现PSD的发病机制,为下一步的研究提供方向。磁共振波谱(magnetic resonance spectroscopy,MRS)分析研究作为一种非侵入性、无损伤的功能性成像技术[4,5],能够检测细胞的代谢变化,为PSD的研究提供了一种有益的探索。本研究通过磁共振波谱分析技术,分析卒中后抑郁患者丘脑细胞代谢改变,寻找能够预测卒中后抑郁的影像評估工具。
1 对象与方法
1.1 研究对象
1.1.1 卒中后抑郁(PSD)组 选择2015年8月~2018年2月于我院神经内科门诊就诊、缺血性卒中后出现抑郁症状,临床确诊为卒中后抑郁的患者,进行抑郁量表评估后同意行丘脑MRS检查。纳入标准:(1)根据中国神经病学会2014年发布的急性缺血性卒中诊断指南标准[6],经头颅MRI确诊,首次诊断为非丘脑区域的缺血性脑卒中患者;(2)缺血性卒中后2个月~2年内出现抑郁症状,17项汉密尔顿抑郁量表(Hamilton's Depression Scale,HAMD)得分≥7分,符合美国精神障碍诊断和统计手册第5版(Diagnostic and Statistical Manual of Mental Disorders:DSM-V,DSM-5)抑郁障碍的诊断标准[7];(3)磁共振证实丘脑区无新鲜梗死/软化灶;(4)至少7 d内未使用影响脑内神经递质的药物;(5)能配合完成量表的评定,患者及家属完全理解本项研究,同意丘脑MRS检查,并签署知情同意书。排除标准:(1)精神或神经系统功能障碍不能配合完成量表及磁共振检查者;(2)发病前有明确的抑郁症或其他精神疾病者;(3)1周内使用过对脑内神经递质或代谢有影响的药物;(4)存在其他系统严重的疾病,长期酗酒或药物依赖者。
1.1.2 对照组 选择2015年8月~2018年2月于我院门诊体检中心体检的健康人群,同意进行汉密尔顿抑郁量表评价及丘脑MRS检查。入组标准:(1)不符合DSM-5任一精神疾病的诊断标准,临床访谈不存在主要精神类疾病的轴心症状;HAMD评分<7分;(2)头颅磁共振检查(Magnetic Resonance Imaging,MRI)未见丘脑、额叶、海马等部位有软化灶;(3)无颅脑外伤史,无严重躯体疾病及内分泌疾病;(4)无长期酗酒及药物依赖史;(5)家属及本人自愿参加本研究,能配合完成量表评价及磁共振检查。排除标准:同PSD组。
共收集PSD患者31例,男15例,年龄40~70岁,平均(56.6±8.8)岁,病程为2~24个月,平均(11.2±3.9)个月:HAMD量表总分为(19.7±5.7)分。对照组入组健康人群32例,男16例,平均年龄(54.9±12.8)岁,HAMD量表总分为(3.5±1.8)分。两组在性别、年龄上比较无差异。见表1。
1.2研究方法
采用临床观察性研究方式,选择诊断为卒中后抑郁的患者及健康人群,收集受试者的一般情况,如性别、年龄等;进行17项汉密尔顿抑郁量表评价,评估受试者精神状态;并行头颅MRI+丘脑MRS检查。
MRS检查方法:采用飞利浦1.5T超导型磁共振仪器完成。采用空间定位技术,先在轴位T1加权成像序列获取三维大脑影像数据,在此基础上进行定位,选取双侧侧脑室后角前方区域为丘脑感兴趣区(region of interest,ROI),MRS采用点分辨自旋回波波谱序列行多体素扫描,参数为重复时间(repetition time,TR)1000 ms,回波时间(Echo Time,TE)144 ms,成像野(field of view,Fov)24 cm×24 cm,激励次数(number of excitations,NEX)1,频率(Freq)16。体素内匀场、发射/接收增益调节、水抑制和无水抑制扫描均由自动扫描程序完成,使半高线宽<10 Hz,水抑制程度为98%。MRS数据使用磁共振扫描仪自带软件完成基线校准、信号平均、代谢物识别及各代谢物波峰曲线下的面积的计算,代谢物的共振峰位置为:N-乙酰天冬氨酸(N-acetylaspartate,NAA):2.02 ppm、肌酸(creatine,Cr):3.03 ppm、胆碱(choline,Cho):3.23 ppm,并得到以Cr为参照的两种代谢物的比值:NAA/Cr和Cho/Cr。MRS由放射科专业医生单独完成。比较NAA/Cr和Cho/Cr在PSD组和对照组之间是否存在差异,并分析NAA/Cr、Cho/Cr与抑郁评分的关系。
1.3 评价标准
汉密尔顿抑郁量表于1960年由Hamilton编制,是临床、科研、抑郁严重程度和抗抑郁疗效评估中最常用的他评量表,有3个版本,即17项、24项、24项,采用0~4分5级评分,具有良好的应用信度。1992年全国诊评协作组研究表明HAMD中文版亦具有较好的信度和效度[8],能够较好地反映抑郁症状的严重程度,包括认知障碍、阻滞、绝望感、焦虑/躯体化、睡眠障碍、体重和日夜变化7类因子,主要用于评价成人抑郁症患者的抑郁症状严重程度及临床试验治疗前后的疗效,评定方法为访谈式及观察法。本研究选用17项量表,HAMD得分≥7分为抑郁症诊断的必要条件。
1.4 统计学方法
采用SAS 9.4软件包进行数据的统计分析。计量资料以(x±s)或M(P25,P75)表示,采用t检验,计数资料以[n(%)]表示,采用χ2检验。MRS各研究指标与HAMD评分的相关性分析采用Pearson相关分析。P<0.05为差异有统计学意义。
2 结果
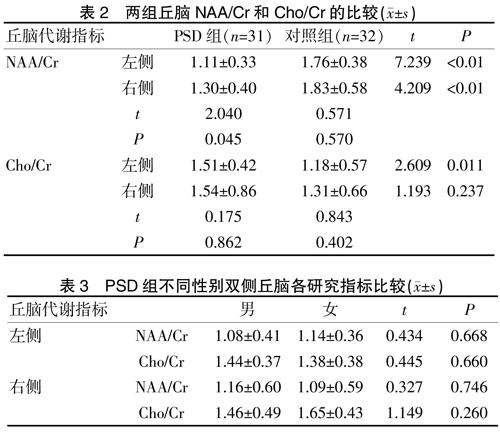
2.1 两组丘脑NAA/Cr和Cho/Cr的比较
PSD组与对照组比较发现,PSD组左侧丘脑NAA/Cr平均值(1.11±0.32),右侧(1.30±0.40),显著低于对照组,差异有统计学意义。PSD组左侧Cho/Cr值1.51,高于对照组,差异有统计学意义。PSD组组内对患者自身双侧丘脑各指标进行比较发现,左侧NAA/Cr值低于右侧,差异有显著性(t=2.040,P=0.045)。见表2。
2.2 PSD组不同性别丘脑研究指标比较
PSD组各指标按照性别不同进行再分析,发现不同性别间的NAA/Cr和Cho/Cr值差异均无统计学意義(P>0.05),见表3。
2.3 PSD组各研究指标与HAMD评分的关系
将PSD组的HAMD评分与各研究指标进行分析发现,双侧丘脑的NAA/Cr值与HAMD评分呈负相关(r=-0.382、-0.287,P<0.05);而双侧丘脑Cho/Cr值与HAMD评分未发现相关关系。见表4。
3 讨论
卒中后抑郁是卒中后2年之内发生的,与脑卒中事件密切相关的情感障碍性疾病,主要表现为抑郁心境和情感低落[9]。脑卒中后抑郁的发病率往往被低估,临床上发现约有1/3的脑卒中患者发生明显的抑郁表现[9-11]。由于PSD多发生在脑卒中后2~6个月,是脑卒中神经功能恢复的黄金时间,发生PSD后,患者兴趣低落,对卒中恢复的信心不足,对康复等治疗的参与性不高,耽误了患者的神经功能恢复进程,给患者家庭及社会增加了极大的负担。对卒中后抑郁进行研究具有极大的社会经济学效益。
丘脑是参与情感体验和情感表达的关键部位,卒中后抑郁的患者很多临床症状与丘脑受损者相似,均可出现情绪的改变及自我评价的改变,导致自理能力下降等,延缓卒中的恢复进程。推测丘脑的结构和(或)功能异常可能与PSD发生发展密切相关。之前的研究发现重度抑郁症患者的皮质-丘脑的网络回路的异常[1],Lu Y等[12]对30例首发未治疗的重度抑郁症患者和26名健康对照受试者进行纤维束成像研究,发现重度抑郁症患者的双侧壳核和左丘脑体积显著减少(P<0.05),左侧丘脑背侧局部萎缩与抑郁的严重程度之间存在负相关。Omura T等[13]的研究对175例卒中的患者做问卷调查。其中诊断为卒中后抑郁的患者有41例,比较抑郁和非抑郁的患者的临床特征发现,PSD患者中,丘脑病变比率明显增高(左侧丘脑5/41 vs 4/134,P=0.03;右侧丘脑5/41 vs 4/134,P=0.03)。Kuchcinski G等[14]研究显示丘脑铁沉积与卒中后抑郁相关,OR:2.77,卒中后抑郁伴随有丘脑背内侧核继发性改变。有些研究[15,16]发现PSD大鼠丘脑源性神经营养因子阳性细胞及高亲和力受体TrkB mRNA和蛋白表达均降低。PSD模型组TrkB阳性细胞表达较对照组[(9.00±2.12)个 vs(41.22±11.91)个]差异有统计学意义。Huang Y等[17]对帕罗西汀的研究同时还发现帕罗西汀可能通过重塑丘脑神经元细胞膜作用于丘脑神经元,来达到抗抑郁的效果。
由神经生理活动引起的局部脑血供和代谢的变化可导致1H-MRS信号的变化,是分析抑郁症的良好工具[4]。MRS最常分析的指标包括NAA、Cho、Cr、Lac值,并计算其比值[18,19]。因为Cr是能量代谢的代谢物,在脑中具有相对恒定的水平,其浓度在各种生理环境下保持相对恒定,通常作为基线数据来使用。NAA/Cr,Cho/Cr的比率可以更客观地反映Cho和NAA的变化。
NAA浓度变化主要反映神经元的结构和功能不同状态下变化的情况。本研究结果发现卒中后抑郁患者双侧丘脑的NAA/Cr值显著低于情绪正常人群,与患者的HAMD评分呈显著负相关,即越严重的卒中后抑郁患者NAA/Cr值越低,提示PSD患者双侧丘脑存在神经元功能异常和(或)结构破坏,损伤的程度可能与抑郁的程度有关。Huang Y等[17]的研究发现PSD患者双侧海马和丘脑中的NAA/Cr比值低于对照组。乔杉杉等[20]的研究发现PSD患者右侧丘脑NAA的值小于非PSD组,均与本研究结果一致。从而提示卒中后抑郁患者的双侧丘脑的微环境发生变化,出现细胞能量代谢障碍或者神经元功能异常和/或结构损害等。
Cho是细胞膜的组分,反映了细胞膜转运功能和细胞增殖的水平,代表胶质细胞的代谢和功能状态。Cho浓度增高可能与神经细胞退行性病变、脑损伤以及反应性胶质增生有关[21]。本项研究结果表明,研究组所入组病例双侧丘脑的Cho/Cr值与对照组相比存在显著差别,与上述研究[17,20]的结果相似。提示卒中后抑郁患者双侧丘脑可能存在胶质细胞的过度增生,细胞膜代谢紊乱及细胞内信号传导异常。
本研究选择磁共振波谱分析为研究手段,对没有丘脑病灶的患者以丘脑为感兴趣脑区,从细胞代谢角度探讨卒中后抑郁的可能机制。卒中后抑郁患者存在的双侧丘脑NAA/Cr值的变化,可以作为一种指标或者一种客观定量的检测工具,对高危风险PSD患者的筛查及风险评估,有可能在精神科或神经内科临床上进一步验证和应用,结合临床量表评估,增加PSD的早期检测率,达到早期诊断早期干预的目的。
[参考文献]
[1] Webb CA,Weber M,Mundy EA,et al. Reduced gray matter volume in the anterior cingulate,orbitofrontal cortex and thalamus as a function of mild depressive symptoms:A voxel-based morphometric analysis[J]. Psychol Med,2014,44(13):2833-2843.
[2] Carlesimo GA,Lombardi MG,Caltagirone C,et al. Recollection and familiarity in the human thalamus[J]. Neuroscience & Biobehavioral Reviews,2015,54:18-28.
[3] Zhi D,Calhoun VD,Lv L,et al. Aberrant dynamic functional network connectivity and graph properties in major depressive disorder[J]. Frontiers in Psychiatry,2018,9:339.
[4] Bustillo JR. Use of proton magnetic resonance spectroscopy in the treatment of psychiatric disorders:A critical update[J]. Dialogues Clin Neurosci,2013,15(3):329-337.
[5] Ito T,Tanaka-Mizuno S,Iwashita N,et al. Proton magnetic resonance spectroscopy assessment of metabolite status of the anterior cingulate cortex in chronic pain patients and healthy controls[J]. Journal of Pain Research,2017,10:287-293.
[6] 中華医学会神经病学分会,中华医学会神经病学分会脑血管病学组. 中国急性缺血性脑卒中诊治指南2014[J].中华神经科杂志,2015,48(4):246-257.
[7] American Psychiatric Association. Diagnostic and statistical manual of mental disorders[M]. 5th edition.Arlington,VA:American Psychiatric Publishing,2013:155-188.
[8] 赵靖平,郑延平. Hamilton 抑郁量表的信度和效度[J]. 中国心理卫生杂志,1992,6(5):214-216.
[9] 王少石,周新雨,朱春燕. 卒中后抑郁临床实践的中国专家共识[J]. 中国卒中杂志,2016. 11(8): 685-693.
[10] Ayerbe L,Ayis S,Wolfe CD,et al. Natural history,predictors and outcomes of depression after stroke:Systematic review and meta-analysis[J]. Br J Psychiatry,2013, 202(1):14-21.
[11] Sarfo FS,Jenkins C,Singh A,et al. Post-stroke depression in Ghana:Characteristics and correlates[J]. Journal of the Neurological Sciences,2017,379:261-265.
[12] Lu Y,Liang H,Han D,et al. The volumetric and shape changes of the putamen and thalamus in first episode, untreated major depressive disorder[J]. Neuroimage Clin,2016,11: 658-666.
[13] Omura T,Kimura M,Kim K,et al. Acute poststroke depression is associated with thalamic lesions and clinical outcomes:A case-control study[J]. Journal of Stroke & Cerebrovascular Diseases the Official Journal of National Stroke Association,2018,27(2):499-505.
[14] Kuchcinski G,Munsch F,Lopes R,et al. Thalamic alterations remote to infarct appear as focal iron accumulation and impact clinical outcome[J]. Brain,2017,140(7):1932-1946.
[15] 李云,彭春,游俊杰,等. 脑卒中后抑郁大鼠丘脑脑源性神经营养因子及酪氨酸激酶受体B蛋白的表达变化[J]. 中华老年心脑血管病杂志,2014,16(5):526-528.
[16] 李云,彭春,郭旭,等. 脑卒中后抑郁大鼠海马、丘脑组织中BNDF、TrkB的表达变化及意义[J]. 山东医药,2013, 53(2):7-9.
[17] Huang Y,Chen W,Li Y, et al. Effects of antidepressant treatment on N-acetyl aspartate and choline levels in the hippocampus and thalami of post-stroke depression patients:A study using(1)H magnetic resonance spectroscopy[J]. Psychiatry Res,2010,182(1):48-52.
[18] 朱程,徐乐平,孙剑,等. 高频或低频重复经颅磁刺激治疗对抑郁障碍患者局部脑内代谢物质的影响[J]. 临床精神医学杂志,2017,27(1):28-31.
[19] 朱敏,刘鹤,宋先东,等. 质子磁共振波谱分析对脑多发性硬化的诊断价值[J]. 中国现代医生,2017,55(5):92-94.
[20] 乔杉杉,李继梅,康智敏. 卒中后抑郁脑代谢物变化特点的磁共振波谱分析[J]. 神经损伤与功能重建,2017, 12(3):228-230,237.
[21] Tisell A,Leinhard OD, Warntjes JB,et al. Procedure for quantitative(1)H magnetic resonance spectroscopy and tissue characterization of human brain tissue based on the use of quantitative magnetic resonance imaging[J]. Magn Reson Med,2013,70(4):905-915.
