加热对鸡卵类黏蛋白结构及其与IgG结合能力的影响
2019-07-10吴子健张允萍侯惠静李晓萌
吴子健,张允萍,侯惠静,李晓萌
(1.天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134;2.天津天狮学院生物与食品工程学院,天津301700)
目前,全球对鸡蛋产生过敏反应的致敏症患者越来越多[1]。鸡蛋不仅是人们的日常食品,而且还是重要的食品工业原料,这也导致了鸡蛋致敏症患者几乎无法避免来自鸡蛋致敏性的威胁。鸡卵类黏蛋白(hen's egg ovomucoid,HOVM)是鸡蛋卵清中一种致敏性广泛、反应剧烈且后果严重的过敏原蛋白[2],会使皮肤血管扩张引起风疹、皮疹,或使胃肠道平滑肌痉挛引起腹泻、腹痛;或使支气管平滑肌收缩导致喘鸣[3]。
HOVM 的含量约占鸡蛋清蛋白总量的11%,是分子质量约为28 kDa 的单亚基糖蛋白,其包括蛋白部分(约75%~80%,由186 个氨基酸残基组成)和糖基部分(约20%~25%)[4]。热处理是食品加工中一种常用的食物处理方式,不仅能够熟化食物,而且能增加食物的口感和风味以及保障食品的安全,研究热处理对于鸡蛋中HOVM 等过敏性蛋白的影响具有十分重要的意义[5]。本课题旨在研究热处理对HOVM 的过敏原性和结构的影响,为探讨HOVM 在热处理作用下结构以及过敏原性的变化规律提供一定的理论基础。
1 材料与方法
1.1 材料与试剂
新鲜鸡蛋:市售;8-苯胺-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS)、鸡卵类黏蛋白抗体NBP1-74676:美国Novus Biologicals 公司;辣根过氧化物酶标记的羊抗兔免疫球蛋白G(immunoglobulin G,IgG):杭州华安生物技术有限公司;其它试剂均为国产分析纯。
1.2 试验仪器
3-18K 离心机:德国 Sigma 公司;EL204 电子天平、FE20 型pH 计:梅特勒-托利多仪器(上海)有限公司;IB8 eco 恒温水浴锅:德国IKA 公司;MOS-450/AF-CD圆二色谱仪:法国Biologic 公司、FL970 荧光分光光度计:上海天美科技有限公司;Spectra Max190 光吸收酶标仪:美国美谷分子仪器有限公司;2000ES 全自动四元梯度高效液相色谱仪(配套UV1000 紫外检测仪):美国科学公司。
1.3 试验方法
1.3.1 HOVM 的提取
HOVM 的提取过程参考王帅等[6]方法,具体过程为:将手工分离得到的鸡蛋蛋清液加入等体积去离子水,置于4.0 ℃下磁力搅拌2 h,然后离心15 min(4 ℃,4 200 r/min),弃沉淀与不溶物,所得上清液缓缓加入等体积三氯乙酸溶液(pH 1.15,10%)并混合均匀,用1.0 mol/L NaOH 溶液调节pH 值至3.5,并于4.0 ℃下静置4 h,离心 15 min(4 ℃,4 200 r/min),取上清置于 4 ℃下透析24 h 以便去除三氯乙酸,透析后的溶液加入硫酸铵至其浓度为50%(体积比),4 ℃下静置4 h,离心15 min(4 ℃,4 200 r/min),取上清再次加入硫酸铵至其终浓度为80 %,再次于4 ℃下静置4 h,最后离心15 min(4 ℃,4 200 r/min),取沉淀,并溶于 20.0mL去离子水中,透析12 h 后冻干,得到HOVM 纯品。
1.3.2 十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gelelectrophoresis,SDSPAGE)
SDS-PAGE 电泳[7]条件:分离胶浓度为12%;浓缩胶浓度为5%;标准蛋白质Marker 采用Fermentas 公司的预染marker(货号为SM0672);电泳电压为200 v;电泳时间40 min。
1.3.3 高效液相色谱
利用高效液相色谱(high performance liquid chromatography,HPLC)法[8]检测 HOVM 样品的纯度,色谱条件如下:色谱柱为 Vydac 214TP C4(5 μm,250 mm×4.6 mm);柱温为 30 ℃;检测波长为 220 nm;流动 A 相为水相(含0.1%三氟乙酸)、流动B 相为乙腈(含0.1%三氟乙酸);洗脱流速为0.3 mL/min。
1.3.4 HOVM 样品的加热处理
将HOVM 样品溶于磷酸盐缓冲液(10 mmol/L、pH 7.4)中,等量分装至试管中,进行加热处理,温度分别为 60、70、80、90、100 ℃,加热时间分别为 30、50、70、90、110 min;加热结束后立即置于冷水中冷却。
1.3.5 圆二色谱法
HOVM 的二级结构表征采用圆二色谱法[9]。具体方法为:将HOVM 配置为0.2 mg/mL 的HOVM 溶液(10 mmol/L 磷酸盐缓冲液,pH 7.4);圆二色谱扫描参数为:光径1.0 cm、波长范围190 nm~250 nm、带宽1.0 nm、扫描速率为60 nm/min、每个样品扫描3 次,取平均值。利用DichroWeb 在线分析程序分析蛋白二级结构组成。
1.3.6 表面疏水性和表面疏水指数S0的测定
HOVM 的表面疏水性采用荧光探针法进行测定[9]。具体方法为:取4.0mLHOVM 待测溶液(0.1 mg/mL),加入 20 μL ANS 荧光探针溶液(1.0 mmol/L),25 ℃条件下避光静置1 h;扫描参数为:激发波长380 nm、发射波长400 nm~700 nm、狭缝宽度5 nm、扫描速度1 200 nm/min。表面疏水指数S0具体方法为:分别量取不同浓度的 4mLHOVM 待测溶液(0.05、0.1、0.15、0.2、0.25 mg/mL),加入 20 μL ANS 荧光探针溶液(1.0 mmol/L),25 ℃条件下避光静置1 h;具体扫描参数如下:激发波长380 nm、发射波长418 nm、狭缝宽度5 nm、扫描速度1 200 nm/min。以蛋白质浓度对荧光强度作图,采用最小二乘法进行曲线拟合,直线斜率即是蛋白质表面疏水指数S0。
1.3.7 间接酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)法
HOVM 与IgG 的结合能力采用间接ELISA 法进行测定[10],具体操作如下:将HOVM 溶于包被液中至蛋白质终浓度为0.02 mg/ml;将HOVM 待测溶液置于96 孔板中,每孔 100 μL 包被液(pH 9.6),4 ℃下包被过夜;然后将包被液倾出,并用磷酸盐吐温缓冲液(pH 7.4,磷酸盐缓冲溶液+1%吐温-20)洗涤3 次;向每孔中加入200 μL 封闭液[磷酸盐吐温缓冲液+1%牛血清白蛋白(bovine serum albumin,BSA)]于 37 ℃下水浴封闭2.5 h;再用磷酸盐吐温缓冲液洗涤3 次;向每孔中加入 100 μL 抗体稀释溶液(体积比 1∶20000),37 ℃下孵育2 h;最后加入辣根过氧化物酶标记的羊抗兔IgG抗体(体积比 1∶2 000)100 μL,37 ℃下孵育 1.5 h,最后加入底物显色液(邻苯二胺)100 μL,37 ℃下避光静置 15 min,测定 OD492nm值。
1.3.8 数据处理与统计分析
用Origin 8.0 作图,用SPSS 17.0 软件对试验数据进行相关性分析,采用 dichroweb(http://dichroweb.cryst.bbk.ac.uk/html/process.shtml)在线分析圆二色光谱的变化。
2 结果与讨论
2.1 HOVM蛋白样品的分离效果
经过方法1.3.1(即三步沉淀法),所得样品的高效液相色谱以及SDS-PAGE 电泳结果如图1 所示。
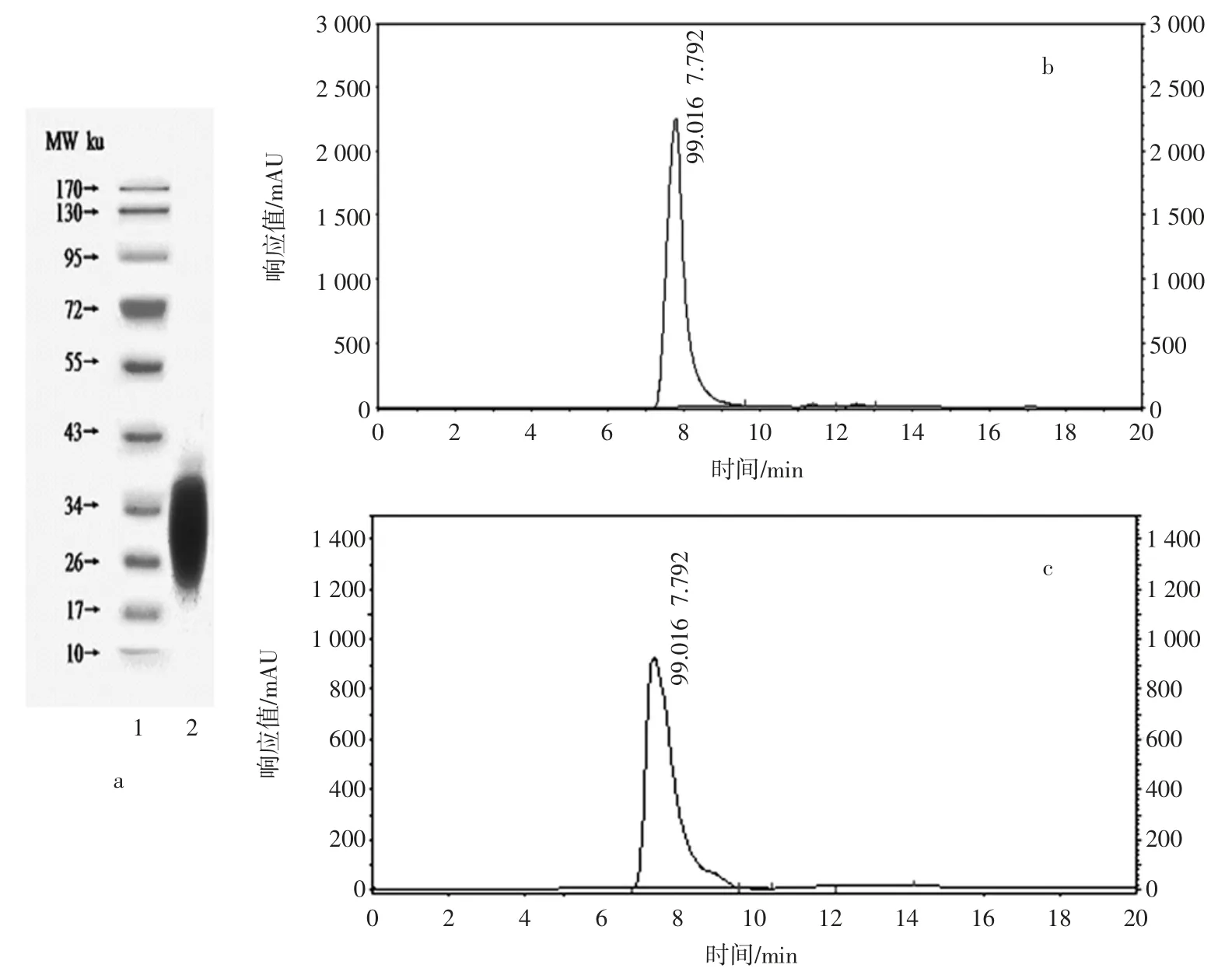
图1 HOVM 样品纯度的检测Fig.1 HOVM sample purity evaluation
结果显示:对比HOVM 样品和标准品液相色谱图,样品与HOVM 标准品均在约7.0 min 时开始出峰,8.0 min 时会达到最大峰值,可以判断所提样品为HOVM;另外经CSChrom Plus 软件峰面积计算可知提取样品的纯度可达99.688%,略高于标准品蛋白质的纯度(99.016%),该结果与王帅[10]、史晓霞[11]所得结果基本一致。HOVM 样品的SDS-PAGE 电泳图谱(如图1a 所示)结果显示样品蛋白电泳道呈现较粗的条带,大约位于20 kDa~39 kDa 分子量范围内,此结果也与王帅、史晓霞等所得到的结果相同,这是因为HOVM中的糖基含量较高(为20%~25%),而糖基含量较高导致其SDS-PAGE 电泳图中呈现出较粗的条带[12-13]。
2.2 热处理对卵类黏蛋白与IgG结合能力的影响
热处理对卵类黏蛋白与IgG 结合能力的影响如图2 所示。

图2 热处理对HOVM 与IgG 结合能力的影响Fig.2 Effects of heating treatment on HOVM's ability to bind IgG
OD492nm值是用于表征间接ELISA 法检测HOVM分子与IgG 的结合能力,OD 值越大,则说明HOVM 与IgG 结合能力越强;反之,OD 值越小,则表明HOVM与IgG 结合能力越弱。温度对HOVM 与IgG 的结合能力的影响如图2 所示:热处理的强度(包括温度和时间)的提高会降低HOVM 与IgG 结合能力。其中在加热温度为 60、70、80 ℃时,OD492nm值下降较缓慢,这也印证了卵类黏蛋白具有高耐热特性;当加热温度达到90 ℃和 100 ℃时,OD492nm值明显减小,HOVM 与 IgG 的结合能力下降:当加热时间低于70 min 时,OD492nm值逐渐减小,HOVM 与IgG 的结合能力逐步下降,当热处理时间提升到90、110 min 时,OD492nm值趋于平稳达到最低值,HOVM 与IgG 的结合能力下降至最低值。这些研究结果与史晓霞[11]的研究结果类似。加热处理对于其它鸡卵清中的过敏蛋白结合IgG 的影响也有报道,如Tong P 等[14]的研究发现:热处理卵转铁蛋白,处理时间5 min~45 min 内,当加热温度不超过60 ℃时,卵转铁蛋白与IgG 的结合能力较强,且随着时间增加结合能力略有提升;当加热温度达到70 ℃,加热5 min 时,卵转铁蛋白与IgG 的结合能力最大,当热处理时间超过5 min 后,卵转铁蛋白与IgG 的结合能力迅速降低;当加热温度超过70 ℃后,随着热处理的时间的延长,卵转铁蛋白与IgG 的结合能力逐步降低,并在30 min以后趋于平缓达到最低值。说明热处理程度的提高(包括温度的升高和加热时间的延长),可以降低这些过敏性蛋白结合IgG 的能力。
2.3 加热对HOVM表面疏水性的影响
加热对HOVM 表面疏水性的影响如图3 所示。
蛋白质的表面疏水性可反映蛋白质分子表面存在的疏水基团数量的变化,也可间接显示蛋白质三级结构的变化情况,是衡量蛋白质功能性质的关键指标之一[15]。通常蛋白质折叠过程中,大多非极性氨基酸残基会由于疏水相互作用从而聚集形成蛋白质的疏水性内核,成为维持蛋白质三级结构的重要作用力[16];但有时,由于某些原因(如变性、溶解环境的变化等),蛋白质分子中的疏水性氨基酸残基会部分暴露在外表面,通常会借助可发荧光的疏水性探针(如ANS)与蛋白质表面暴露的疏水性残基相互结合,利用所产生荧光强度的变化来间接反映蛋白质的表面疏水性强度[17-19]。本研究利用ANS 荧光探针法检测HOVM 分子表面疏水性,热处理温度和时间对HOVM 分子表面疏水性产生的影响如图3 所示:热处理时间相同的条件下,加热温度对HOVM 表面疏水性影响的变化趋势基本一致;当处理温度范围为60 ℃~90 ℃时,HOVM 的外源性荧光强度随着温度的升高而增强(即HOVM 的表面疏水性随处理温度升高而增加),表明60 ℃~90 ℃温度范围内,加热会逐渐增加蛋白质分子中疏水性氨基酸残基的暴露程度,进而使得其外源性荧光强度增强;但当加热温度为100 ℃时,HOVM 的外源性荧光强度会下降,只比处理温度60 ℃下的荧光强度高一点,可能的原因在于温度升高到一定程度时,蛋白质分子之间会发生不可逆的聚集,形成大的蛋白质分子聚集体,从而会掩蔽一部分原本暴露的表面疏水性基团,也就减少了与ANS 结合的疏水性残基的数量,此时的荧光强度就会显著降低[20];另外,在一些物理过程(如加热等)的作用下,蛋白质分子与ANS 荧光探针结合后,其最大荧光波长会发生蓝移[21]。从图3 中可以看出,随着处理强度(包括时间和温度)的提高,HOVM 的最大荧光波长数(λmax)较之对照组会发生蓝移。相同加热时间下,随着热处理温度的升高,HOVM 的蓝移程度不断加大。且在每组数据中都发现,加热温度达到90 ℃和100 ℃时,蓝移程度最大。如加热时间30 min 时,60、70、80、90 ℃以及 100 ℃处理温度下,λmax蓝移分别为25、20、23、28 nm 的蓝移。
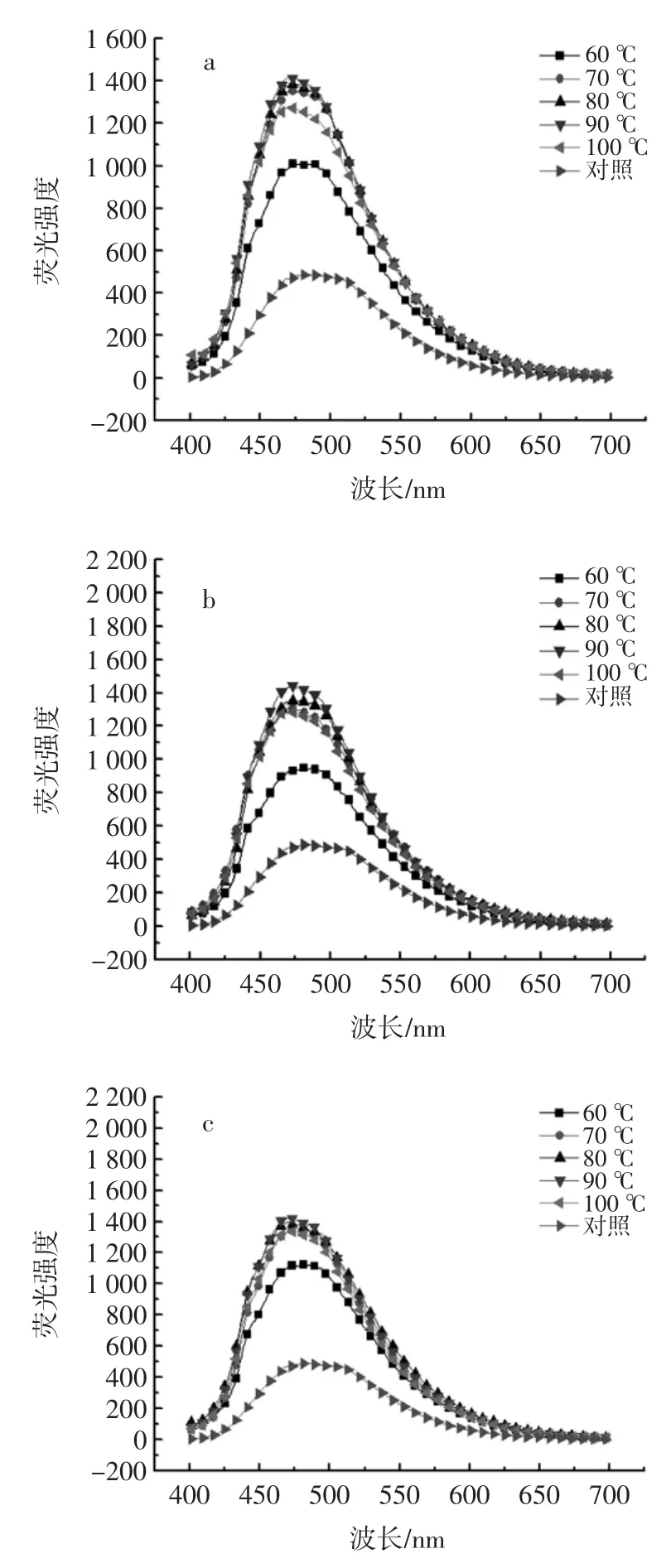
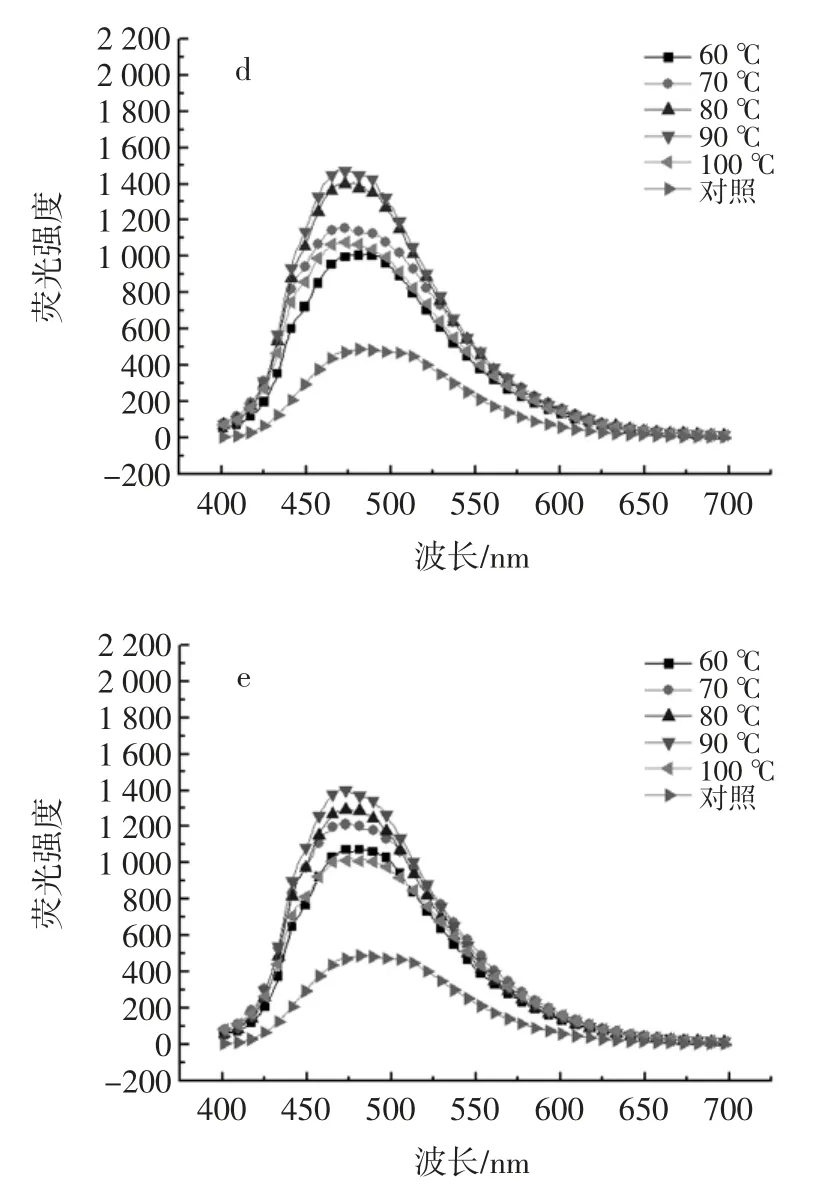
图3 热处理对HOVM 表面疏水性的影响Fig.3 Effects of heat treatment on HOVM's surface hydrophobicity
热处理对IgG 结合能力与表面疏水性指数S0的影响如图4 所示。
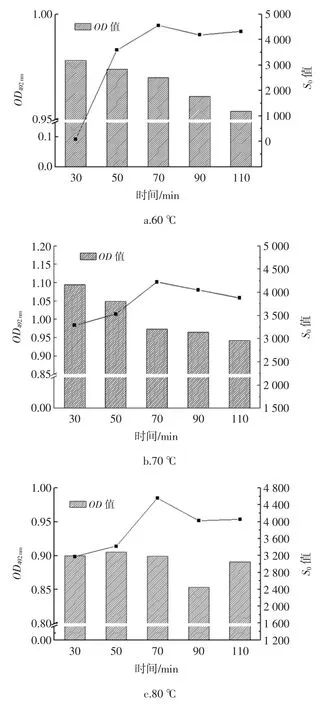
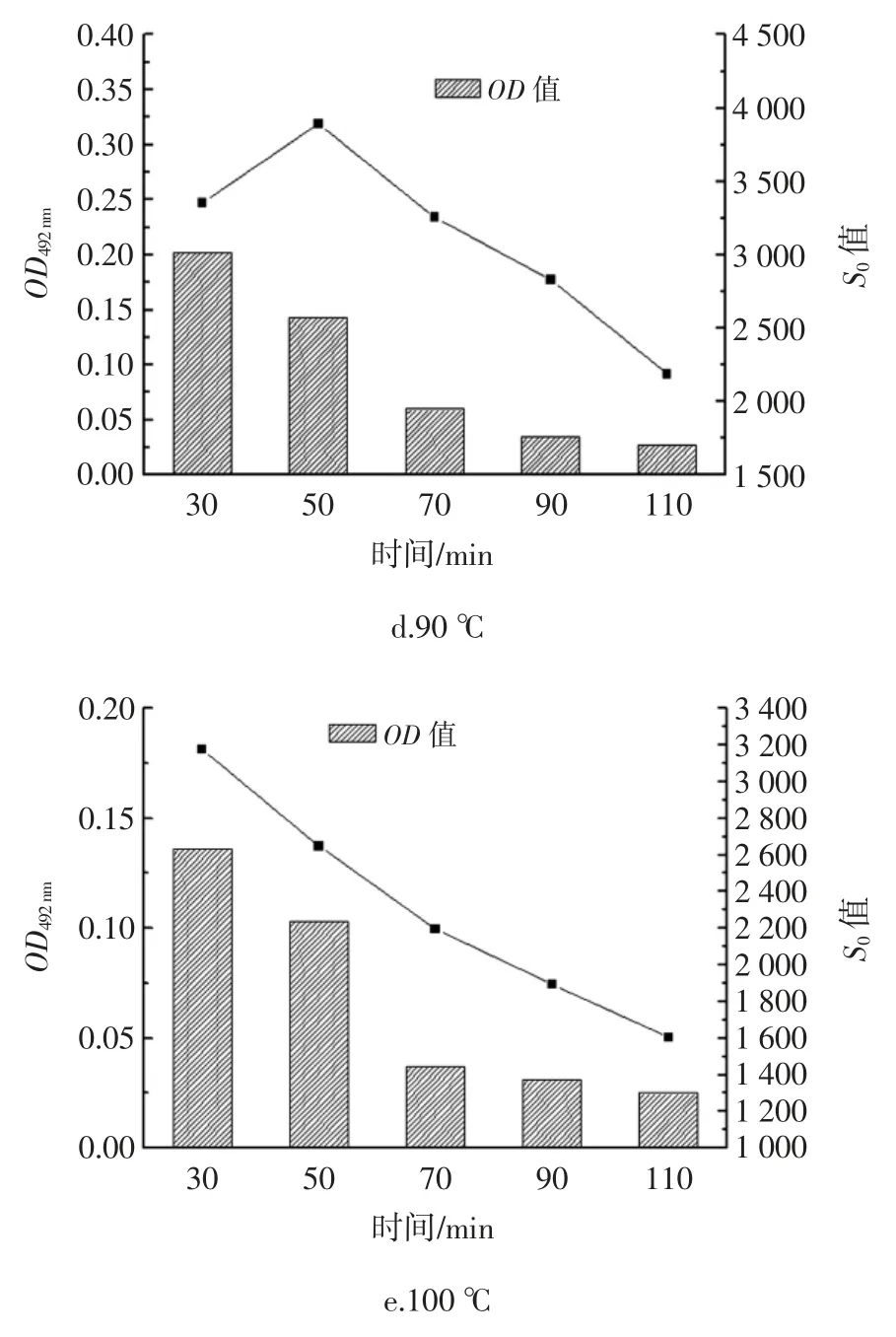
图4 热处理对IgG 结合能力与表面疏水性指数S0的影响Fig.4 Effects of heat treatment on HOVM's IgG-binding ability and surface hydrophobicity index S0
如图4 所示,热处理温度为 60、70、80 ℃且热处理时间不超过70 min 时,表面疏水性指数随着热处理时间的延长而增大,并在70 min 时有最大值,这可能是因为在加热时蛋白质分子就从天然的卷曲状态发生变性而舒展开,原来藏在卷曲结构内部的一些疏水基团就暴露出来,而在外部的亲水性基团相对减少,结果导致S0的增大。当热处理温度为80 ℃时,热处理时间在 70 min~110 min 时,OD492nm值有一个先下降再上升的过程,而对比表面疏水性指数S0的变化,发现S0值较高,这可能是因为抗原表位多存在于亲水区域[22],表面疏水性指数的升高表明亲水区域被掩蔽,即部分抗原表位被掩蔽,因此OD492nm值下降,即HOVM 与IgG 结合能力降低。当热处理温度为90、100 ℃时,发现表面疏水性指数与OD492nm值随着加热时间的延长呈现了一个自峰值下降的现象。这可能是因为当温度过高时蛋白质发生了剧烈的凝聚致使其表面疏水性指数也随之下降,这也使得其抗原表位失活,引起OD492nm值的显著下降,即与IgG 结合能力下降。
2.5 加热对HOVM二级结构的影响
加热对HOVM 二级结构的影响如图5 所示。
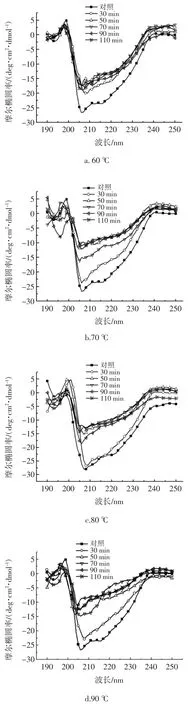
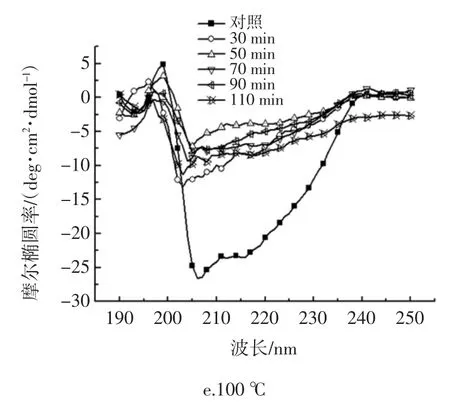
图5 热处理对HOVM 圆二色光谱图谱及二级结构的影响Fig.5 Effects of Heating on the far-UV CD spectrum structure of HOVM.
圆二色谱法可用于分析蛋白质二级结构的变化,通常波长范围在190 nm~250 nm,α-螺旋的特征峰为208 nm~222 nm 处的负肩峰和 192 nm 处的正峰;β-折叠的特征峰为214 nm 附近的负峰和185 nm~200 nm处的正峰;β-转角的特征正峰在206 nm 处[23]。通过圆二色谱法检测温度对HOVM 二级结构的影响,其结果如图5 所示:不同温度下,经热处理的HOVM 样品圆二色谱图均在206 nm 处附近有一正峰,且加热时间延长,峰值会随之提高,表明β-折叠的含量在逐渐提高且光谱曲线变得更加不平滑;当加热温度相同时,热处理时间的延长会使200 nm~225 nm 处的负肩峰强度逐渐减小;热处理110 min 时的HOVM 样品圆二色谱图谱中208 nm~225 nm 处的肩峰值强度最小,推测此时的α-螺旋含量最小。
由图5,代表α-螺旋的负肩峰的峰强度随着热处理程度的增加而不断减小,这表明热处理使α-螺旋结构含量降低。代表β-折叠在214 nm 处显示的特征负峰强度和代表β-折叠在185 nm~200 nm 处的正峰随着热处理程度的增加而不断减小,这表明热处理使β-折叠结构含量不断降低,二级结构随着热处理时间的延长都呈现出α-螺旋和β-折叠的含量逐渐降低、而β-转角和无规则卷曲的含量逐渐升高的趋势。
2.4 加热处理HOVM蛋白IgG结合能力与二级结构的变化的关系
加热处理HOVM 蛋白IgG 结合能力与二级结构的变化的影响如图6 所示。
蛋白质分子中多肽链平面通过氨基酸α-C 原子盘旋呈紧密而稳定的结构在加热作用下转变成为不规则的疏松构象,从而不同程度地影响蛋白质的二级结构[24]。
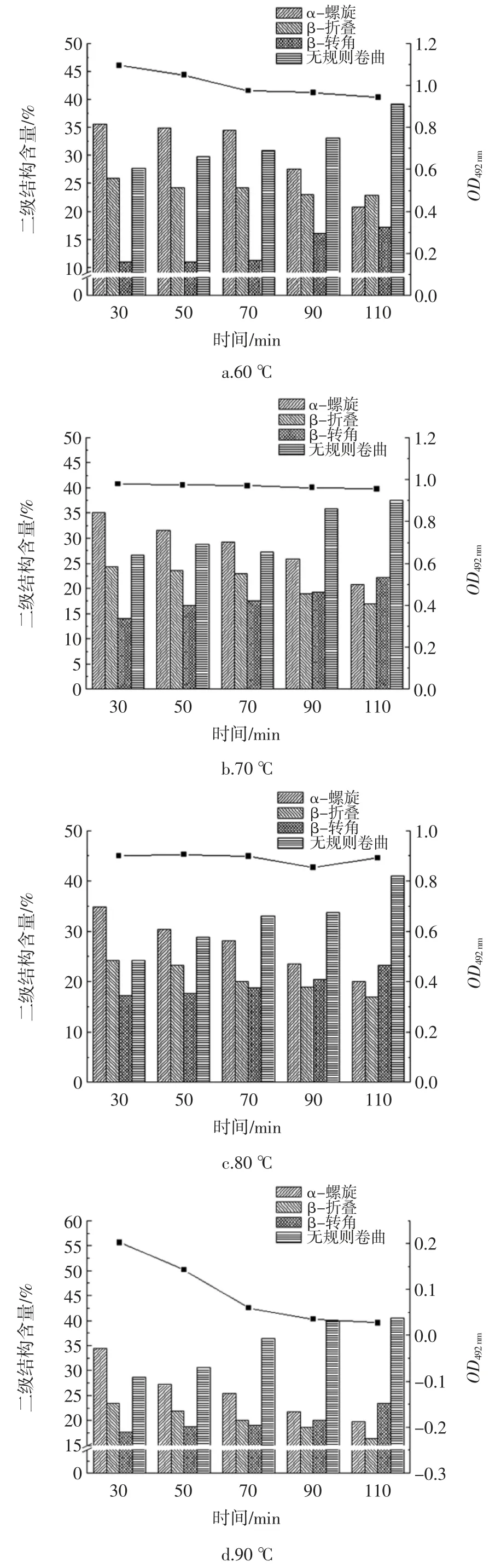
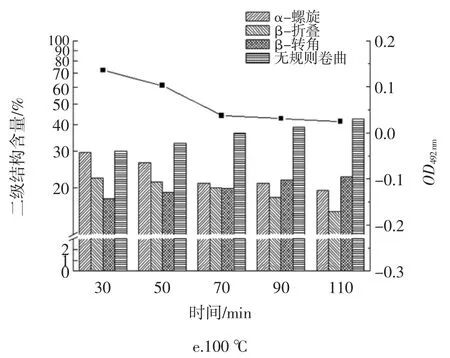
图6 热处理对IgG 结合能力与二级结构含量的影响Fig.6 The effect of heat treatment on IgG binding capacity and secondary structure content
由图6 可知,在加热的过程中,HOVM 的二级结构有明显的改变,α-螺旋和β-折叠的含量均呈下降趋势,β-转角和无规则卷曲呈上升趋势,无规则卷曲的含量在热处理温度100 ℃、热处理时间110 min 时达到最大,占比为42.5%,β-转角的含量虽然在逐步上升;但在加热110 min,90 ℃下达到最高值,占比为23.5%,当加热温度提高至100 ℃时,β-转角的含量略有下降。对比OD492nm值的变化,发现当加热温度超过80 ℃时,随着时间的增加,可以看到α-螺旋、β-折叠的含量与OD492nm值的变化同趋势下降。可以猜测抗原表位周围含有较多的α-螺旋和β-折叠结构。在加热温度为 60、70 ℃的时候,α-螺旋、β-折叠的含量发生了下降但OD492nm值的变化并不明显。这可能是因为蛋白质的二级结构发生了一定改变,但还不足以使其抗原表位被掩蔽掉,因此OD492nm值的变化不够显著,此时的HOVM 与IgG 的结合能力没有过多的降低。
由于在加热80 ℃以后OD492nm值有一个断崖式的下降,因此选择分段的方式进行相关性分析具体结果如表1,结果发现:当加热温度在60 ℃~80 ℃时,温度、α-螺旋、β-折叠和β-转角的含量均与OD492nm值均呈显著相关,其中α-螺旋、β-折叠的含量与OD492nm值呈显著正相关(p<0.05),温度、β-转角的含量与 OD 呈显著负相关(p<0.01)。当加热时间达到80 ℃以上时,时间、α-螺旋、β-折叠、β-转角和无规则卷曲的含量均与OD492nm呈显著相关(p<0.01),其中 α-螺旋、β-折叠的含量与 OD492nm值呈显著正相关(p<0.01),时间、β-转角和无规则卷曲的含量与OD492nm值呈显著负相关(p<0.01)。
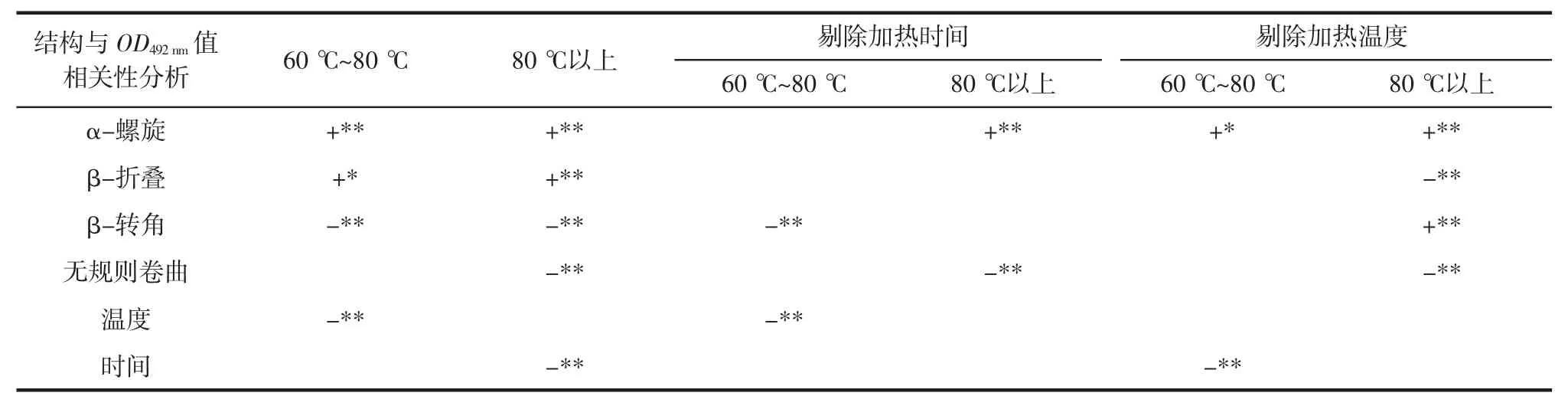
表1 二级结构与OD492nm值相关性分析汇总表Table 1 Summary of correlation analysis between secondary structure and OD492nmvalue
在进行进一步的偏相关性分析中发现:剔除加热时间对其他因素的影响后,当加热温度在60 ℃~80 ℃时,温度和β-转角的含量均与OD492nm值在0.01 水平上呈显著相关且均呈显著负相关(p<0.01)。当加热时间达到90 ℃以后时,α-螺旋和无规则卷曲的含量均与OD492nm值呈显著相关,其中α-螺旋的含量与OD492nm值呈显著正相关(p<0.01),无规则卷曲的含量与OD492nm呈显著负相关(p<0.05)。
当温度达到80 ℃以上时,剔除加热温度对其他因素的影响后,发现加热时间、α-螺旋、β-折叠、β-转角和无规则卷曲的含量均与OD492nm值均显著相关。其中,α-螺旋、β-折叠的含量与OD492nm值呈显著正相关(p<0.01),时间、β-转角和无规则卷曲的含量与OD492nm值呈显著负相关(p<0.01)。
3 结论
热处理会影响HOVM 的结构及其与IgG 结合能力。首先,随着热处理强度(包括温度和时间)的增加,HOVM 与IgG 的结合能力会不断下降,特别是90 ℃和100 ℃处理下,HOVM 与IgG 的结合能力显著下降达到最低值,相关性分析显示60 ℃~80 ℃,温度与OD492nm值呈显著负相关(p<0.01),而加热温度80 ℃以上时,加热时间与 OD492nm值呈显著负相关(p<0.01);其次,表面疏水性指数在热处理强度不高的情况下会随热处理强度的提高而增加,热处理强度高的情况下会随强度的增高而下降,HOVM 的最大荧光波长数(λmax)发生蓝移以及数值的变化表明HOVM 结构先变得松散,随后处理温度的攀升可能会进一步导致HOVM 蛋白发生凝聚;并且,在热处理过程中,HOVM 的二级结构组成中α-螺旋和β-折叠的含量呈下降趋势,β-转角和无规则卷曲的含量呈上升趋势;HOVM 二级结构组成的改变与其结合IgG 的能力之间存在一定关系,即当热处理温度在 60 ℃~80 ℃时,α-螺旋、β-折叠的含量与 OD492nm值呈显著正相关(p<0.05),β-转角的含量与OD492nm值呈显著负相关(p<0.01)。当加热时间达到80 ℃以上时,α-螺旋、β-折叠的含量与 OD492nm值呈显著正相关(p<0.01),β-转角和无规则卷曲的含量与OD492nm值呈显著负相关(p<0.01)。
