荞麦叶大百合总黄酮提取工艺及抗氧化活性研究
2019-07-10秦晶晶钱慧琴赵媛魏婧魏琬絜闫福林
秦晶晶,钱慧琴,赵媛,魏婧,魏琬絜,闫福林,2,*
(1.新乡医学院三全学院,河南新乡453000;2.新乡医学院,河南新乡453000)
荞麦叶大百合(Cardiocrinum cathayanum)属于为百合科(Liliaceae)百合属(Lium)多年生单子叶植物,是国家卫生部审批通过的第一批药食两用植物之一[1-3]。研究发现,百合具有抗氧化、消炎、抗疲劳、抗抑郁、降血糖、改善呼吸功能等作用,百合主要化学成分为黄酮、多糖、皂苷,生物碱物质[4]。其中黄酮类化合物是广泛存在于植物界的一大类天然产物,酮类化合物具有多种生物活性,如抗氧化、抗炎、抗病毒、强心、镇静、镇痛、抗衰老和抗肿瘤等作用[5-10]。其中最为重要的是它能减少自由基形成和清除自由基的抗氧化活性,还具有抗脂质过氧化作用,是一类值得深入研究的天然有机抗氧化剂[11]。
目前,尚未有荞麦叶大百合中总黄酮提取工艺及其抗氧化性的研究报道,因此,本研究以河南南阳桐柏县为产地的荞麦叶大百合作为研究对象,通过乙醇提取荞麦叶大百合总黄酮,以总黄酮提取率(mg/g)为评价指标,考察乙醇浓度、提取温度、料液比、提取时间对黄酮提取率的影响,并在单因素的试验基础上,进行了四因素三水平正交试验,从而优化荞麦叶大百合总黄酮提取工艺。由于黄酮具有较强的抗氧化作用,因此在荞麦叶大百合总黄酮的最佳提取工艺条件下通过DPPH 试验来初步研究其抗氧化活性,以期为荞麦叶大百合的综合利用和提取荞麦叶大百合黄酮作为天然食品抗氧化剂等提供了理论基础。
1 材料与方法
1.1 材料与设备
荞麦叶大百合采自南阳桐柏县,经新乡医学院三全学院药学院中药教研室闫福林教授鉴定为百合科大百合属的地上部分,自然晾干,试验前60 ℃烘至恒重,粉碎,过40 目筛,备用。芦丁对照品(批号:100080-201408):中国食品药品检定研究院;DPPH(CAS:1898-66-4):东京化成工业株式会社;95 %乙醇、NaNO2、Al(NO3)3、NaOH 等试剂均为分析纯:天津市德恩化学试剂有限公司。
FA1004A 电子分析天平:上海象平仪器仪表有限公司;SG-4054 型数控精密恒温水浴锅:上海硕光电子科技有限公司;KQ5200DE 型数控超声波清洗器:昆山市超声仪器有限公司;R206 型旋转蒸发仪:上海申生科技有限公司;SHZ-3 型循环水式真空泵:郑州杜甫仪器厂;101-8 型电热鼓风恒温干燥箱:江苏金坛市佳美仪器有限公司;T6 新世纪紫外可见分光光度计:北京普析通用仪器有限责任公司。
1.2 试验方法
1.2.1 芦丁标准曲线绘制
精密称取芦丁对照品25 mg,置于50mL容量瓶中,加入少量95%乙醇溶解并定容至刻度,摇匀即得芦丁对照品溶液(5 mg/mL)。精密吸取芦丁对照品溶液 0.0 、0.2 、0.4、0.6 、0.8、1.0、1.2 mL,分别置于 10 mL具塞试管中,各加水至5.0 mL,分别加入5%亚硝酸钠0.6 mL,摇匀,放6 min,加入10%硝酸铝0.6 mL,摇匀后放置6 min,加入4%NaOH 3.0 mL,加水至刻度,摇匀后放置15 min。以第一管做空白,于506 nm 波长处测定吸收度A[12],以芦丁浓度C(μg/mL)为横坐标,吸收度A 为纵坐标,绘制标准曲线,y=0.070 2x+0.001 3,R2=0.999 7。
1.2.2 样品总黄酮的测定
称取荞麦叶的大百合粉末2.5 g,经抽滤得到提取物,旋转蒸发后溶解定容至25mL容量瓶中,摇匀,备用。按“1.2.1”项方法测吸光度,根据芦丁标准曲线计算出总黄酮含量。
1.2.3 单因素试验
按“1.2.1”方法,研究单因素乙醇浓度(50%、60%、70%、80%、90%),提取温度(40、50、60、70、80 ℃),料液比[1∶5、1∶10、1∶20、1∶30、1∶40(g/mL)],提取时间(10、20、30、40、50 min)对荞麦叶大百合总黄酮的影响。
1.2.4 最佳工艺条件选择
为了获得以乙醇作为溶剂,回流提取荞麦叶大百合黄酮的最佳工艺条件,在单因素试验结果基础上,以荞麦叶大百合总黄酮提取率为考察指标,进行L9(34)正交试验,具体因素与水平设计见表1。
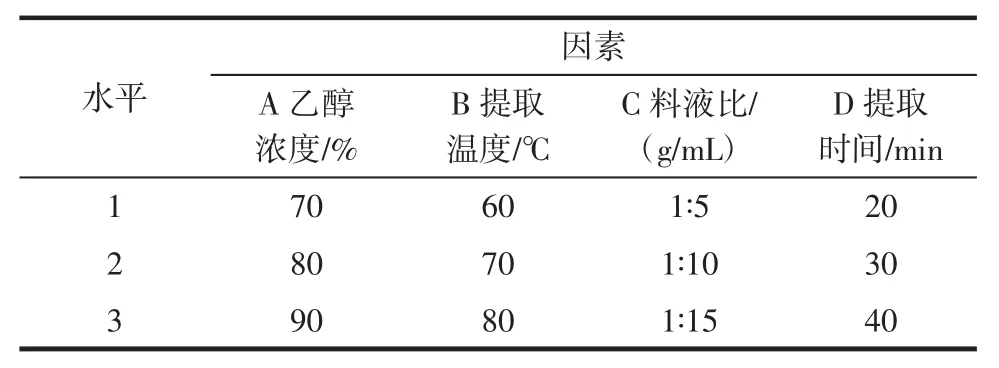
表1 L9(34)正交试验的因素与水平Table 1 The factors and levels of L9(34)orthogonal experiment
1.2.5 荞麦叶大百合总黄酮对DPPH 自由基清除能力的测定
荞麦叶大百合浓缩液加无水乙醇配制成质量浓度分别为 8、16、24、32、40、48、64、72、80 μg/mL 的样品溶液。参考文献[13],在10mL试管中分别加入2 mL的1.3×10-5mol/L DPPH 溶液和2mL的不同浓度的各样品溶液,密封,避光反应30 min,于517 nm 处测定各样品溶液的吸光度为A1,同时以等量乙醇溶液作为空白对照,并且平行测定用乙醇溶液作参比时的吸光度A2(即为2mL的1.3×10-5mol/L DPPH溶液加入2mL的无水乙醇溶液),测定2mL的无水乙醇溶液和2 mL不同浓度的各样品液混合液的吸光度为A0。根据下面的公式计算清除率及EC50。

式中:A2表示2 mLDPPH 中加入2mL的无水乙醇的吸光度;A1表示2 mLDPPH 中加入2mL各样品溶液的吸光度;A0表示2mL无水乙醇中加入2mL各样品液的吸光度。
1.3 数据统计分析
采用 SPASS20.0、Microsoft Excel 2007 进行试验数据处理、分析及绘图。
2 结果与分析
2.1 单因素试验结果
2.1.1 不同乙醇浓度对荞麦叶大百合黄酮提取工艺的影响
不同乙醇浓度对荞麦叶大百合黄酮提取工艺的影响见图1。
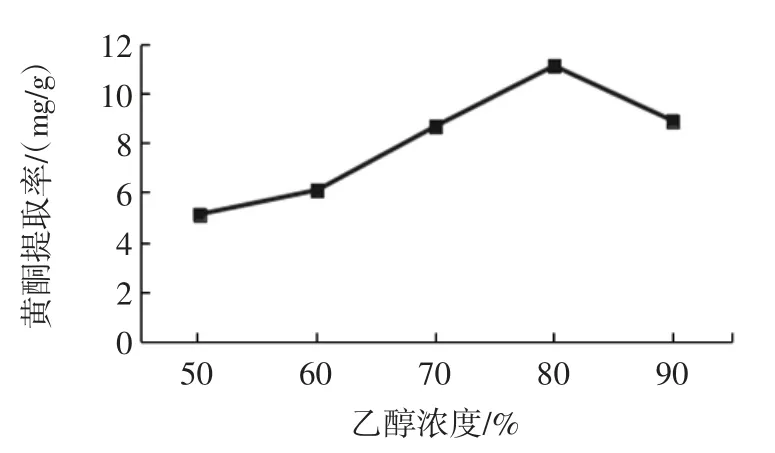
图1 不同乙醇浓度对荞麦叶大百合黄酮提取工艺影响Fig.1 The effects of ethanol concentration on extraction quantity of total flavonoids from Cardiocrinum cathayanum
由图1 可知,乙醇浓度为80%时,黄酮提取率最高为11.11 mg/g,当乙醇浓度为50%~80%时,所提取黄酮质量随着乙醇浓度增大而增加。而当乙醇浓度>80%时,黄酮的质量随浓度增加而减小,其原因可能是因为随着乙醇浓度增加,细胞内外浓度差增加,从而增加提取黄酮质量。但当乙醇超过80%以后,使有些醇溶性杂质、色素增多,这些杂质会与黄酮竞争溶剂,导致黄酮类化合物的溶解度降低。因此,选择乙醇浓度为80%优化黄酮提取。
2.1.2 不同提取温度对荞麦叶大百合黄酮提取工艺的影响
不同提取温度对荞麦叶大百合黄酮提取工艺的影响见图2。
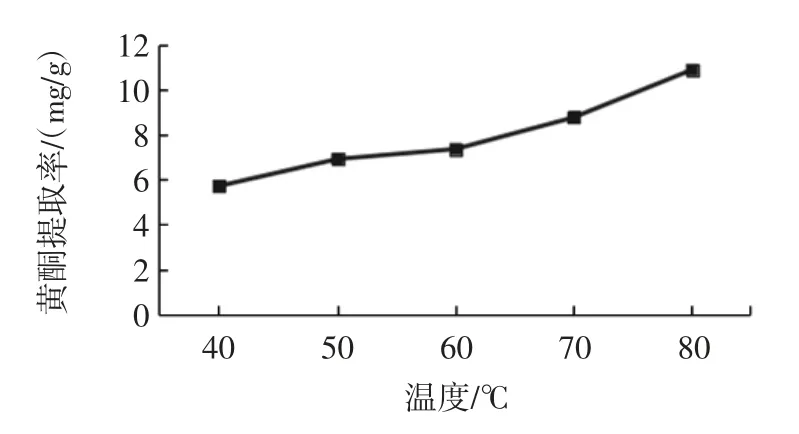
图2 不同温度对荞麦叶大百合黄酮提取工艺影响Fig.2 The effects of extraction temperature on extraction quantity of total flavonoids from Cardiocrinum cathayanum
由图2 可知,提取温度为80 ℃时,黄酮提取率最高为10.91 mg/g,提取黄酮质量随着乙温度的增高而增高,可能是由于荞麦叶大白合中黄酮类化合物极性小,溶解度低,因此增加温度时使其溶解,而且由于80%乙醇浓度的沸点约为80 ℃,因此选择提取温度为80 ℃优化黄酮提取。
2.1.3 不同料液比对荞麦叶大百合黄酮提取工艺的影响
不同料液比对荞麦叶大百合黄酮提取工艺的影响见图3。
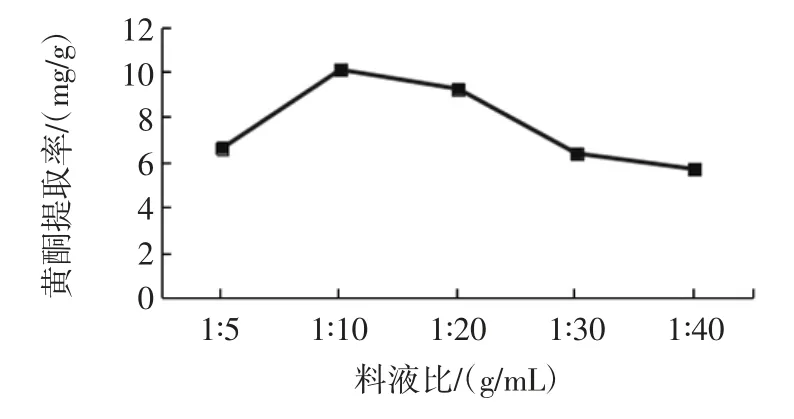
图3 不同料液比对荞麦叶大百合黄酮提取工艺影响Fig.3 The effects of material-liquid ratio on extraction quantity of total flavonoids from Cardiocrinum cathayanum
由图3 可知,料液比为 1∶10(g/mL)时黄酮提取率最高,为 10.11 mg/g;当料液比为 1∶5(g/mL)~1∶10(g/mL)时,所提取黄酮质量随着溶液体积增大而增加。其原因可能是刚开始随着溶液体积增加,荞麦叶大百合颗粒与乙醇之间的接触面增加,提高了黄酮类化合物像溶剂中转移的扩散系数,使得更多的黄酮类化合物转移到提取溶剂中。而当料液比为 1∶10(g/mL)~1∶40(g/mL)时,所提取黄酮质量随着溶液体积增大反而降低。可能是由于随着溶液体积在继续增加,由于大量溶质溶出、部分黄酮类化合物与溶剂长时间接触导致结构破坏所致的。因此选择料液比为1∶10(g/mL)时优化黄酮提取。
2.1.4 不同提取时间对荞麦叶大百合黄酮提取工艺的影响
不同提取时间对荞麦叶大百合黄酮提取工艺的影响见图4。
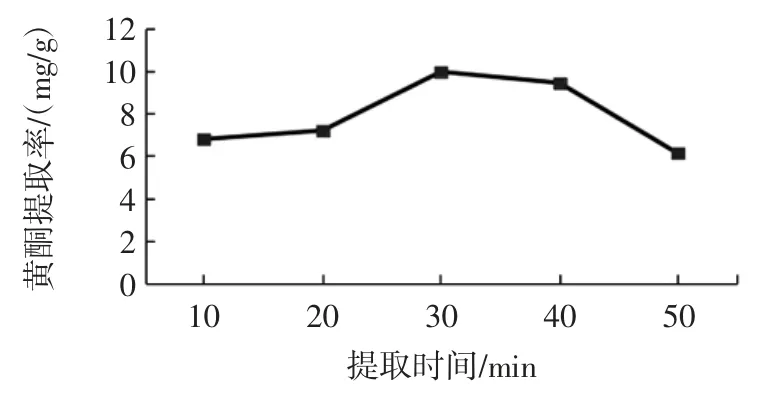
图4 不同提取时间对荞麦叶大百合黄酮提取工艺影响Fig.4 The effects of extraction time on extraction quantity of total flavonoids from Cardiocrinum cathayanum
由图4 可知,提取时间为30 min 时,黄酮提取率最高,为10.01 mg/g。当提取时间为10 min~30 min 时,黄酮含量随着提取时间增加而增加。超过30 min 时,黄酮含量随着提取时间反而降低。其原因可能是因为随着提取时间延长,溶剂与荞麦叶大百合颗粒充分接触,使其里面的黄酮类化合物充分溶出,从而使黄酮含量增高;但是当一定温度时,时间越久,由于溶剂中乙醇挥发,导致提取溶剂极性增加,根据相似相容原理,极性小的黄酮类化合物反而析出,从而导致黄酮类化合物含量降低。因此选择提取时间为30 min 时优化黄酮提取。
2.2 正交试验结果分析
正交试验结果分析见表2。
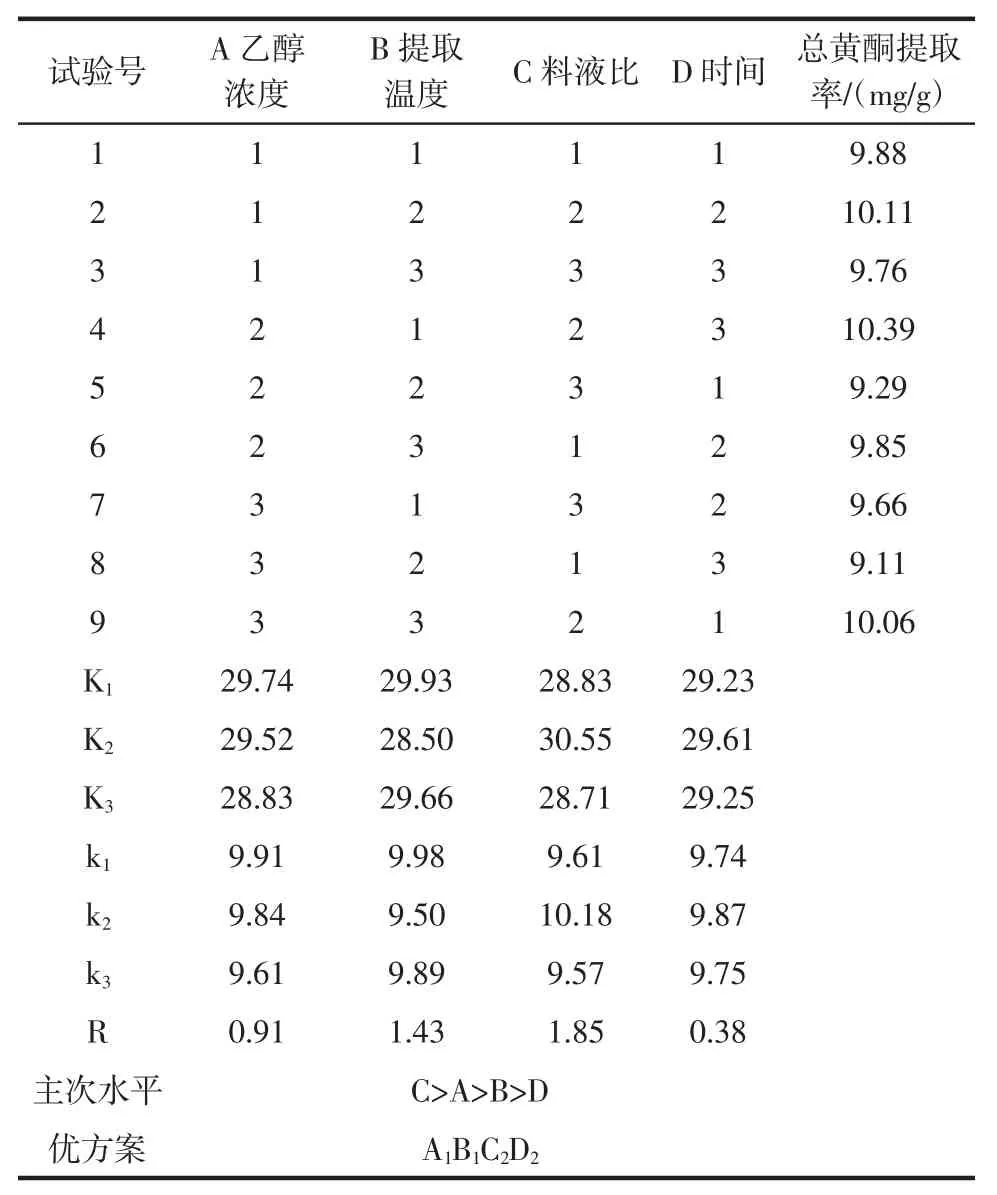
表2 正交试验结果直观分析Table 2 Visual analysis of orthogonal experiment results
由表2 可知,R 值越大,说明该因素的水平变动对试验结果的影响越大,荞麦叶大百合黄酮提取的4 个因素影响大小顺序为料液比(C)>乙醇浓度(A)>提取温度(B)>提取时间(D)。
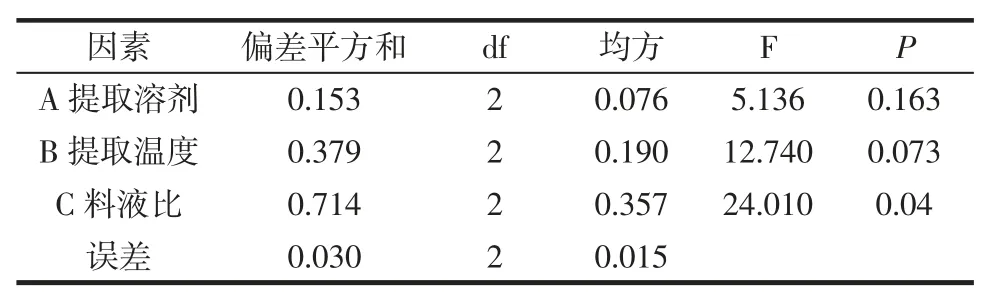
表3 方差分析结果Table 3 Variance analysis tables
方差分析表3 显示:料液比对黄酮提取率的影响存在统计学差异(P<0.05),而提取温度和提取溶剂对黄酮提取率的影响无统计学差异(0.05<P<0.1)。综合考虑黄酮的最佳提取工艺条件组合为A1B1C2D2,即乙醇浓度为 70%,提取温度 60 ℃,料液比为 1∶10(g/mL)和提取时间为30 min。
2.3 最佳工艺条件验证
根据所筛选的最佳工艺条件提取荞麦叶大百合3份,按照“1.2.1”项下方法测定总黄酮的提取率,试验结果见表4。
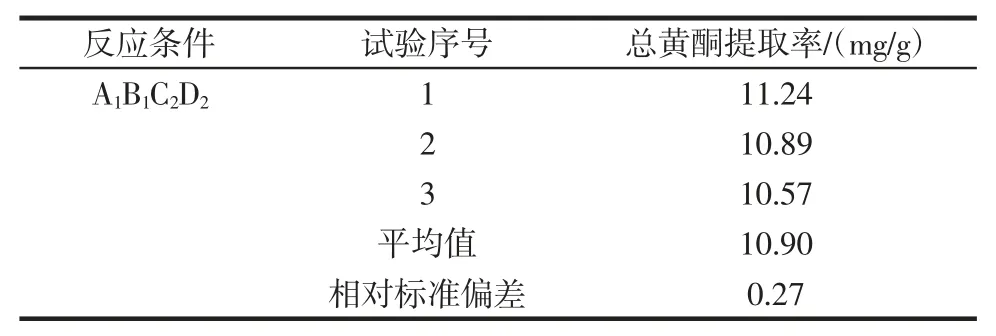
表4 验证试验结果Table 4 Verify the experimental results
结果表明:总黄酮提取率为10.90 mg/g,相对标准偏差为0.27%,总黄酮提取率较高,重现性较好,表明此提取工艺稳定合理。
2.4 DPPH自由基清除作用的测定
不同浓度的荞麦叶大百合的总黄酮溶液、对照品VC溶液对DPPH 自由基清除率结果见图6。
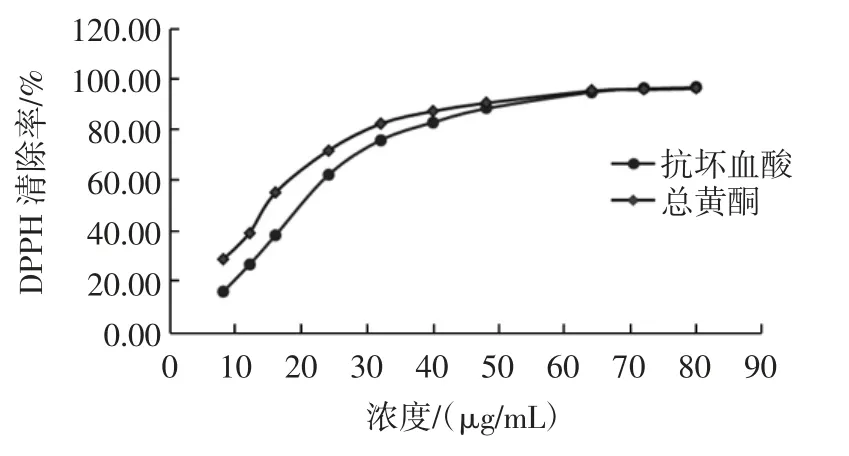
图5 不同浓度的荞麦叶大百合总黄酮和抗坏血酸对DPPH 自由基的清除率Fig.5 DPPH radicals scavenging activities of VCand total flavonoids
在浓度0~24 μg/mL 范围内其清除能力随总黄酮浓度的升高而加强,当浓度增加为32 μg/mL,清除率达到95.72%,此后其清除率基本趋于平衡。根据SPSS20.0软件数据分析,得到荞麦叶大百合总黄酮EC50为4.439 μg/mL 和 VC的 EC50为 18.746 μg/mL,可见,荞麦叶大百合总黄酮对DPPH 自由基清除率明显高于VC。
3 结论与讨论
目前,国内外对龙牙百合花、香水百合中总黄酮提取工艺及抗氧化性有研究[2-6],但荞麦叶大百合黄酮提取工艺及抗氧化性尚未出现报道,此外由于黄酮类化合物不溶于水,易溶于乙醇等有机溶剂,因此本试验初步采用乙醇回流法提取荞麦叶大百合中总黄酮,用醇溶液进行提取时,脂溶性物质如黄酮类可被大量溶出,因此以总黄酮提取率为指标确定最佳提取工艺,优化后得到的最佳提取工艺参数:乙醇体积分数为70 %,液料比为 1∶10(g/mL),回流提取时间为 30 min,提取温度为60 ℃,在此工艺条件下进行回流提取,得到荞麦叶大百合总黄酮的平均提取率为10.90 mg/g,此提取工艺重现性良好。此结果为进一步研究荞麦叶大百合总黄酮适合于工业化生产的最佳提取工艺打下良好基础。
体外抗氧化初步研究表明,荞麦叶大百合中总黄酮对于DPPH 自由基的清除能力显著优于抗氧化剂VC,具有较强的抗氧化活性,为其在食品、药品等领域开发天然抗氧化剂提供一定的理论依据。
