冬虫夏草对氧化损伤小鼠抗氧化作用研究
2019-07-10罗胜勇栗原博乐智勇于留荣曹晖
罗胜勇,栗原博,乐智勇,于留荣,曹晖
(1.暨南大学药学院,广东广州510632;2.安徽省医学科学研究院,安徽合肥230061;3.康美药业股份有限公司,广东揭阳522000;4.南方医科大学中医药学院,广东广州510515;5.暨南大学岭南中药研究中心,广东广州510632)
生物体在新陈代谢过程中,会不断产生各种活性氧自由基。正常生理情况下,适量的氧自由基对维持机体的健康具有重要作用[1],但当自由基生成过多时,则会出现氧化损伤[2],使得机体蛋白质、DNA 和脂类物质被破坏,正常细胞信号传导被干扰,进而导致诸如心脑血管疾病、炎症、抑郁症、肿瘤、衰老等多种疾病的发生[3-7]。因此,开发安全、有效的具有抗氧化作用的产品越来越受到医药研究者的重视。冬虫夏草(Cordyceps sinensis)为麦角菌科真菌寄生在虫草蝙蝠蛾(Hepialus armoricanus)幼虫上的子座及幼虫内菌核的复合体,是一种名贵的滋补性传统中药材,具有免疫调节、抗菌、抗病毒、抑制肿瘤、降血糖等多种药理作用[8-9]。关于其抗氧化能力以往研究也较多,但主要都集中在其体外抗氧化能力方面,而对于冬虫夏草体内抗氧化作用目前还缺少报道。因此,本实验按照我国《保健食品检验与评价技术规范》(国食药监保化[2012]107 号附件3)中抗氧化功能评价方法,对冬虫夏草体内抗氧能力进行全面深入研究,并初步探讨其作用机制,以期能为今后更加科学合理的虫草资源、开发抗氧化的产品提供科学依据。
1 材料和方法
1.1 材料与试剂
天然冬虫夏草(批号201607):康美(北京)药物研究院有限公司;D-半乳糖(批号20160406):国药集团化学试剂有限公司;丙二醛(malondialdehyde,MDA)测试盒(批号20170622)、超氧化物岐化酶(superoxide dismutase,SOD)测试盒(批号 20170626)、还原型谷胱甘肽(glutathione,GSH)测试盒(批号 20170627),蛋白质羰基测试盒(批号2-170908),谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)(批号 20170916)、总抗氧化能力(total antioxidant activity,T-AOC)测试盒(批号20170912):南京建成生物工程研究院。RNAiso Reagent(批号 AA4608-1)、反转录试剂盒(批号AK5306)、Taq DNA 聚 合 酶 、Easy Dilution 稀 释 液 :TaKaRa公司;引物由上海吉玛制药技术有限公司提供。
1.2 实验动物
1.3 仪器与设备
AL104 电子天平:梅特勒-托利多(上海)有限公司;UV-1750 紫外可见分光光度计:日本岛津公司;电热水浴锅:上海医疗器械五厂;GL-16G-Ⅱ型高速离心机:上海安亭科学仪器厂。
1.4 实验方法
1.4.1 小鼠氧化损伤模型建立(D-半乳糖诱导)
取健康成年雄性ICR 小鼠(SPF 级),适应性饲养后,选取体重25 g~30 g 的动物进行造模,造模动物颈背部皮下注射D-半乳糖120 mg/(kg·BW),空白组动物颈背部皮下注射等体积氯化钠注射液,注射量均为0.1 mL/10 g,每日1 次,连续注射6 周,内眦静脉取血测MDA,选取与空白组比较MDA 有明显升高的动物,随机分组[10]。
1.4.2 分组及给受试物
取造模成功动物随机分为模型组、阳性组[维生素E,100 mg/(kg·BW)]、冬虫夏草高[1 g/(kg·BW)]、中[0.5 g/(kg·BW)]、低[0.25 g/(kg·BW)]剂量组,每组10 只,分别灌胃给予相应受试样品,灌胃体积为0.2 mL/(10 g·BW),另取10 只正常动物作为空白组。空白组和模型对照组灌胃给予等体积蒸馏水,每天1次,连续30 d。在给受试样品的同时,模型对照组和受试样组颈背部皮下继续注射120 mg/(kg·BW)D-半乳糖,正常组动物颈背部皮下注射等体积氯化钠注射液,注射量均为0.1 mL/10 g。造模及给受试物期间,每周称1 次体重,依据体重调整给受试物的体积。
1.4.3 血清中 MDA、蛋白羰基、GSH 含量,SOD、GSHPx、T-AOC 活性测定
给各受试样品30 d 后,动物断头取血,3 000 r/min离心10 min 后,取血清,按试剂盒说明书测定血清中MDA、蛋白羰基、GSH 含量及 SOD、GSH-Px、T-AOC活性。
目前,依托南方电网大平台优化配置资源的作用,南方电网云南电网公司还将不断扩大西电东送规模,最大限度地消纳云南清洁水电。到2030年,云南省清洁能源总装机将达到1.3亿千瓦,最大电力外送能力将超过5000万千瓦,届时,云南将成为全国最重要的绿色能源基地和西电东送能源基地之一,电力行业将成为云南打造绿色能源牌的主力军和排头兵,云南清洁水电资源优势,也将进一步转化成为产业优势、经济优势和发展优势。
1.4.4 肝脏及脑组织中MDA 含量,SOD、GSH-Px 活性测定
迅速取肝脏和脑组织,称取部分肝组织和脑组织块,加入生理盐水,组织匀浆器制备成10%肝组织匀浆,3 000 r/min 离心10 min 后,取上清液按试剂盒说明书测定肝脏及脑组织中MDA 含量,SOD、GSH-Px 活性。
1.4.5 实时定量聚合酶链式反应(real time-polymerase chain reaction,RT-PCR)检测肝组织中SOD 和 GSHPx 基因表达量
随机取5 只动物剩余肝脏组织用无菌磷酸盐缓冲液清洗3 次后,加液氮研磨后,加入Trizol 后提取总RNA,紫外分光光度计检测RNA 的浓度及纯度,利用逆转录试剂盒合成cDNA 后,取2 μL 进行RT-PCR[11-12]检测,逆转录过程及RT-PCR 过程参照说明书进行。最终结果以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参,采用与荧光定量PCR 仪配套Step One Software v2.1 分析PCR数据。引物信息见表1。
1.5 数据统计
2 结果与分析
2.1 冬虫夏草对小鼠血清中MDA含量的影响
各组小鼠血清中MDA 含量见表2。
表2 各组小鼠血清中 MDA 含量(±s,n=10)Table 2 The MDA content in serum of each group mice(±s,n=10)
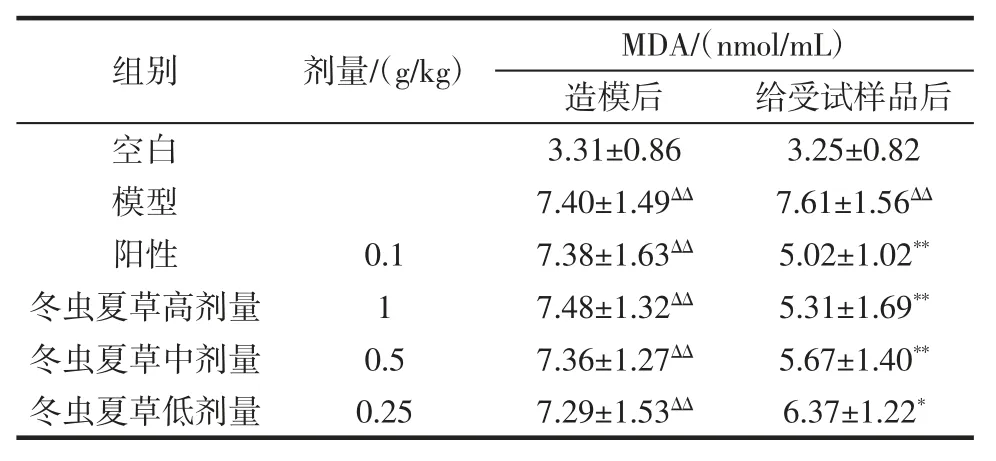
表2 各组小鼠血清中 MDA 含量(±s,n=10)Table 2 The MDA content in serum of each group mice(±s,n=10)
注:与空白组比较,ΔΔp<0.01 差异极显著;与模型组比较,*p<0.05差异显著,**p<0.01 差异极显著。
组别剂量/(g/kg)MDA/(nmol/mL)造模后 给受试样品后空白 3.31±0.86 3.25±0.82模型 7.40±1.49ΔΔ 7.61±1.56ΔΔ阳性 0.1 7.38±1.63ΔΔ 5.02±1.02**冬虫夏草高剂量 1 7.48±1.32ΔΔ 5.31±1.69**冬虫夏草中剂量 0.5 7.36±1.27ΔΔ 5.67±1.40**冬虫夏草低剂量 0.25 7.29±1.53ΔΔ 6.37±1.22*
通过对表2 数据进行方差分析,造模后,与空白组比较,各组MDA 含量明显升高,表明造模成功。给受试样品30 d 后,与模型组比较,冬虫夏草高、中、低剂量组MDA 含量均明显降低,差异有显著性(p<0.01,p<0.05)。表明冬虫夏草高、中、低剂量可明显降低血清中MDA 含量。
2.2 冬虫夏草对动物血清中蛋白质羰基、GSH含量及GSH-Px、SOD、T-AOC活性的影响
各组小鼠血清中蛋白质羰基、GSH 含量及GSHPx、SOD、T-AOC 活性见表3。
表3 各组小鼠血清中蛋白质羰基、GSH 含量及 GSH-Px、SOD、T-AOC 活性(±s,n=10)Table 3 The protein carbonyl,GSH contents and the GSH-Px,SOD,T-AOC activities in serum of each group mice(±s,n=10)

表3 各组小鼠血清中蛋白质羰基、GSH 含量及 GSH-Px、SOD、T-AOC 活性(±s,n=10)Table 3 The protein carbonyl,GSH contents and the GSH-Px,SOD,T-AOC activities in serum of each group mice(±s,n=10)
注:与空白组比较,ΔΔp<0.01 差异极显著;与模型组比较,*p<0.05 差异显著,**p<0.01 差异极显著。
组别剂量/(g/kg) 蛋白质羰基/(nmol/mg)GSH/(mg/L)GSH-Px/(U/mL)SOD/(U/mL)T-AOC/(U/mL)空白 2.83±0.36 8.14±2.33 117.56±23.15 231.11±26.96 24.67±6.47模型 4.16±0.44ΔΔ 3.90±1.13ΔΔ 56.46±15.91ΔΔ 182.65±9.96ΔΔ 4.67±2.04ΔΔ阳性 0.1 3.55±0.52** 6.83±1.32** 102.33±32.67** 223.52±20.83** 20.82±5.33**冬虫夏草高剂量 1 3.61±0.59* 5.69±1.68** 88.97±27.72** 215.63±20.62** 16.89±5.25**冬虫夏草中剂量 0.5 3.76±0.31* 5.37±1.84* 82.35±16.68** 214.10±18.91** 15.06±5.56**冬虫夏草低剂量 0.25 3.82±0.37 4.68±1.05 73.36±20.78* 200.32±15.23* 12.32±3.87**
通过对表3 数据进行方差分析,与空白组比较,模型组动物血清中蛋白质羰基含量明显升高,GSH 含量,GSH-Px、SOD、T-AOC 活性明显降低;与模型组比较,冬虫夏草高、中剂量组动物血清中蛋白质羰基含量明显降低,GSH 含量明显升高;高、中、低剂量动物血清中GSH-Px、SOD、T-AOC 活性明显升高,差异有显著性。表明冬虫夏草高、中剂量可明显降低血清中蛋白质羰基含量,升高GSH 含量;高、中、低剂量可明显升高动物血清中GSH-Px、SOD、T-AOC 活性。
2.3 冬虫夏草对动物肝脏中MDA含量,SOD、GSHPx活性的影响
各组动物肝脏组织中MDA 含量,GSH-Px、SOD活性见表4。
通过对表4 数据进行方差分析,与空白组比较,模型组动物肝脏中MDA 含量明显升高,GSH-Px、SOD活性明显降低;与模型组比较,冬虫夏草高、中、低剂量组动物肝脏中MDA 含量明显降低,GSH-Px、SOD 活性明显升高,差异有显著性。表明冬虫夏草高、中、低剂量均可明显降低动物肝脏MDA 含量,升高GSHPx、SOD 活性。
表4 各组动物肝脏组织中 MDA 含量,GSH-Px、SOD 活性(±s,n=10)Table 4 The MDA content and the GSH-Px,SOD activities in liver of each group mice(±s,n=10)
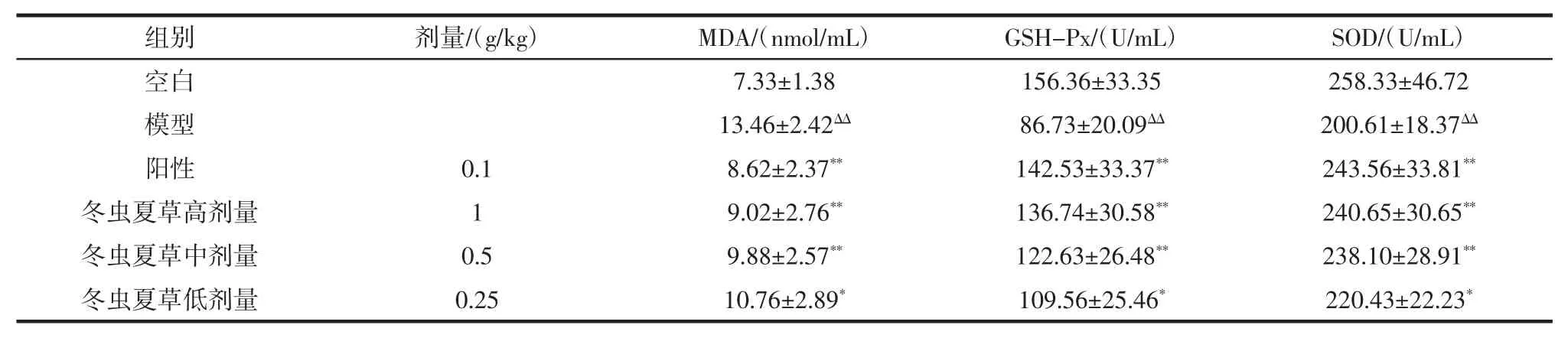
表4 各组动物肝脏组织中 MDA 含量,GSH-Px、SOD 活性(±s,n=10)Table 4 The MDA content and the GSH-Px,SOD activities in liver of each group mice(±s,n=10)
注:与空白组比较,ΔΔp<0.01 差异极显著;与模型组比较,*p<0.05 差异显著,**p<0.01 差异极显著。
组别剂量/(g/kg)MDA/(nmol/mL)GSH-Px/(U/mL)SOD/(U/mL)空白 7.33±1.38 156.36±33.35 258.33±46.72模型 13.46±2.42ΔΔ 86.73±20.09ΔΔ 200.61±18.37ΔΔ阳性 0.1 8.62±2.37** 142.53±33.37** 243.56±33.81**冬虫夏草高剂量 1 9.02±2.76** 136.74±30.58** 240.65±30.65**冬虫夏草中剂量 0.5 9.88±2.57** 122.63±26.48** 238.10±28.91**冬虫夏草低剂量 0.25 10.76±2.89* 109.56±25.46* 220.43±22.23*
2.4 冬虫夏草对动物脑组织中MDA含量,SOD、GSH-Px活性的影响
各组动物脑组织中 MDA 含量,GSH-Px、SOD 活性见表5。
表5 各组动物脑组织中 MDA 含量,GSH-Px、SOD活性(±s,n=10)Table 5 The MDA content and the GSH-Px,SOD activities in brain of each group mice(±s,n=10)
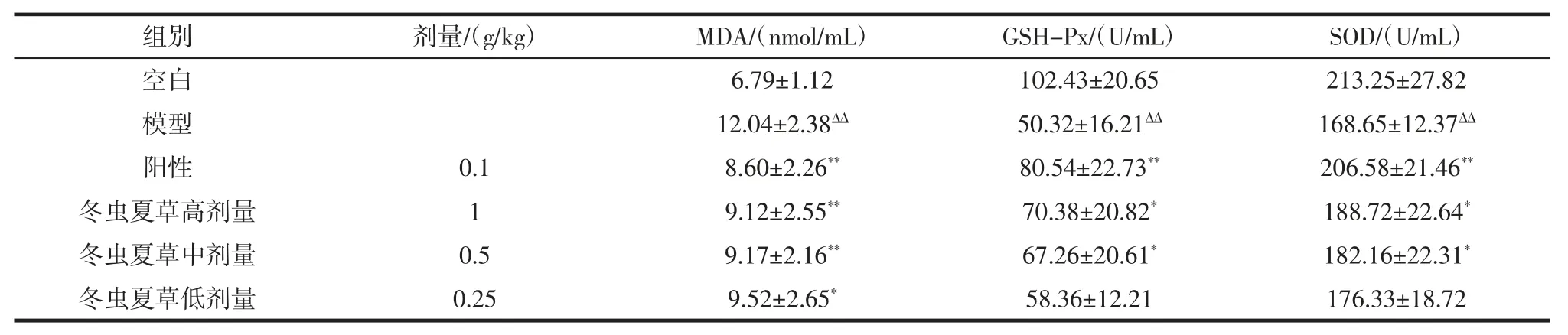
表5 各组动物脑组织中 MDA 含量,GSH-Px、SOD活性(±s,n=10)Table 5 The MDA content and the GSH-Px,SOD activities in brain of each group mice(±s,n=10)
注:与空白组比较,ΔΔp<0.01 差异极显著;与模型组比较,*p<0.05 差异显著,**p<0.01 差异极显著。
组别剂量/(g/kg)MDA/(nmol/mL)GSH-Px/(U/mL)SOD/(U/mL)空白 6.79±1.12 102.43±20.65 213.25±27.82模型 12.04±2.38ΔΔ 50.32±16.21ΔΔ 168.65±12.37ΔΔ阳性 0.1 8.60±2.26** 80.54±22.73** 206.58±21.46**冬虫夏草高剂量 1 9.12±2.55** 70.38±20.82* 188.72±22.64*冬虫夏草中剂量 0.5 9.17±2.16** 67.26±20.61* 182.16±22.31*冬虫夏草低剂量 0.25 9.52±2.65* 58.36±12.21 176.33±18.72
通过对表5 数据进行方差分析,与空白组比较,模型组动物脑组织中MDA 含量明显升高,GSH-Px、SOD活性明显降低;与模型组比较,冬虫夏草高、中、低剂量组动物脑组织中MDA 含量明显降低,高、中剂量组动物脑组织中GSH-Px、SOD 活性明显升高,差异有显著性。表明冬虫夏草高、中、低剂量可明显降低动物脑组织中MDA 含量,高、中剂量可明显升高GSH-Px、SOD活性。
2.5 冬虫夏草对动物肝脏组织中SOD、GSH-Px mRNA表达的影响
各组动物肝脏组织中SOD、GSH-Px mRNA 表达水平见图1、图2。通过对图1、图2 数据进行方差分析,与空白组比较,模型组动物肝组织中SOD、GSH-Px mRNA 表达水平明显降低;与模型组比较,冬虫夏草高、中剂量组动物肝组织中SOD、GSH-Px mRNA 表达水平明显升高,差异有显著性。表明冬虫夏草高、中剂量可明显升高动物肝组织中SOD、GSH-Px mRNA 表达水平。
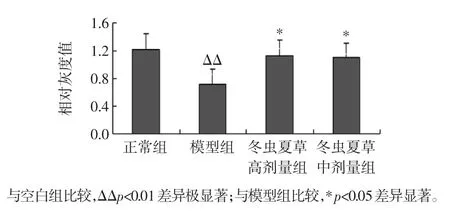
图1 各组小鼠肝脏组织中SOD mRNA 表达Fig.1 The SOD mRNA expression in liver of each group mice
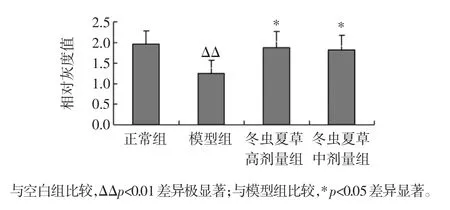
图2 各组小鼠肝脏组织中GSH-Px mRNA 表达Fig.2 The GSH-Px mRNA expression in liver of each group mice
3 结论与讨论
D-半乳糖氧化损伤模型,是研究抗氧化药物的经典模型[13],并作为研究抗氧化功能保健食品指定的造模方法。连续大剂量皮下注射D-半乳糖后,在小鼠机体细胞内由醛糖还原酶催化,还原生成半乳糖醇,半乳糖醇不能被细胞进一步代谢,在细胞内大量堆积,影响正常渗透压,导致细胞肿胀和功能障碍[14-15],最终会引起机体代谢紊乱、抗氧化物质活性下降、自由基堆积,从而产生氧化损伤效应。本实验通过皮下注射D-半乳糖构建小鼠氧化损伤模型,研究冬虫夏草的体内抗氧化活性。与空白组相比,模型组小鼠血清、肝脏和脑组织中的MDA 含量明显升高,GSH 含量明显降低,SOD、GSH-Px、T-AOC 活力明显下降。表明氧化损伤小鼠模型构建成功。
MDA 是细胞膜脂质过氧化的终产物之一,其含量可反映机体内脂质过氧化程度,蛋白羰基是多种氨基酸在蛋白质的氧化修饰过程中的早期标志,可直接反映蛋白质的损伤程度[16];GSH 是一种低分子清除剂,可清除O2-自由基、H2O2、LOOH,其含量多少是衡量机体抗氧化能力大小的重要因素。SOD 主要催化O2-自由基生成H2O2,再由其他抗氧化酶如GSH-Px 和过氧化氢酶作用生成水,其酶活性高低反应机体清除自由基能力[17];GSH-Px 是体内存在的一种含硒清除自由基和抑制自由基反应的系统,对防止体内自由基引起膜脂质过氧化至关重要,SOD 和GSH-Px 两者之间明显存在着相互保护作用和协同抗氧化作用[18]。总抗氧化能力(T-AOC)代表机体抗氧化酶系统和非酶系统对外来刺激的代偿能力以及机体自由基的代谢状态,是反应机体抗氧化能力的良好指标,可从整体上反映机体的抗氧化能力[19]。因此,通过检测体内MDA、蛋白质羰基、GSH 含量以及 SOD、GSH-Px、T-AOC 活性可全面了解体内自由基的产生和清除情况。本研究结果显示,与模型组比较,冬虫夏草能明显降低动物血清中MDA 蛋白质羰基含量,升高GSH 含量,明显升高动物血清中GSH-Px、SOD、T-AOC 活性,对于肝脏和脑组织,冬虫夏草也均能明显降低其中的MDA 含量,升高GSH-Px、SOD 活性,表明冬虫夏草具有明显的体内抗氧化能力。进一步研究发现,冬虫夏草能明显促进小鼠肝脏中SOD、GSH-Px mRNA 的表达水平,这与对应的抗氧化酶活力增强结果相一致。
综上所述,冬虫夏草对氧化损伤小鼠体内抗氧化能力有明显增强作用,其机制可能与摄入冬虫夏草后,体内的相关抗氧化酶基因mRNA 表达上调,使得SOD、GSH-Px 抗氧化酶活力增强,机体获得较高清除自由基的能力,从而降低体内脂质和蛋白质过氧化损伤有关。
