酶解制备褐藻寡糖工艺优化及活性研究
2019-07-10陈淑琼李晓月吴晨烁严芬
陈淑琼,李晓月,吴晨烁,严芬
(福州大学生物科学与工程学院,福建福州350108)
褐藻胶是β-D 甘露糖醛酸和其C-5 差向异构体α-L 甘露糖醛酸通过1,4-糖苷键连接而成的[1]。主要从海带、马尾藻等褐藻植物的细胞壁中提取的一种酸性直链多糖,但因其凝胶性强、黏度大、水溶性较低,导致应用有一定的局限性[2]。
褐藻寡糖是褐藻胶的寡聚物,是一种具有较强的溶解性、易吸收、安全无毒的化合物,研究表明其具有抗氧化活性[3]、抑菌活性[4]、促进植物生长[5]、治疗人类疾病[6]等作用。目前主要以化学法和酶解法制备褐藻寡糖,但化学法存在反应条件难控制、产物难分离、残留物质难清除的问题,使得其应用具有很大的局限性。酶解法因其具有较强的特异性、提取效率较高、反应条件较温和、降解过程比较容易控制等优点将逐渐成为制备褐藻寡糖的主要方法[7]。
本研究采用茶文化与健康研究所筛选获得的海洋来源黄杆菌B2 发酵产褐藻胶裂解酶,再以所得褐藻胶裂解酶酶解褐藻酸钠。在单因素试验的基础上,以体系中还原糖的生成量为响应值,利用响应面分析法对褐藻胶裂解酶酶解工艺进行优化,以期提高还原糖的生成量,并研究酶解制备的褐藻寡糖的ABTS+自由基清除能力、抑菌能力和对对虾的多酚氧化酶活性的影响,为褐藻寡糖的进一步研究提供理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
黄杆菌 (Flavobacterium)B2、假单胞菌(Pseudomonas)、希瓦氏菌(Shewanella):由茶文化与健康研究所实验室筛选并保藏;南美白对虾(Penaeus vannamei)由福清市谊华水产食品有限公司提供,并于当天保活运回实验室。
1.1.2 试剂
三氯乙酸、磷酸二氢钾、氯化钠、磷酸二氢钠、十二水磷酸氢二钠、3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)和植酸(70%)、苯酚、硫酸(均为分析纯):国药集团化学试剂有限公司;蛋白胨、酵母粉:英国OXOID 公司;海藻酸钠(食品级):Aladdin 公司。
1.2 仪器与设备
ZQZY-70BS 型气浴式恒温摇床:上海知楚仪器公司;JJ500 型电子天平:常熟市双杰测试仪器厂;TCL-20000cR 型高速冷冻离心机:上海安亭科学仪器厂;STARTER 2100 型pH 计:奥豪斯仪器有限公司;YXQLS 型立式压力蒸汽灭菌锅:上海博讯实业设备厂;SYNERGY-H1 型酶标仪:BioTek 公司。
1.3 试验方法
1.3.1 培养基的配制
2216E 培养基:蛋白胨5.0 g,酵母粉1.0 g,三氯化铁0.01 g,用人工海水溶解并定容至1 000 mL,121 ℃灭菌20 min。
发酵培养基:海藻酸钠5.0 g,蛋白胨2.0 g,磷酸二氢钾1.0 g,pH 7.2,人工海水溶解并定容至1 000 mL,121 ℃ 灭菌 20 min。
1.3.2 制备褐藻胶裂解酶粗酶液并测定酶活
挑取单菌落的黄杆菌B2 接种于液体培养基2216E 中,震荡培养 16 h(30 ℃、180 r/min),再以转接的培养基体积的3 %接种量转接于发酵培养基中,培养 36 h(30 ℃、180 r/min),离心(4 ℃、10 000 r/min)10 min,收集上清液。上清液在4 ℃条件下加硫酸铵至60 %饱和度,4 ℃静置过夜,离心(4 ℃、11 000 r/min)10 min,收集沉淀,用磷酸盐缓冲液(pH 8.0、20 mmol/L)溶解并透析。透析后的样品即粗酶液,采用3,5-二硝基水杨酸(DNS)法[8]测定酶活后于4 ℃贮藏备用。
1.3.3 单因素试验
1)称取一定质量的褐藻酸钠溶于磷酸盐缓冲液(pH 8.0、20 mmol/L)中,配制成 2 g/L 的褐藻酸钠溶液,从中取100mL溶液,加入20mL的粗酶液(酶活为21 U/mL)在 40 ℃下反应 18 h,每 2 h 取 10mL酶解液,立即沸水浴10 min 终止反应,测定还原糖生成量并计算褐藻酸钠的转化率,以加入20mL灭活酶液作空白对照。
2)在反应温度 40 ℃、pH 8.0 条件下,研究不同底物浓度(2、4、6、8、10、12 g/L)在褐藻酸钠水解过程中对还原糖生成量及褐藻酸钠的转化率的影响。
3)在底物浓度8 g/L、反应温度40 ℃条件下,研究不同酶解液 pH(5.0、6.0、7.0、8.0、9.0)在褐藻酸钠水解过程中对还原糖生成量及褐藻酸钠的转化率的影响。
4)在底物浓度 8 g/L、pH 8.0 的条件下,研究不同温度(20、30、40、50、60 ℃)在褐藻酸钠水解过程中对还原糖生成量及褐藻酸钠的转化率的影响。
1.3.4 响应面试验设计
在单因素试验的基础上,确定中心组合试验设计的自变量及水平。根据中心试验设计(central composite design,CCD)原理,以还原糖生成量为指标,选取温度、pH 值两个因素,设计两因素五水平响应面分析试验,用响应面分析法对数据进行回归分析,来确定最佳工艺参数。试验因素与水平设计见表1。

表1 CCD 试验设计因子及水平表Table 1 Factors and level of response surface central composite design
1.3.5 还原糖生成量测定
采用3,5-二硝基水杨酸(DNS)法测定还原糖生成量[8]。
1.3.6 转化率测定
采用苯酚-硫酸法测定体系中的总糖浓度[9],还原糖含量与总糖含量的比值,即为体系的转化率。
1.3.7 ABTS+自由基清除活力
参照Wang 等[10]的方法进行测定。蒸馏水作为空白组,维生素C 作为阳性对照,计算ABTS+自由基清除活力。
1.3.8 不同浓度的褐藻寡糖的抑菌指数
在预试验的基础上,选取褐藻寡糖的浓度梯度:4、6、8、10、12 g/L,以对对虾腐败菌假单胞菌和希瓦氏菌按体积比1∶1 混合的菌液的抑菌指数为考察指标。按混合菌液体积的3%的比例将褐藻寡糖加入混合菌液后震荡培养8 h,在600 nm 处测定吸光值,计算抑菌指数,确定各成分的最佳浓度。同时,设置无菌水为空白对照组,平行测定4 次。抑菌指数公式为:

式中:Acontrol表示空白组吸光值;Asample表示样品组吸光值。
1.3.9 对虾的多酚氧化酶(polyphenol oxidase,PPO)活性测定
将购买的对虾,保活运回实验室,加碎冰使其猝死,清洗干净后,剔除肢体残缺、颜色异常的个体;挑选大小一致的对虾随机放入预冷的蒸馏水中,避光浸泡1 h。沥干后随机分组放入自封袋中,放置(4±1)℃条件下贮藏。取20 只虾头,用液氮研磨至粉末,50 mmol/L pH 6.8 的磷酸盐溶液溶解,4 ℃离心30 min 得到的上清液即为PPO 粗酶液。测定酶活之前,预先在1mL酶液中分别加入100 μL 的褐藻寡糖、植酸(蒸馏水为空白对照)35 ℃孵育30 min,再于470 nm 处测定吸光值。多酚氧化酶的酶活测定参照González 等[11]的方法。
1.3.10 数据分析
采用SPSS 17.0 及Origin 8.5 进行数据分析。
2 结果与分析
2.1 酶解条件单因素优化
2.1.1 酶解时间对降解效果的影响
酶解时间对褐藻酸钠水解效果的影响见图1。
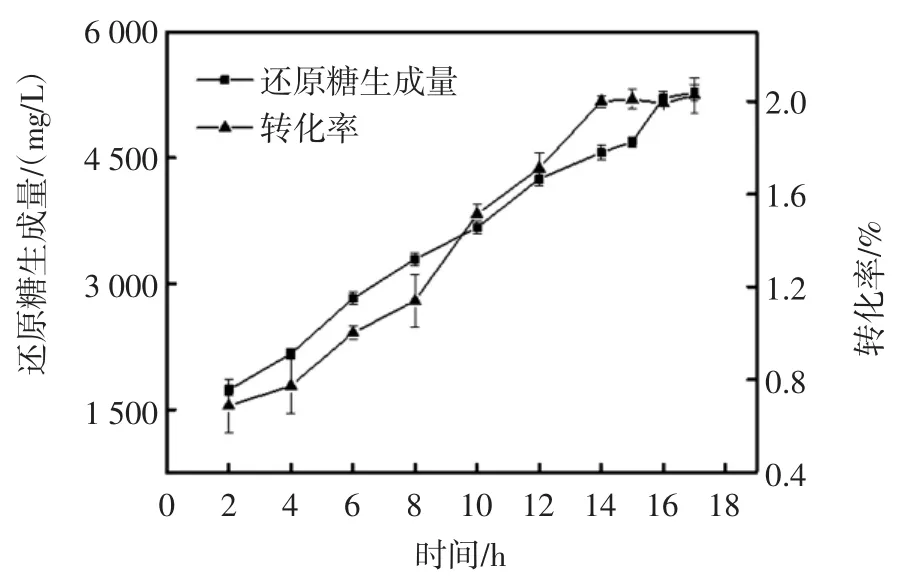
图1 酶解时间对褐藻酸钠水解效果的影响Fig.1 Effect of hydrolysis time on sodium alginate hydrolysis
酶解时间影响酶解产物的得率,酶解时间太短,酶解反应就不够充分,当酶解反应已达到平衡时,增加酶解时间也不能明显提高酶解产物的生成量和转化率。由图1 可知,酶解过程中,随着时间的推移,酶解反应还原糖生成量及褐藻酸钠的转化率也随之升高,酶解16 h 后,还原糖生成量及转化率趋于平稳,表明酶解16 h 时褐藻酸钠基本已经酶解为寡糖,继续进行酶解还原糖生成量和转化率也不会增加太多,因此选择16 h 为褐藻胶裂解酶酶解褐藻酸钠制备褐藻寡糖的最佳酶解时间。
2.1.2 底物浓度对降解效果的影响
底物浓度对褐藻酸钠水解效果的影响见图2。
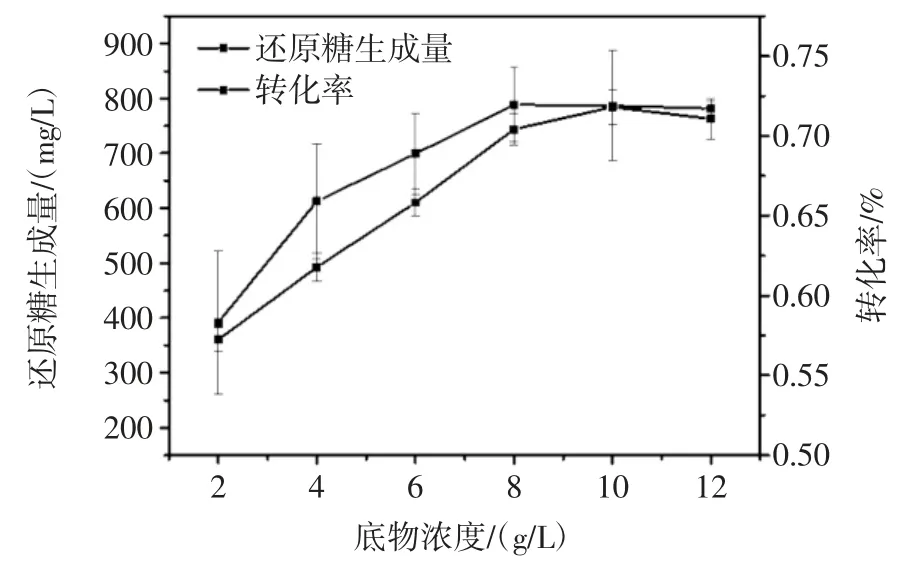
图2 底物浓度对褐藻酸钠水解效果的影响Fig.2 Effect of substrate concentration on sodium alginate hydrolysis
随着底物浓度逐渐增大,还原糖生成量也不断增加。当底物浓度增至8 g/L 时,褐藻酸钠转化率达到最大值,而后还原糖生成量和转化率基本稳定。这是因为褐藻酸钠的水溶液具有高黏度特性,且溶液黏度呈几何级数上升,在较高的底物浓度下,酶量明显不足,不利于酶与底物的充分接触[12],减弱了酶解底物的速度,使还原糖的生成量和转化率变低,因此选择褐藻酸钠浓度为8 g/L 为最佳底物浓度。
2.1.3 温度对降解效果的影响
温度对褐藻酸钠水解效果的影响见图3。
温度能够影响酶的活性,在酶解反应中起很重要的作用。一定温度范围内,酶活力随着温度的升高而升高,当达到酶的最适温度时,此时酶的酶活力达到最大,酶解效果最好;当温度逐渐升高超过了最适温度时,酶蛋白质会因为过高的温度而变性失活,酶活力的降低,影响了酶解反应的进程。如图3 所示,还原糖生成量及褐藻酸钠转化率随着温度的升高而升高,并在反应温度30 ℃时达到最大值;而当温度大于30 ℃,二者随温度的升高而降低。结果表明,褐藻胶裂解酶在30 ℃时酶活力最大,降解海藻酸钠效果最好,故褐藻胶裂解酶酶解褐藻酸钠制备褐藻寡糖的最佳反应温度应选择30 ℃。
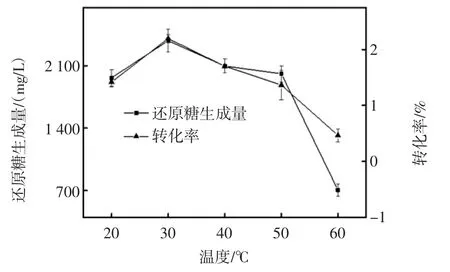
图3 温度对褐藻酸钠水解效果的影响Fig.3 Effect of hydrolysis temperatures on sodium alginate hydrolysis
2.1.4 pH 值对降解效果的影响
pH 值对褐藻酸钠水解效果的影响见图4。
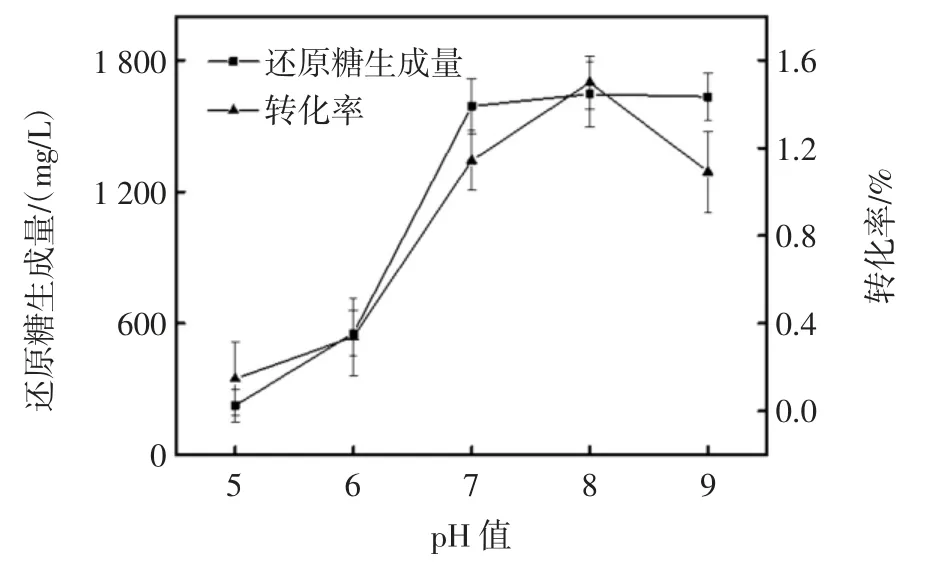
图4 pH 值对褐藻酸钠水解效果的影响Fig.4 Effect of pH value on sodium alginate hydrolysis
图4 表明褐藻胶裂解酶对pH 值变化敏感,当pH值为8.0 时,还原糖生成量及褐藻酸钠转化率达到最大值,当体系pH 值偏离最适pH 值时,二者都会出现不同程度地减小。这与酶自身的性质和结构有关,即酶在一定的pH 值范围内表现出最大活力,当酶处于最适pH 值时,其酶活力最大,酶解速度最快,酶解效果最好,偏离最适pH 值时,酶的活性中心构像会产生一定的变化,甚至于改变了整个酶分子的结构,从而使酶变性失活[13],酶活力的下降,影响了酶解反应的进程,减弱了酶解速度,还原糖生成量及转化率也大大下降,故最佳反应pH 值应为8.0。
2.2 响应面优化
经统计学分析得到,还原糖生成量或转化率具有显著差异的是pH 值和温度。由于温度和pH 值是褐藻胶裂解酶酶的特定属性,酶活力对温度和pH 值较为敏感,当温度和pH 值改变时,可能会导致酶失活,因此选择这两个因素进行响应面分析。优化试验设计采用响应面法(RSM),所用软件为Design-Expert 8.0.6,实施模型为中心组合设计。响应面CCD 设计及结果见表2。
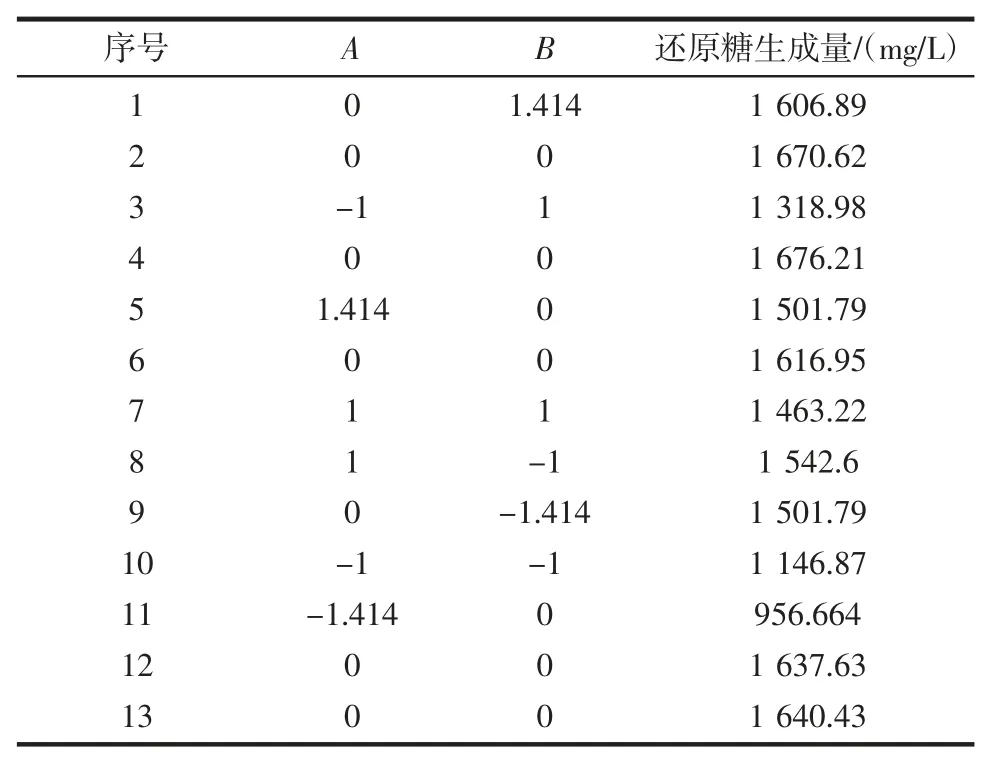
表2 响应面试验设计与结果Table 2 Response surface design and corresponding results
利用软件进行回归分析,得到响应值Y 还原糖生成量的多项式回归模型为:Y=1 648.37+163.86A+30.17B-62.87AB-215.54A2-52.98B2,对结果进行方差分析,结果见表3。
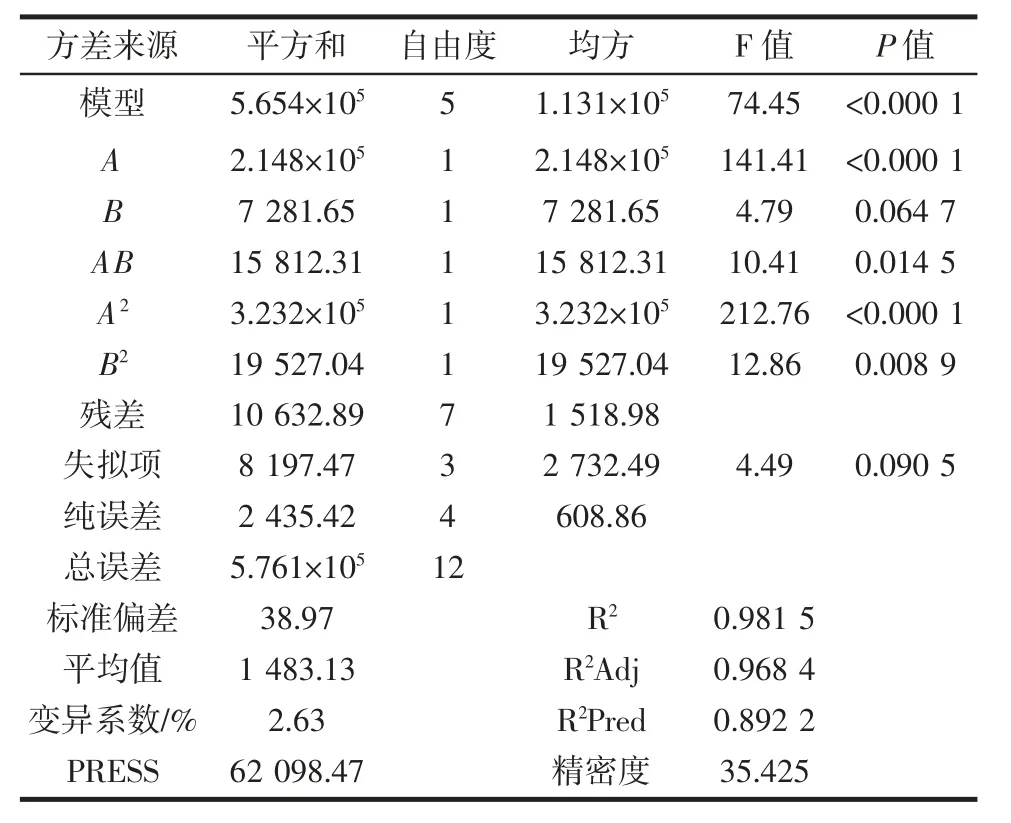
表3 中心组合试验方差分析结果Table 3 Results of analysis of variance(ANOVA)of central composite design
回归方程方差分析显示,模型的P<0.000 1 说明该模型显著,失拟项P=0.090 5>0.05,表明失拟不显著,模型没有失拟现象,说明该模型的选择是合理可行的。决定系数R2=0.981 5,说明实测值和预测值拟合度良好;校正决定系数R2Adj=0.968 4,表明仅有总变异的不到4%不能由该模型解释;本试验变异系数=2.63%,说明试验结果可靠。精密度为35.425 大于4,说明该模型可以对试验结果进行拟合。
响应面各试验点预测值和真实值线性关系见图5。
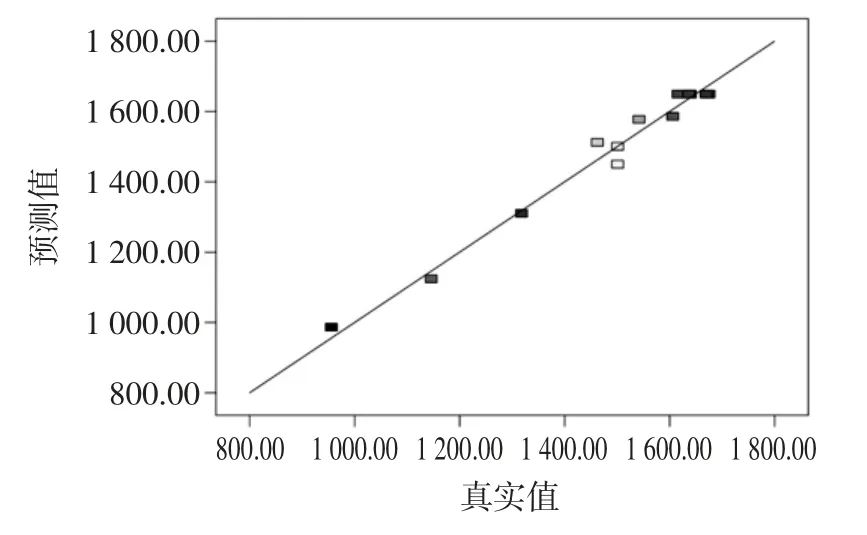
图5 响应面各试验点预测值和真实值线性关系图Fig.5 Linear correlation plot between predicted and actual values of tannasecontent of response surface model
如图5 所示,软件拟合的响应面各试验点预测值和真实值拟合程度良好。该拟合方程为褐藻胶裂解酶水解制备褐藻寡糖提供了一个合适的模型,可用此模型代替真实试验点对酶解反应进行分析和预测。
根据上述拟合的回归方程,利用Design-Expert 8.0.6 软件绘制出的三维响应面及与之对应的等高线图见图6。
图6 的温度和体系pH 值对还原糖生成量的影响的响应面及等高线图能比较直观地解释各变量之间对响应值的影响。等高线的形状可以反映因素间交互作用的强弱。图6 显示了温度和体系pH 值对还原糖生成量的影响。当温度不变时,还原糖生成量会随体系pH 值的增大出现先增大后降低的趋势;当体系pH值不变时,还原糖生成量同样会出现先增大再降低的趋势。因此预测该试验存在一个最大值,通过Design-Expert 8.0.6 软件预测还原糖生成量的最大值为1 680 mg/L,最佳试验条件是体系pH 值为8.37,温度为30.65 ℃。
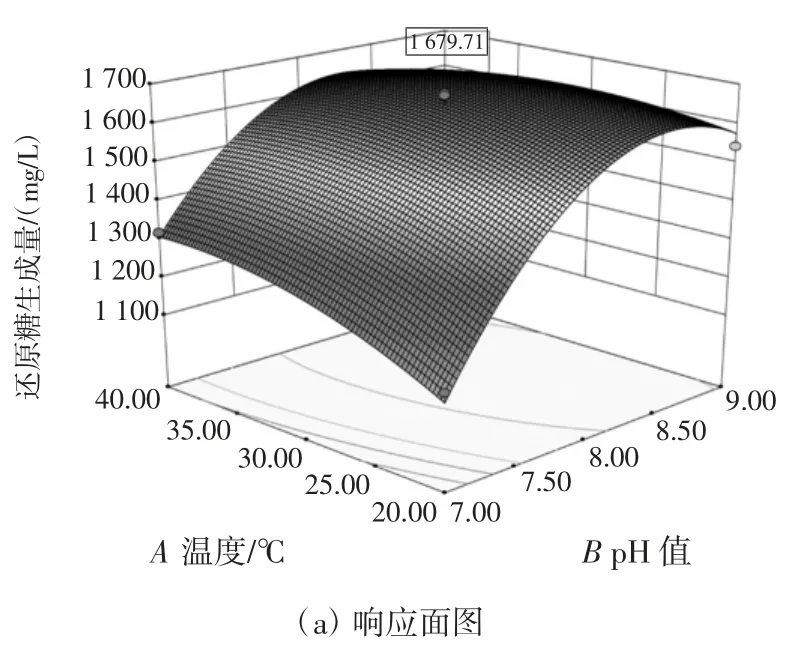
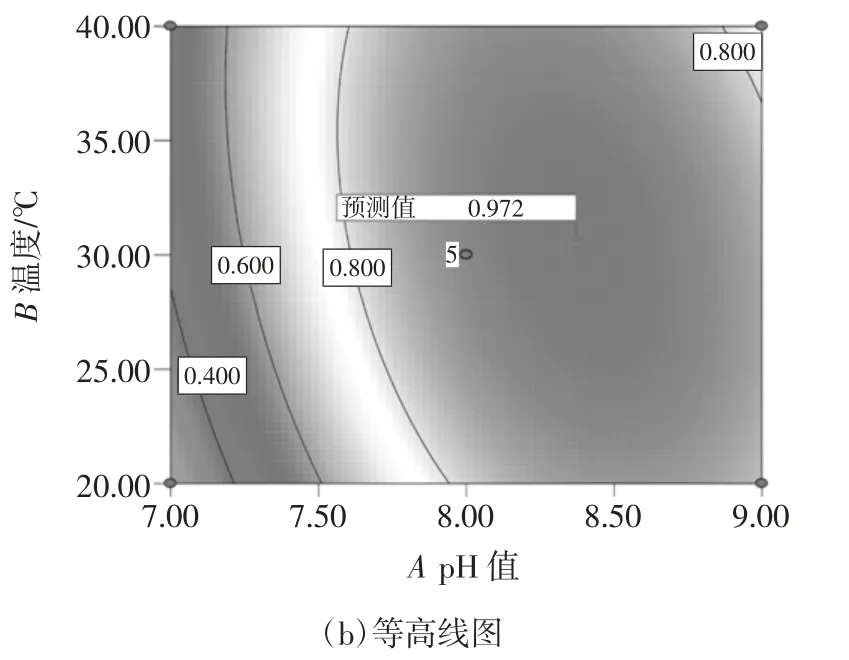
图6 体系pH 值和温度对还原糖生成量影响的响应面及等高线图Fig.6 Response surface curves and contour plots of interaction effect between enzyme dosage and pH value
2.3 验证试验
根据以上最佳工艺条件,取实际可控的条件:体系pH 8.4、酶解温度30 ℃、底物质量浓度8 g/L,该条件下酶解制备褐藻寡糖,经测定,其还原糖生成量为1 660 mg/L。略低于响应面试验的预测值,但误差仅在1.20%之间,证明了响应面所得的模型及最佳条件的可靠性。
2.4 褐藻寡糖对ABTS+自由基的清除能力
ABTS 在适当的氧化剂如过硫酸钾氧化作用下会形成蓝绿色的单阳离子自由基(ABTS+自由基),当抗氧化剂存在时,ABTS+自由基的产生将受到抑制。表4可以看出,褐藻寡糖表现出良好的清除活性,清除能力随着浓度的升高而增强。且当浓度增至5.0 g/L 时,达到与维生素C 同等的清除效果。对虾腐败的原因之一是由于氧气的作用,结果表明酶解得到的褐藻寡糖有较强的抗氧化能力,因此褐藻寡糖可以减少氧化作用延长对虾的货架期。

表4 褐藻寡糖对ABTS+自由基清除活性Table 4 Scavenging effect of alginate oligosaccharides on ABTS+
2.5 不同浓度的褐藻寡糖的抑菌指数
不同浓度的褐藻寡糖的抑菌指数见图7。
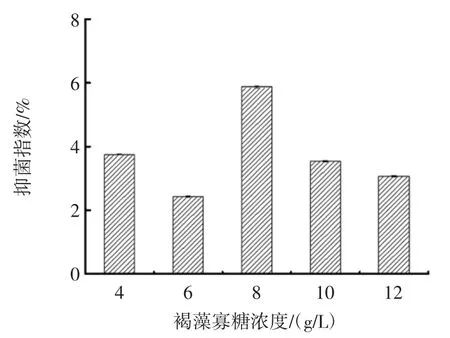
图7 不同浓度褐藻寡糖的抑菌指数Fig.7 Different concentrations of alginate oligosaccharide antibacterial index
从图7 可知,当褐藻寡糖浓度达到8 g/L 时,对对虾的腐败菌的抑菌指数达到了最大;随着褐藻寡糖浓度的增加,抑菌指数变低的原因可能是由于褐藻胶裂解酶的降解能力具有一定的限度,对底物海藻酸钠降解不完全,而海藻酸钠可以作为碳源促进对虾腐败菌的生长,削弱了褐藻寡糖的抑菌效果。综合以上分析,选择褐藻寡糖浓度为8 g/L 时对对虾的腐败菌希瓦氏菌和假单胞菌的抑菌能力最大,抑菌效果最好。
2.6 褐藻寡糖对对虾虾头PPO活性影响
各物质对对虾虾头PPO 活性的影响见图8。
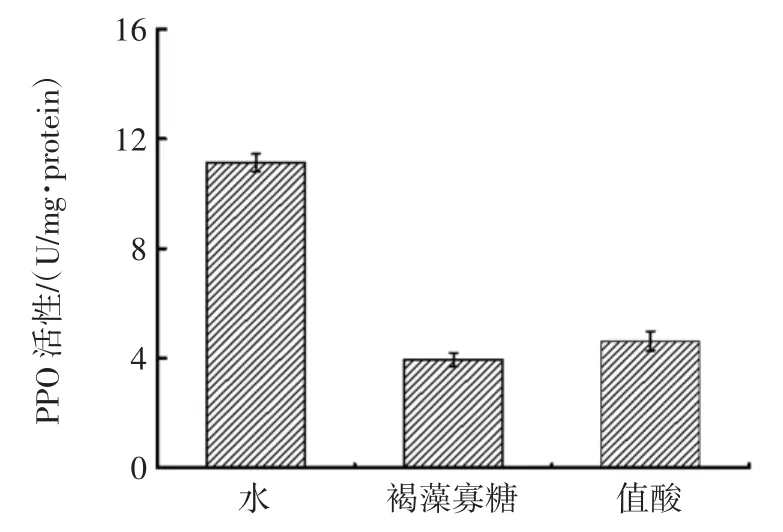
图8 各物质对对虾虾头PPO 活性的影响Fig.8 Effect of different material on PPO activity
由图8 可知,向PPO 粗酶液中添加褐藻寡糖、植酸后PPO 活性显著低于对照组,表明这2 种物质可以有效抑制多酚氧化酶活性。由于PPO 可以诱导虾体内的无色一元酚与氧气接触,逐步氧化成有色醌类物质,造成褐变,因此保鲜剂中含有褐藻寡糖或植酸这两种物质可以减轻对虾的褐变反应,提高感官评价分值。
3 结论
本试验利用单因素与响应面相结合的方法对褐藻胶裂解酶酶解褐藻酸钠的工艺条件进行优化,最佳的酶解条件为:体系pH 8.4、酶解温度30 ℃、底物质量浓度8 g/L,该条件下还原糖生成量达到1 660 mg/L,比优化前提高了64.9%。当褐藻寡糖浓度达到5.0 g/L时,可达到与维生素C 同等的ABTS+自由基清除效果,表明褐藻寡糖具有较强的抗氧化作用,当褐藻寡糖浓度达到8 g/L 时,对对虾的腐败菌希瓦氏菌和假单胞菌的抑菌指数达到了最大,表明褐藻寡糖对对虾的腐败菌生长具有一定的抑制作用,将其作用于虾头中提取的多酚氧化酶发现能有效的抑制多酚氧化酶的活性,为酶解褐藻酸钠制备的褐藻寡糖的开发和对对虾的贮藏保鲜研究提供了理论依据。
