人参皂苷Rg1对LRRK2突变致帕金森病果蝇的治疗作用探讨
2019-07-10赵文学赵雨王伟楠郑丽娜刘美辰
赵文学,赵雨,王伟楠,郑丽娜,刘美辰
(长春中医药大学吉林省人参科学研究院,吉林长春130117)
帕金森病(parkinson's disease,PD)是常见晚发型神经退行性疾病,是进行性发展的致死性复杂疾病。PD 的发病诱因大多为散发性,只有约5%~10%的人群为家族遗传性[1]。虽然只有少数人群的发病诱因为家族遗传性,但描述这些致病基因的致病机理,为深入了解PD 的发病机制及药物靶点的发现提供了新的研究思路。
LRRK2 是较为常见的常染色体显性遗传PD 相关基因,LRRK2 突变是构成家族性和散发性PD 的最常见已知原因[2-4]。LRRK2 基因在受黑质(substantia nigra,SN)影响的多巴胺神经元中呈现极低的表达量,而在接受黑质多巴胺(dopamine,DA)输入的纹状体神经元中则出现更高的表达[5-6]。LRRK2 是一种具有激酶和GTP 酶结构域的大型多域蛋白,其激酶功能域与MAPK 蛋白激酶功能相近,其活性的升高是较为公认的PD 致病机制之一,更是临床PD 治疗药物开发的主要设计靶点[7]。已有研究表明,MAPK 传导途径中有3种蛋白与PD 的发生发展相关,分别为ERK、P38 MAPK 以及 JNK[8]。LRRK2 能够激活 P38 MAPK 进而调控JNK 信号传递途径,引起细胞凋亡[9]。此外,氧化应激所产生的活性氧(reactive oxygen species,ROS)亦是引起凋亡的另一个关键因素。但当ROS 产生量上升时,机体可诱导产生保护性蛋白,进而起到保护细胞免受凋亡的作用。其中的Keap1/Nrf2/ARE 信号传递途径是机体抗氧化机制中最为重要的信号传递途径[10]。当机体发生氧化应激反应时,Nrf2(NF-E2-related factor 2)与 Keap1(Kelch-like ECH-associated protein-1)亲和能力降低,呈现游离状态转入细胞核内,与ARE结合,启动GCLC 等关键抗氧化蛋白的转录表达,诱导细胞自身抗氧化能力增强,维护内环境稳态,保护细胞免受氧化应激的损伤[11]。
人参皂苷是人参中的主要活性成分,人参皂苷Rg1 对于PD 模型的作用效应已取得了比较多的研究进展。人参皂苷 Rg1 对于 1-甲基-4-苯基-1,2,3,6-四氢吡啶(1-methyl-4-phenyl-1,2,3,6-terahydropyridine,MPTP)及鱼藤酮等神经毒性物质诱导的神经元细胞凋亡具有显著保护作用,其作用途径可能是通过降低活性氧(reactive oxygen species,ROS)水平以及线粒体细胞色素C 向细胞质的释放,进而抑制caspase-3活力,减少凋亡实现的[12]。同时,人参皂苷Rg1 在磷酸化胞外调节激酶1/2(phospho extracellular regulated protein kinases,P-ERK1/2)信号通路依赖的神经保护作用中亦发挥了协同作用[13-15]。人参皂苷Rg1 预处理,可见磷酸化P-38,COX-2 和PGE2 阳性细胞显著减少,并且改善了TH(+)神经元的显著减少现象,这意味着Rg1 可能通过作用于P-38 信号通路以保护PD中的多巴胺能神经元[16]。以上研究结果证明了人参皂苷Rg1 对于PD 的潜在治疗效应。因此,本实验选用LRRK2 突变转基因果蝇品系,于体内整体水平验证人参皂苷Rg1 对于果蝇PD 模型的保护作用,验证其对LRRK2 激酶活性的抑制作用效应,并通过进一步的实验验证其作用途径。
1 材料与方法
1.1 材料与试剂
人参皂苷Rg1:长春中医药大学生物工程实验室;辣根过氧化物酶(horseradish peroxidase,HRP)标记羊抗鼠二抗Ig G、HRP 标记羊抗兔二抗Ig G:英国英杰生命技术有限公司;抗体P-LRRK2、P-P38MAPK、ERK、P-ERK:艾博抗(上海)贸易有限公司;抗体兔抗Nrf2多抗、兔抗谷氨酰半胱氨酸合成酶(glutamate-cysteine ligase catalytic,GCLC)多抗:上海斯信生物科技有限公司;抗体Flag:上海欣百诺生物科技有限公司;37%多聚甲醛、TritonX-100:美国西格玛奥德里奇公司;二氢乙啶:威格拉斯生物技术(北京)有限公司;动物非免疫血清(羊):福州迈新生物技术开发有限公司;其他试剂均为国产分析纯。
1.2 仪器
SZ660 系列连续变倍体式显微镜:重庆奥特光学仪器有限公司;MJX-430 果蝇培养箱:浙江托普仪器有限公司;DHG-9070A 型电热恒温鼓风干燥箱:上海精宏实验设备有限公司;PL203 型天平:Mettler TOLEDD;SX-700 灭菌锅:上海博讯实业有限医疗设备厂;WPUP-YJ-40 超纯水仪:沃特浦;DFPCO2LID 型 CO2麻醉板:上海玉博生物科技有限公司;BT01-100 型恒流泵:上海沪西分析仪器厂有限公司;S210 型pH 计:梅特勒-托利多;1645050 型电泳仪:伯乐生命医学产品(上海)有限公司;FL1000 成像系统:上海哈灵生物技术有限公司;501985 型解剖镊子:世界精密仪器商贸(上海)有限公司。
1.3 果蝇品系
实验所用品系 TH-GAL4;UAS-LRRK2 1915T 以及MHC-GAL4;UAS-LRRK2 1915T 由长春中医药大学生物工程实验室构建。
1.4 方法
1.4.1 果蝇培养基的制备
称取玉米粉175 g,黄豆粉30 g 及琼脂粉20 g,加入3 L 纯净水充分搅拌溶解。保持沸腾状态30 min 后加入60 g 安琪酵母粉,50 g 蔗糖,50 g 葡萄糖,充分混匀后继续加热煮沸。随后量取90mL甘蔗糖浆加入容器中,冷却20 min 加入10%尼泊金甲酯40mL及丙酸20mL制成普通培养基。在普通培养基的基础上,配成Rg1 终浓度为 0.1、0.4 mmol/L 和 1.6 mmol/L 的含药培养基。
1.4.2 药物分组
将LRRK2 1915T 突变果蝇分为4 个不同作用浓度组(0、0.1、0.4、1.6 mmol/L),并设置于幼虫期和成虫期均给药(L+/A+)和仅有成虫期给药(L-/A+)两种药物作用方式。利用果蝇寿命实验确定给药方式和最佳药物作用浓度以用于后续果蝇爬行能力分析、脑部多巴胺含量分析和Western blot 检测。
1.4.3 果蝇寿命实验
收取各组8 h 内新羽化未交配的雄蝇成虫100只,每管分装20 只果蝇到含药培养基中,于29 ℃培养箱中培养。之后每24 h 于同一时刻观察记录各模型各喂药组果蝇生存情况,直至受试果蝇全部死亡,期间每隔1 d 更换一次新的培养基,以防因食物黏连造成死亡。
1.4.4 果蝇爬行能力检测
果蝇的负趋地性用来分析果蝇的爬行能力。取各生长时间点(I:3日龄~6日龄;II:10日龄~15日龄;III:20日龄~25日龄)实验组和对照组果蝇,经 CO2麻醉后,各随机抽取30 只放于长10 cm,直径约为1.5 cm的塑料长管中。室温(25 ℃)放置20 min 以确保果蝇于麻醉状态中苏醒,且充分适应环境。设置终点距离为距离管底6 cm 处。随后,轻柔将爬行管中的果蝇敲至管底,记录10 s 内到达终点处的果蝇数,每组实验重复10 次。
1.4.5 果蝇脑部多巴胺含量检测
取各病理模型组及对照组2日龄雄蝇100 只,按照每培养管20 只随机分为对照组和药物组。药物浓度设置为单一药物浓度,选择依据为果蝇寿命实验筛选出的有效药物浓度。受试果蝇转管至含药培养基,并置于29 ℃培养箱中实验即为正式开始,于疾病发展的 3 个不同时期(I:3 d~5 d;II:15 d~18 d;III:25 d~30 d)在培养的100 只果蝇中随机选取3 只,剪取果蝇大脑进行多巴胺含量检测,每组设置5 个平行对照。
1.4.6 Western blot 检测
收取各实验组10日龄~15日龄果蝇30 只,冰上剪取果蝇头部,提取蛋白质,检测给药前后果蝇脑中P-LRRK2、Nrf2、谷氨酰半胱氨酸合成酶(glutamate--cysteine ligase catalytic,GCLC)、细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)、P -P38MAPK 的表达变化。
1.4.7 统计学分析
除特殊说明外,所有研究均进行至少3 次的生物学重复,数据以means±SD 形式展示。统计学分析应用GraphPad Prism6 软件完成,组间差异分析应用Oneway ANOVA 分析方法完成。
2 结果与分析
2.1 人参皂苷Rg1对LRRK2-1915T果蝇存活率的影响
人参皂苷Rg1 对LRRK2-1915T 果蝇存活率的影响见图1。
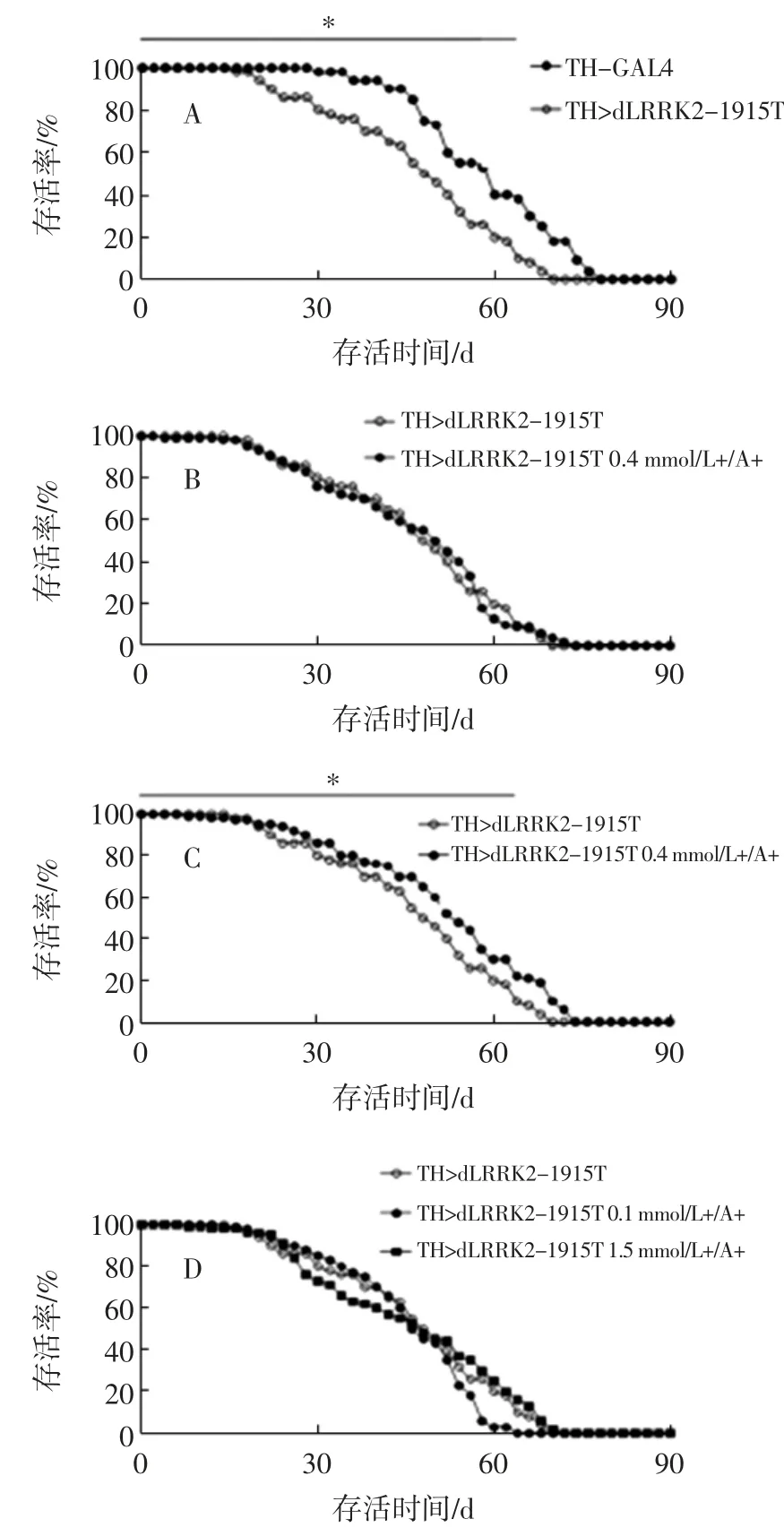
图1 人参皂苷Rg1 对LRRK2-1915T 果蝇存活率的影响Fig.1 Effect of ginsenoside Rg1 on the survival rate of LRRK2-1915T fruit fly
相对于对照组TH-GAL4 果蝇,LRRK-1915T 突变果蝇的存活率显著降低(P<0.05)。以0.4 mmol/L 人参皂苷Rg1 于幼虫发育期和成虫发育期同时喂食病理模型果蝇时,可在一定程度上提高病理模型果蝇的存活率。同样作用浓度下如幼虫期不给药,则作用效应消失。以0.1 mmol/L 和0.6 mmol/L 人参皂苷Rg1 喂食病理模型果蝇时,则无显著作用效应。
2.2 人参皂苷Rg1对LRRK2-1915T果蝇爬行能力的影响
人参皂苷Rg1 对LRRK2-1915T 果蝇爬行能力的影响见图2。
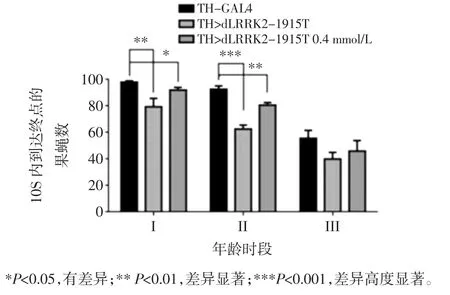
图2 人参皂苷Rg1 对LRRK2-1915T 果蝇爬行能力的影响Fig.2 Effect of ginsenoside Rg1 on the crawling ability of LRRK2-1915T fruit fly
由图2 可知,对照组果蝇MHC-GAL4 的爬行能力随着培养时间的延长出现了一定程度的降低,但LRRK-1915T 病理模型组爬行能力降低的更为显著。而在疾病发展的I(3 d~5 d)和II(15 d~18 d)期,人参皂苷Rg1 0.4 mmol/L 能在一定程度上挽救1915T 果蝇爬行能力的降低,但当疾病进展至 III(25 d~30 d)期时,药物作用效应消失。
2.3 人参皂苷Rg1对LRRK2-1915T果蝇脑多巴胺(DA)含量的影响
人参皂苷Rg1 对TH>dLRRK2-1915T 果蝇脑DA含量的影响见图3。
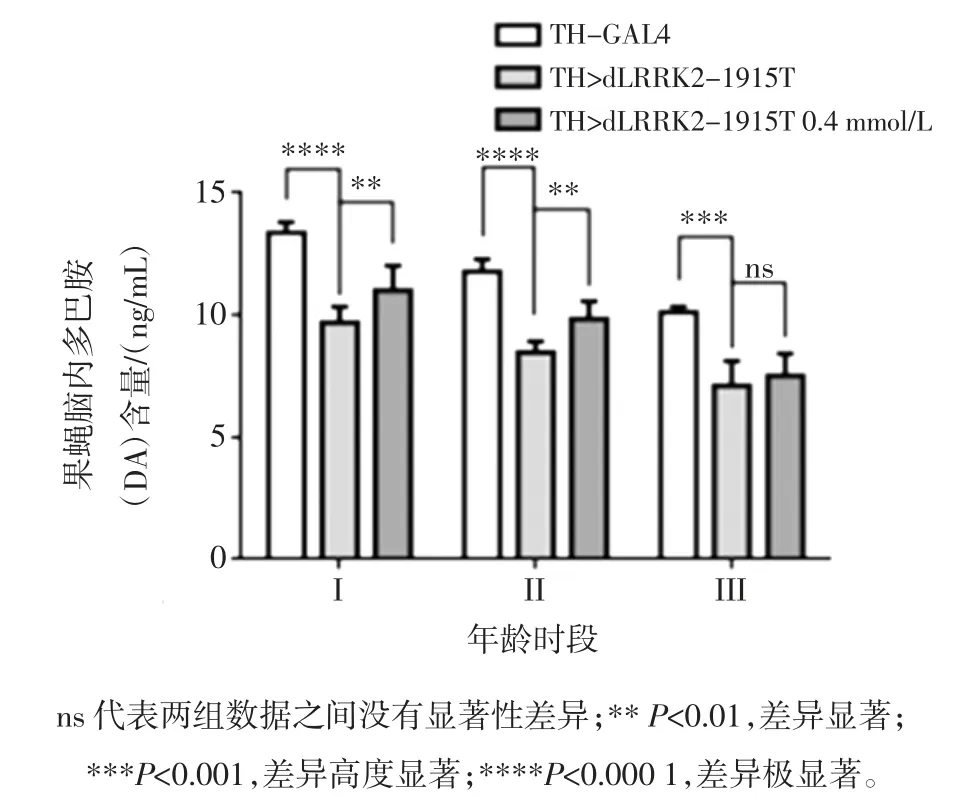
图3 人参皂苷Rg1 对LRRK2-1915T 果蝇脑部多巴胺含量的影响Fig.3 Effect of ginsenoside Rg1 on dopamine content in LRRK2-1915T drosophila brain
由图3 可见 I(3 d~5 d)、II(15 d~18 d) 以及 III(25 d~30 d)3 个不同时期中,对照组 TH-GAL4 果蝇随生长时间的延长DA 含量也出现了一定程度的下降,但病理模型组DA 下降更为显著,0.4 mmol/L 人参皂苷Rg1 均可在一定程度上挽救LRRK2 突变导致的DA 含量降低。以上研究结果充分说明于果蝇幼虫发育和成虫发育时期同时给与0.4 mmol/L 人参皂苷Rg1干预,可以挽救LRRK2 突变导致的果蝇PD 样病理表型。
2.4 人参皂苷Rg1对LRRK2-1915T果蝇保护作用机制探讨
2.4.1 磷酸化LRRK2 表达量的改变
人参皂苷Rg1 对TH>dLRRK2-1915T 果蝇磷酸化LRRL2 蛋白表达量的影响见图4。
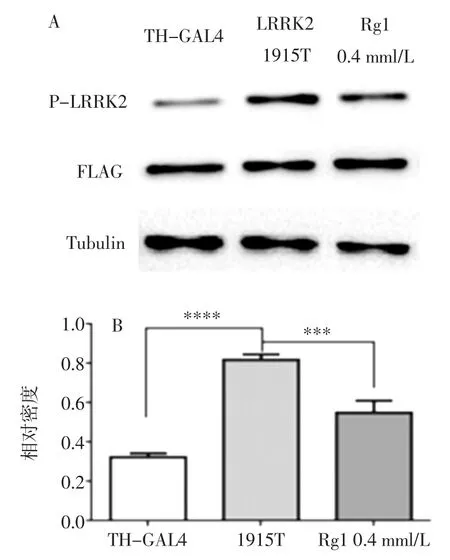
图4 人参皂苷Rg1 对1915T 突变果蝇P-LRRK2 表达水平的影响Fig.4 Effect of ginsenoside Rg1 on the expression of P-LRRK2 in 1915T mutant Drosophila
由图4 可知,与阴性对照组TH-GAL4 相比,LRRK2-1915T 突变果蝇磷酸化LRRK2 水平显著升高(P<0.000 1),给与 0.4 mmol/L 人参皂苷 Rg1 干预后,磷酸化 LRRK2 表达水平降低(P<0.001)。
2.4.2 对Nrf2 和GCLC 表达的影响
人参皂苷Rg1 对 TH>dLRRK2-1915T 果蝇 Nrf2和GCLC 蛋白表达量的影响见图5。
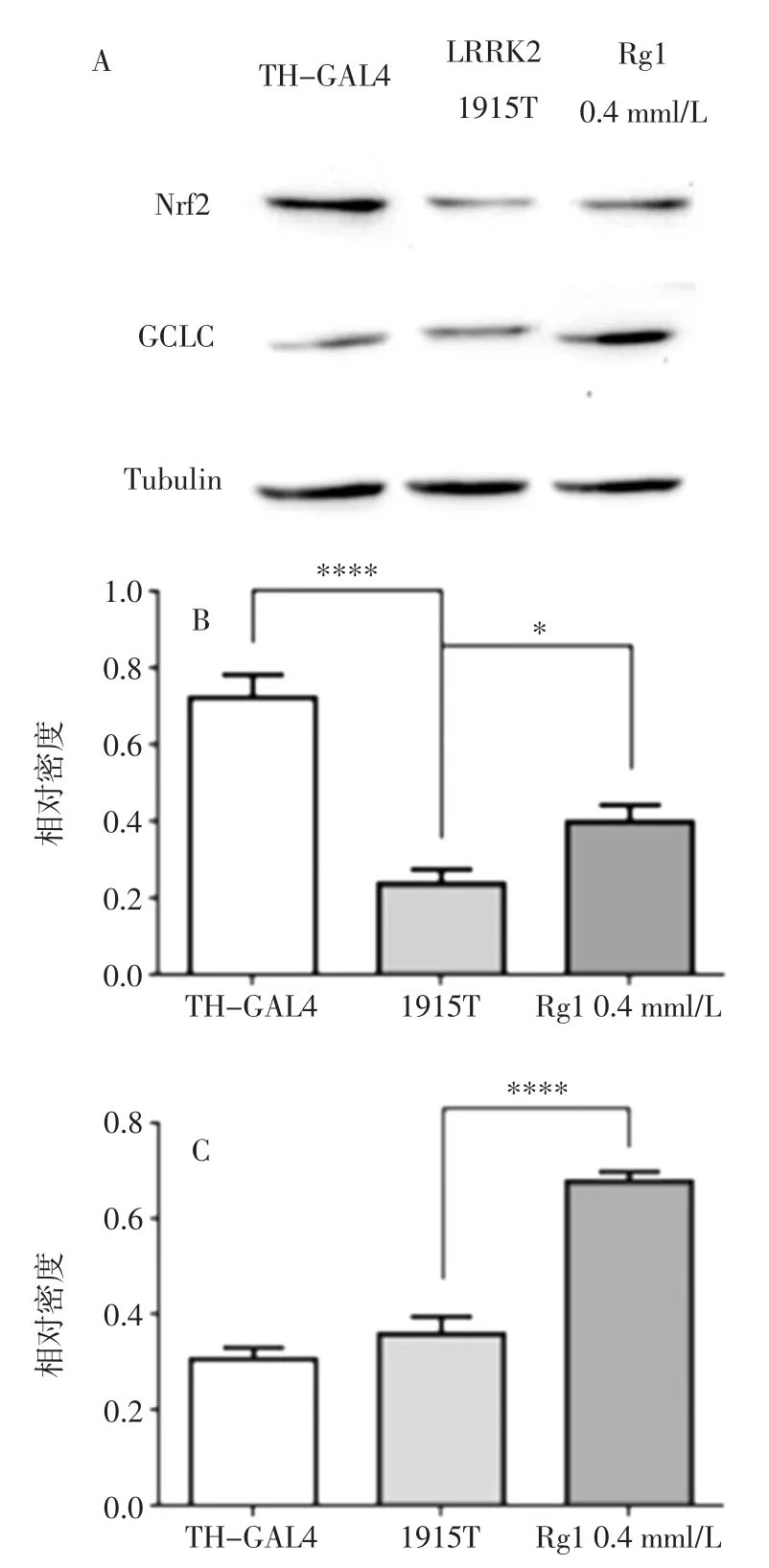
图5 人参皂苷Rg1 对1915T 突变果蝇Nrf2 和GCLC 表达水平的影响Fig.5 Effects of ginsenoside Rg1 on the expression of Nrf2 and GCLC in 1915T mutant Drosophila
由图5 可知,与阴性对照组果蝇相比,LRRK-1915T 果蝇Nrf2 表达量显著降低,而GCLC 无显著变化,当给与人参皂苷Rg1 时,人参皂苷Rg1 可显著提升Nrf2 和GCLC 蛋白的表达水平。
2.4.3 P-P38MAPK 表达的影响
人参皂苷Rg1 对TH>dLRRK2-1915T 果蝇P-P38蛋白表达量的影响见图6。
由图6 可知,与阴性对照组果蝇相比,LRRK-1915T 果蝇磷酸化P38 水平显著升高,而人参皂苷Rg1 可显著抑制磷酸化P38 水平的上升趋势。
2.4.4 磷酸化ERK 表达量的变化
人参皂苷Rg1 对TH>dLRRK2-1915T 果蝇磷酸化ERKE 蛋白表达量的影响见图7。
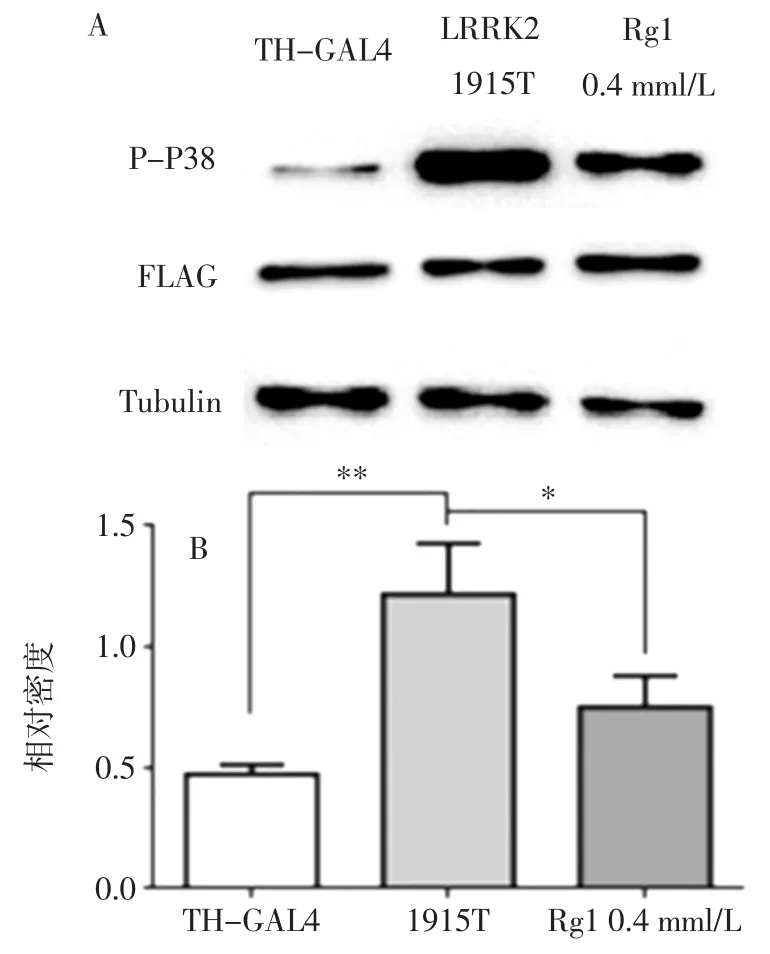
图6 人参皂苷Rg1 对1915T 突变果蝇P-P38 表达水平的影响Fig.6 Effect of ginsenoside Rg1 on the expression of P-P38 in 1915T mutant drosophila
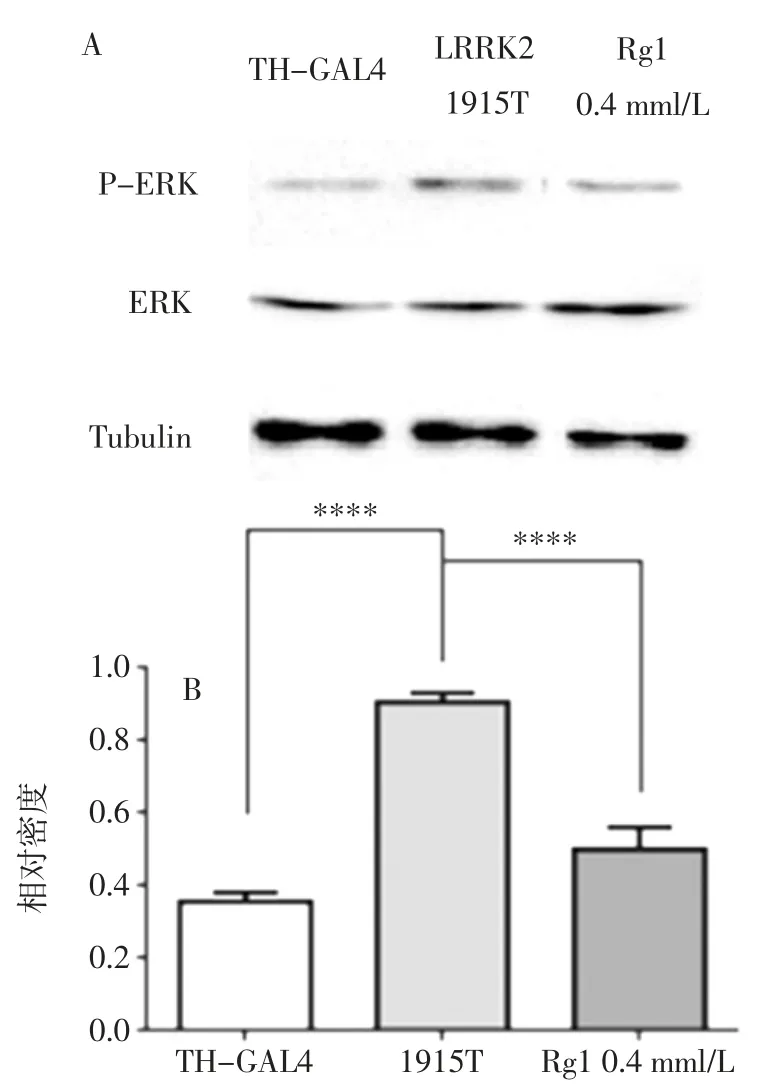
图7 人参皂苷Rg1 对1915T 突变果蝇P-ERK 表达水平的影响Fig.7 Effect of ginsenoside Rg1 on the expression of P-ERK in 1915T mutant drosophila
由图7 可知,与阴性对照组果蝇相比,LRRK-1915T 果蝇磷酸化ERK 水平显著升高,而人参皂苷Rg1 可显著抑制磷酸化ERK 水平的上升趋势。
3 结论与讨论
人参皂苷Rg1 对于PD 模型的作用效应已取得了比较多的研究进展。人参皂苷Rg1 对于MPTP 诱导的黑质神经元细胞凋亡显示出保护作用,体内研究表明使用5.0、10.0 mg/kg 的Rg1 预处理,可增加体内Zona compacta 区 Nissl 染色和 TH(+) 神经元并且减少TUNEL(+)神经元(P <0.01)[17]。人参皂苷 Rg1 对于MPTP 诱导的SN 区神经元丢失现象的挽救也可能是通过其抗氧化效应实现的,同时抑制JNK 信号途径的级联反映。Rg1 可阻止GSH 的下降,保持SOD 活力,降低JNK 和c-Jun 的磷酸化程度[18]。关于人参皂苷Rg1的保护作用,在不同模型中的其他研究也提到Rg1 在磷酸化胞外调节激酶1/2(P-ERK1/2)信号通路作为神经保护中涉及的机制的重要性。CNS 中的抗炎活性被认为在PD 中发挥有益作用。在这一观点的基础上,发现人参皂苷Rg1 抑制体内MPTP 诱导的小鼠PD 模型SN 区 COX-2 表达;与 MPTP 模型组相比,用 Rg1 预处理磷酸化P-38,COX-2 和PGE2 阳性细胞显着减少,并且改善了TH(+)神经元的显着减少现象,意味着Rg1 可能通过作用于P-38 信号通路以保护PD 中的多巴胺能神经元[19]。
由此可见人参皂苷Rg1 对LRRK2 突变果蝇的挽救作用途径可能是通过:1)激活Nrf2,从而升高了GCLC 蛋白的表达,产生了一定的抗氧化作用效用,提高神经元抵抗氧化应激的能力,进而保护了多巴胺能神经元的功能,维护DA 含量;2)抑制磷酸化P38 表达,阻断JNK 信号传递途径,一定程度抑制了LRRK2突变导致的LRRK2 激酶活性,进而维系了多巴胺能神经元功能。因此,本研究针对人参皂苷Rg1,利用果蝇活体器官模型,探讨人参皂苷Rg1 对LRRK2 突变导致PD 样病理症状的挽救作用,并从P38-JNK 信号途径和氧化应激相关Keap1-Nrf2-ARE 信号途径解释了其作用机制。研究成果为人参皂苷Rg1 的神经保护作用提供了一定的科学依据。
