巨噬细胞p38丝裂原活化蛋白激酶信号通路促进抗结核菌感染作用
2019-07-10盛青邹威凤周强周晓婷黎希
盛青 邹威凤 周强 周晓婷 黎希
广州市胸科医院呼吸内科(广州510095)
【关键字】 p38 丝裂原活化蛋白激酶;结核分枝杆菌;结核病;菌落形成单位;骨髓来源的巨噬细胞
固有免疫反应除了作为保护宿主免受病原体感染的第一道防线,在抗病原菌感染中发挥重要作用之外,还可通过产生各种特异性细胞因子和趋化因子来激活宿主的适应性免疫反应[1]。其中巨噬细胞可利用其细胞表面或胞内的模式识别受体(pattern recognition receptor,PRRs)识别病原体相关分子模式(pathogen-associated molecular patterns,PAMPs),激活细胞内一系列信号分子,如丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK),其中包括p38 MAPK、胞外调节蛋白激酶和c-Jun 氨基末端激酶等信号分子,这些信号分子可促进细胞因子和趋化因子的表达,并进一步促进机体的适应性免疫反应,从而在抗病原菌感染中发挥重要作用。虽然许多干预措施侧重于调节适应性免疫系统,但固有免疫反应对于宿主保护也是至关重要的[2]。研究发现在结核菌感染巨噬细胞过程中,p38 MAPK 信号通路可促进感染细胞内吞噬体的成熟[3]和细胞凋亡进程[4],另外也介导巨噬细胞内TNF-α和IL-6 的表达[1],这些发现提示巨噬细胞内p38 MAPK 信号通路在抗结核菌感染过程中具有重要作用,然而,p38 MAPK信号通路是否能够抑制巨噬细胞内结核菌的存活尚不可知。因此,本文将研究巨噬细胞内p38 MAPK 信号通路在抗结核菌感染中的具体作用和分子机制。
1 材料与方法
1.1 材料
1.1.1 动物 SPF 级8~10 周龄雄性C57BL/6 小鼠10 只,体质量(18 ± 0.5)g,由深圳第三人民医院肝病研究所提供。
1.1.2 主要仪器和试剂 ACK LYSING BUFFER(Invitrogen),重组小鼠M-CSF(peprotech),DMEM培养基(Gibco),胎牛血清(Gibco),结核菌H37Ra(上海楚瑞生物有限公司),Phospho-p38 MAPK(Thr180/Tyr182)(28B10)Human mAb(APC)(eBioscience),Phospho-p38 MAPK(Thr180/Tyr182)(D3F9)XP®Rabbit mAb(CST),Lyse/Fix Buffer(5x)(BD),Perm Buffer Ⅲ(BD),实时定量PCR 仪(Roche),紫外分光光度仪(DeNovix),普通PCR仪(ABI),高速离心机(Eppendorf),流式细胞仪(BD FACSCantoⅡ)。
1.2 方法
1.2.1 肺结核小鼠的构建 随机将8~10 周龄雄性C57BL/6 小鼠分成两组,每组各5 只,分别通过气溶胶雾化吸入大约150 CFUs H37Ra 和等体积的PBS 液体[5],1 个月后处死小鼠,取其肺脏,分离肺组织淋巴细胞。
1.2.2 p38 MAPK的磷酸化检测 20倍体积的预热1x Lyse/Fix Buffe 立即固定细胞,37 ℃孵育10 min,5 000 r/min离心5 min,去上清;振荡片刻,加入1 mL预冷Perm BufferⅢ,冰上破膜30 min;FACS buffer洗两次,染色(p-p38 APC 1∶100),常温孵育30 min;FACS buffer 洗两次,并在流式细胞仪上检测p38 MAPK 的磷酸化水平。
1.2.3 分离与培养小鼠骨髓来源的巨噬细胞 从小鼠胫骨和股骨中分离骨髓细胞,单细胞悬于DMEM 培养基中,其中DMEM 培养基中加有10%FBS 和20 ng/mL M-CSF,放置37 ℃,5% CO2培养箱中培养5 d,收集巨噬细胞。
1.2.4 蛋白印迹检测 提取细胞蛋白后,将蛋白定量后平均加入12%聚丙烯酰胺凝胶中,蛋白被分离后转入硝酸纤维素膜中,随后用特异性一抗p-p38 MAPK 孵育过夜,次日孵育二抗,加入适当发光液曝光检测。
1.2.5 qRT-PCR 检测 根据Total RNA Kit I 说明书抽提总RNA;RNA 浓度和A260/280 比率由紫外分光光度仪检测;通过PrimeScript®RT kit 反转录成cDNA;qPCR 由SYBR Green PCR Master Mix 按照标准步骤操作;所有基因的mRNA 与管家基因GAPDH 以2-ΔΔCT函数值进行计算。
1.2.6 CFU 计数 结核菌H37Ra 以MOI=5 感染巨噬细胞,分别孵育4 h 与72 h 后,用无菌PBS 清洗2 遍,随后用0.1%SDS 裂解细胞,裂解物被依次稀释成3 个梯度,分别接种于7H11 Middlebrook 琼脂培养板上,在5% CO2和37 ℃的条件下培养,3~4 周后计数各平板菌落数量。
1.3 统计学方法 采用GraphPad Prism 5.0 软件进行统计分析,以H37Ra 雾化小鼠的结核组和PBS 的对照组肺组织p38 MAPK 的磷酸化水平、不同组间细胞内结核菌吞噬率和存活率以及不同组间细胞IL-6、TNF-α及IL-1β mRNA的相对水平为计数资料,以表示,两组间比较采用t检验,多组间比较采用方差分析,以P<0.05为差异具有统计学意义。
2 结果
2.1 不同小鼠肺组织中p38 MAPK磷酸化水平的比较 如图1所示,H37Ra雾化组肺组织中p38 MAPK的磷酸化水平(2.115 ± 0.2960)%显著高于PBS 雾化组(0.4250 ± 0.1075)%,两者间差异具有统计学意义(t=5.493,P=0.000 6)。
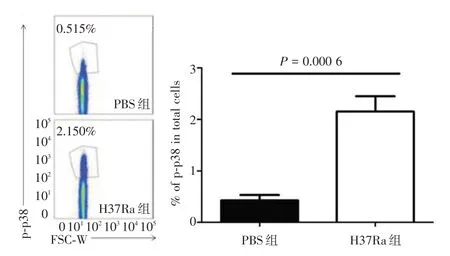
图1 PBS 和H37Ra 雾化的小鼠肺组织中p38 MAPK 的磷酸化水平Fig.1 Phosphorylation level of p38 MAPK in lung homogenate of mice atomized with PBS and H37Ra
2.2 H37Ra 感染小鼠巨噬细胞前后p38 MAPK 磷酸化水平的比较 接着检测巨噬细胞中p38 MAPK信号通路与结核菌感染的关系,如图2所示,与空白对照相比,结核菌H37Ra 感染巨噬细胞15、30、45 以及60 min 后,其胞内p38 MAPK 的磷酸化水平逐渐增加。
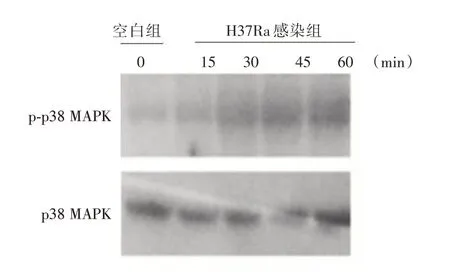
图2 蛋白印迹法检测H37Ra 在不同时间点感染巨噬细胞后p38 MAPK 的磷酸化水平Fig.2 Western Blot analysis of phosphorylation level of p38 MAPK after H37Ra infection of macrophages at indicated time points
2.3 p38 MAPK 信号通路对巨噬细胞控制结核菌感染的影响 为了进一步研究巨噬细胞中p38 MAPK 信号通路在结核菌感染中的作用,笔者利用SB203580 抑制细胞内p38 MAPK 活性后,检测巨噬细胞内结核菌吞噬率和存活率的变化。如图3A 所示,空白对照组细胞内H37Ra 吞噬率为(80.00 ± 5.774)%,SB203580 抑制组细胞内H37Ra吞噬率为(75.00 ± 2.887)%,两者间差异没有统计学意义(t=0.774 6,P=0.481 8);如图3B所示,空白对照组细胞内H37Ra 存活率为(100.0 ± 5.774)%,SB203580 抑制组细胞内H37Ra 存活率为(130.0 ±5.774)%,SB203580 抑制组细胞内H37Ra 存活率显著高于空白对照组,两者间差异具有统计学意义(t=3.674,P=0.021 3)。

图3 p38 MAPK 信号通路对巨噬细胞吞噬H37Ra 和杀菌活性的影响Fig.3 Effect of p38 MAPK signaling pathway on uptake of H37Ra and bactericidal activity of macrophages
2.4 p38 MAPK 信号通路对结核菌诱导巨噬细胞内细胞因子表达的影响 由于巨噬细胞主要通过炎症因子发挥抗感染作用,因此笔者检测p38 MAPK 信号通路对结核菌诱导巨噬细胞内细胞因子表达有影响,结果如图4A所示,H37Ra+SB203580感染组IL-6 mRNA 表达水平(70.005.774)显著低于H37Ra 感染组(150.0 ± 5.774),两者间差异具有统计学意义(t=9.789,P=0.000 6);如图4B 所示,H37Ra+SB203580 感染组TNF-α mRNA 表达水平(7.667 ± 0.881 9)显著低于H37Ra 感染组(16.00±1.155),两者间差异具有统计学意义(t=5.735,P=0.004 6);如图4C 所示,H37Ra+SB203580 感染组IL-1β mRNA 表达水平(8.000 ± 0.577 4)显著低于H37Ra 感染组(25.00 ± 1.732),两者间差异具有统计学意义(t=9.311,P=0.000 7)。

图4 p38 MAPK 信号通路对H37Ra 诱导巨噬细胞内细胞因子表达的影响Fig.4 Effect of p38 MAPK signaling pathway on H37Ra-induced cytokine expression in macrophages
3 讨论
研究宿主对结核菌感染的抗性或易感性的关键调节机制或信号分子对于开发新的结核病控制策略非常重要[6]。尤其对常规抗结核治疗具有耐受性的耐多药和广泛耐药结核菌株更为重要。最近,已经鉴定出几种宿主分子可作为潜在的宿主定向治疗(host-direct therapy,HDT)靶点[7]。在这项研究中,笔者首次发现p38 MAPK 可以抑制巨噬细胞内结核菌的存活,提示p38 MAPK 可能是HDT抗结核病的新靶点。在肺结核小鼠模型中笔者发现,肺组织中p38 MAPK 的磷酸化活性显著增加,表明p38 MAPK 信号通路参与了小鼠肺结核的发生发展过程,但具体发挥怎样的作用仍未清楚。
结核菌主要通过呼吸道感染宿主,起初被肺泡巨噬细胞吞噬,在巨噬细胞表面含有大量的PRRs,可识别结核菌中的PAMPs,如脂多糖等,激活细胞内一系列重要的信号通路,参与各种细胞反应[8],并激活T 细胞介导的适应性免疫应答[9]。其中p38 MAPK 信号通路是细胞内重要的活化通路之一[8]。在结核菌感染巨噬细胞过程中,p38 MAPK信号通路可促进感染细胞内吞噬体的成熟[3]和细胞凋亡进程[4]。且有研究[10]发现,剧毒结核菌株可通过去磷酸化作用抑制巨噬细胞内p38 MAPK 的磷酸化活性,而减毒结核菌株诱导的p38 MAPK 磷酸化活性明显更高,这些发现与笔者的结果一致,但p38 MAPK 信号通路是否能抑制巨噬细胞内结核菌的存活有待进一步论证。接着笔者发现在结核菌感染巨噬细胞的过程中,p38 MAPK信号活性逐渐增加,同时抑制其活性后,巨噬细胞内结核菌的存活率增加,表明p38 MAPK 信号通路确实能够抑制巨噬细胞内结核菌的存活。
上述发现表明p38 MAPK 信号通路的激活可以增强巨噬细胞的抗结核菌感染的作用,因此,笔者初步分析p38 MAPK 信号通路增强巨噬细胞内抗结核菌感染的分子机制。笔者发现在结核菌感染巨噬细胞过程中,抑制p38 MAPK 活性后,巨噬细胞内结核菌诱导的细胞因子表达水平显著下降,包括IL-6、TNF-α及IL-1β等,表明p38 MAPK 信号通路可能通过调控细胞内炎症因子的表达水平参与抗结核菌感染的过程,而TNF-α在结核病的早期和长期控制中起着至关重要的作用[11],如巨噬细胞在识别结核菌细胞壁PAMPs后分泌TNF-α,随后激活巨噬细胞,将其迁移到感染部位,参与肉芽肿的形成[12]。另外,TNF-α可上调一氧化氮合酶2 的表达,并进一步诱导巨噬细胞内活性氮中间体的产生,介导胞内杀灭结核菌的过程[13]。另外有研究发现由于IL-6 缺陷型小鼠在结核菌感染后病理反应加重,提示笔者IL-6 在保护宿主免受结核菌感染中也起着至关重要的作用[13]。因此,笔者初步认为,在结核菌感染巨噬细胞过程中,p38 MAPK 信号通路可能通过调控细胞因子的表达水平参与各种宿主防御反应,如细胞自噬、凋亡或应激等。总之,宿主细胞中p38 MAPK 的活性与抗结核菌感染过程密切相关,对清除巨噬细胞中结核菌具有重要的作用,这一成果为p38 MAPK 潜在的临床应用提供了理论依据,可能作为HDT 抗结核病治疗的新靶点。
