猪丁型冠状病毒诱导的细胞线粒体凋亡
2019-07-10焦少勇林翠杜柳阳刘俊丽顾金燕周继勇
焦少勇,林翠,杜柳阳,刘俊丽,顾金燕,周继勇
猪丁型冠状病毒诱导的细胞线粒体凋亡
焦少勇1,林翠2,杜柳阳1,刘俊丽1,顾金燕1,周继勇2
1 南京农业大学 免疫研究所,江苏 南京 210095 2 浙江大学 农业农村部动物病毒学重点实验室,浙江 杭州 310058
猪丁型冠状病毒 (Porcine deltacoronavirus,PDCoV) 是一种新型的猪肠道致病性冠状病毒,可引起猪群剧烈腹泻及呕吐,但致病机制尚不清楚。本研究检测了PDCoV感染诱导的细胞凋亡。Caspase酶活性检测显示,在PDCoV感染的细胞中,caspase 3、caspase 8和caspase 9的活性随病毒感染量的增多而显著提高,类似的现象未能在紫外灭活病毒感染的细胞中观察到,表明PDCoV感染可同时激活内源性与外源性细胞凋亡通路,并暗示细胞凋亡的诱导依赖于病毒复制。为深入探究PDCoV诱导的内源性细胞凋亡,分别检测胞浆和线粒体中细胞色素C与凋亡诱导因子。结果显示,与正常细胞相比,PDCoV感染细胞从线粒体释放到胞浆的细胞色素C显著增多,且其释放量随着感染时间的延长而增多,而凋亡诱导因子始终定位于线粒体,提示PDCoV感染通过促使线粒体膜间隙的细胞色素C进入胞浆而启动caspase依赖的线粒体凋亡通路。本研究初步揭示了PDCoV诱导细胞凋亡的机制。
猪丁型冠状病毒,线粒体凋亡,细胞色素C
猪丁型冠状病毒(Porcine deltacoronavirus,PDCoV) 是近年来发现的新型冠状病毒,属于套氏病毒目冠状病毒科丁型冠状病毒属,是有囊膜的单股正链RNA病毒,基因组全长约为25.4 kb[1]。PDCoV于2012年首次在中国香港被报道[2],并于2014年初在美国的腹泻猪群中首次被检测到[3],现已在美国、加拿大及亚洲多个国家流行[4-6]。PDCoV可感染各年龄段猪群,主要引起仔猪水样腹泻、呕吐及脱水[7]。组织病理学研究发现,PDCoV可感染猪小肠绒毛上皮细胞,引起细胞空泡化、绒毛萎缩及细胞坏死脱落[8]。在体外,PDCoV可感染猪肾细胞(LLC porcine kidney,LLC-PK) 和猪睾丸细胞(Swine testicular,ST),并使感染细胞产生明显病变[9],这些都提示PDCoV感染与细胞凋亡密切相关。
细胞凋亡是在生理或病理条件下,细胞受内外信号刺激后发生的受基因调控的自杀行为,又被称为“程序性细胞死亡”。在抵抗微生物感染、维持机体内环境稳态中也起着至关重要的作用[10-11]。病毒感染过程与细胞凋亡发生密切相关,一方面细胞通过凋亡过程可以清除病毒,抵抗病毒感染;另一方面病毒在与宿主细胞博弈过程中会进化出一些拮抗或劫持策略,以利于病毒的复制与传播。目前已发现许多病毒在感染后期可诱导细胞凋亡,猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV) 被证实其感染晚期可通过激活线粒体凋亡诱导因子(Apoptosis-inducing factor,AIF)诱导不依赖caspase的细胞凋亡[12],从而利于病毒扩散。近期有研究表明,PDCoV感染也能激活线粒体凋亡通路[13],但对于PDCoV诱导凋亡的具体机制仍需深入探究。本研究通过检测PDCoV感染细胞中各项内外源凋亡指标,确定了病毒激活凋亡的具体途径,为深入探究PDCoV调节细胞凋亡的机制奠定基础。
1 材料与方法
1.1 细胞和病毒
ST细胞和PDCoV-CH-HA3-2017 (MK040455)毒株由本实验室保存。ST细胞培养于含10%胎牛血清的DMEM培养基中,0.05%胰酶消化后按1︰3比例传代。PDCoV病毒扩繁后使用Optiprep密度梯度离心法进行纯化。病毒灭活系采用紫外线(Ultraviolet,UV) 照射1 h,用间接免疫荧光试验(Immunofluorescence assay,IFA) 来检测PDCoV的灭活效果。本实验中病毒感染复数均为MOI=1。
1.2 生物材料和主要试剂
DMEM培养基和胎牛血清购自Gibco公司;TPCK胰蛋白酶购自Invitrogen公司;Optiprep密度梯度介质购自Sigma-Aldrich公司;BCA蛋白定量试剂盒购自GenStar公司;细胞线粒体分离试剂盒和RIPA细胞裂解液购自上海碧云天生物技术有限公司;线粒体荧光染料JC-1购自杭州联科生物技术有限公司;caspase 8检测试剂盒购自Clontech Laboratories公司;caspase 3、caspase 9及AIF的抗体均购自Cell Signaling Technology公司;细胞色素C、线粒体外膜转位酶20 (Tomm 20)的抗体购自Abcam公司;兔抗β-actin抗体购自杭州华安生物技术有限公司;HRP标记羊抗兔IgG和HRP标记羊抗鼠IgG购自KPL公司;PDCoV N蛋白的鼠多抗和PDCoV S蛋白的兔多抗由本实验室制备并保存。
1.3 病毒蛋白多抗的制备
PCR扩增PDCoV-CH-HA3-2017毒株的N基因,构建pET-28A-N原核表达质粒,转化BL21感受态细胞,挑斑活化重组表达菌,以1︰100接种含卡那抗性的液体培养基,待培养至值约为0.4–0.6时,加入1 mmol/L IPTG诱导剂,16 ℃、80 r/min振荡培养14 h,诱导表达N蛋白。收集菌体,经超声破碎后取上清液,使用Ni-NTA亲和纯化柱进行融合蛋白的纯化。取蛋白与佐剂等比例混合充分乳化后免疫小鼠3次,最后取小鼠血清即为PDCoV N蛋白鼠多抗,进行ELISA、IFA、SDS-WB方法检测抗体的反应性,并用于后续试验。
PDCoV S蛋白兔多抗制备过程与PDCoV N蛋白鼠多抗制备过程类似。截取PDCoV S1中段第766–1173位碱基编码的亲水区域命名为S1ep,将合成的S1ep基因序列插入pET-28A载体,构建pET-28A-S1ep重组质粒。将重组质粒转化BL21感受态细胞后,以0.5 mmol/L IPTG为诱导剂,16 ℃、100 r/min诱导过夜,Ni-NTA纯化S1ep融合蛋白,与佐剂混合乳化后免疫新西兰大白兔3次,最后心脏取血并收集血清得到后续试验所用的PDCoV S蛋白兔多抗。
1.4 Optiprep不连续密度梯度离心纯化病毒
将收集的病毒液于4 ℃、4 800 r/min离心25 min,上清经0.4 μm滤器过滤后转移至高速离心管中,平衡后于4 ℃、15 700 r/min离心2 h,弃上清。取0.5 mL DMEM吹悬病毒沉淀并于4 ℃溶解过夜。分别取900 μL 40%、30%、20%和10% (/) 碘克沙醇(Iodixanol) 梯度介质依次缓慢注入超速离心管中配制密度梯度,将已溶解的病毒液缓慢加于密度梯度溶液上层,平衡后于4 ℃、20 300 r/min离心3 h,分别取病毒可能所在条带并转移至高速离心管中,平衡后于4 ℃、15 700 r/min离心2 h,所得沉淀即为纯化后的病毒粒子。用适量DMEM溶解沉淀,分装冻存于–80 ℃。取一部分纯化的病毒样品通过SDS-PAGE、免疫印迹、电镜观察以及毒价测定确定病毒纯化成功。
1.5 蛋白样品制备及免疫印迹
收集细胞样品,加入细胞裂解液,使用BCA试剂盒进行蛋白质定量。取等量的蛋白样品进行SDS-PAGE,半干转印法将蛋白转移到NC膜上,膜经封闭、一抗和二抗等处理后,使用ECL显色液显色。本研究中使用的一抗分别为:抗细胞色素C鼠单抗(1︰1 000)、Tomm 20兔单抗(1︰1 000),AIF兔单抗(1︰1 000)、caspase 3兔单抗(1︰4 000)、caspase 9鼠单抗(1︰200)、β-actin兔单抗(1︰1 000)、PDCoV S兔多抗(1︰500) 和PDCoV N鼠多抗(1︰500),对应的二抗为HRP标记的羊抗鼠二抗(1︰8 000) 和HRP标记的羊抗兔二抗(1︰8 000)。
1.6 Caspase 8活性检测
2 000 r/min离心5 min收集细胞样品,加入50 μL预冷的细胞裂解缓冲液重悬细胞沉淀,冰上孵育10 min后,4 ℃、12 000 r/min离心10 min,取上清加入50 μL 2×反应缓冲液/DDT混合液,冰上孵育30 min;随后加入5 μL 1 mmol/L的caspase 8底物(IETD-pNA),37 ℃水浴1 h;最后,使用酶标仪测定405 nm波长下的吸光值。再根据标准曲线计算pNA量。
1.7 胞浆和线粒体组分分离
1 500 r/min室温离心5 min收集细胞,用预冷PBS重悬细胞。4 ℃、2 500 r/min离心5 min,向沉淀中加入1 mL线粒体分离试剂,重悬细胞后于冰浴放置15 min。随后,将细胞悬液匀浆后于4 ℃、2 500 r/min离心10 min。上清于4 ℃、10 800 r/min离心10 min。此时,收集所得沉淀加入150 μL线粒体裂解液得到样品即为线粒体组分,而上清液再经11 300 r/min离心10 min所得上清即为胞浆组分。
1.8 线粒体膜电位检测
待96孔板细胞密度达到70%时接种PDCoV,分别在接毒后16 h、24 h和32 h检测。将JC-1试剂与DMEM按1︰10稀释混匀,避光放置培养箱中温浴至37 ℃后,向样品孔中分别加入10 μL JC-1混合液,混匀后避光置于37 ℃培养箱中孵育20 min。样品经DMEM培养基洗涤两次后置于OLYMPUS DP72倒置荧光显微镜下观察。
2 结果与分析
2.1 PDCoV激活凋亡依赖于病毒复制
本研究使用Optiprep不连续密度梯度离心对扩繁所得PDCoV病毒进行纯化。纯化后的病毒粒子存在于Optiprep介质的20%与30%梯度之间,透射电镜观察可见直径100 nm左右、形态规则、外有囊膜、表层有日冕状纤突的病毒粒子(图1A)。经紫外线灭活的纯化PDCoV (UV-PDCoV)与未灭活PDCoV分别感染ST细胞,检测凋亡指示蛋白caspase 3的剪切体水平,十字孢碱(Staurosporine,STS) 处理作为凋亡阳性对照。结果如图1B和1C所示,UV-PDCoV感染的细胞几乎检测不到病毒S蛋白和caspase剪切体(Cleaved-caspase,Cl-caspase),而活病毒感染后可检测到大量的S蛋白和Cl-caspase 3,说明只有活PDCoV可以使caspase 3发生剪切,表明ST细胞凋亡的激活依赖于PDCoV的复制。
2.2 PDCoV感染激活细胞内源性与外源性凋亡通路
为了进一步验证PDCoV激活细胞凋亡的途径,我们收集了感染PDCoV不同时间点的细胞样品,并检测凋亡相关Cl-caspase及caspase酶活性。与未感染组比较,感染细胞内Cl-caspase 3和Cl-caspase 9条带均显著增多,并与感染病毒量呈正相关(图2A、2B和2C)。病毒感染后24 h,Cl-caspase 9水平最高(图2A和2C);感染后32 h,Cl-caspase 3水平最高(图2A和2B)。Caspase 8活性检测结果显示,病毒感染后24 h,caspase 8酶活性显著增强;感染后32 h,酶活性逐渐回落至正常水平(图2D),表明PDCoV激活了感染细胞中内外源性凋亡信号通路。
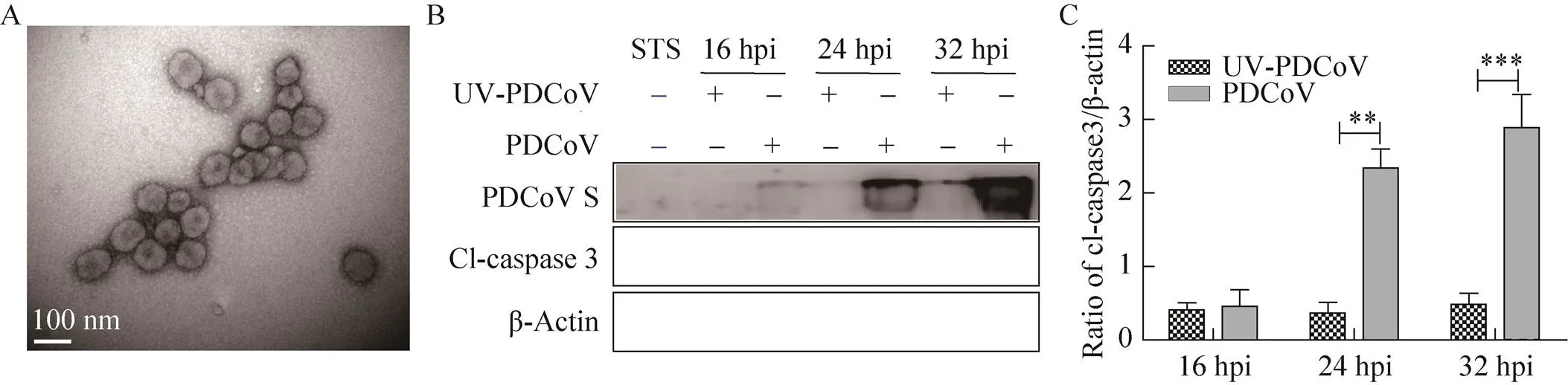
图1 PDCoV活化感染细胞的caspase 3
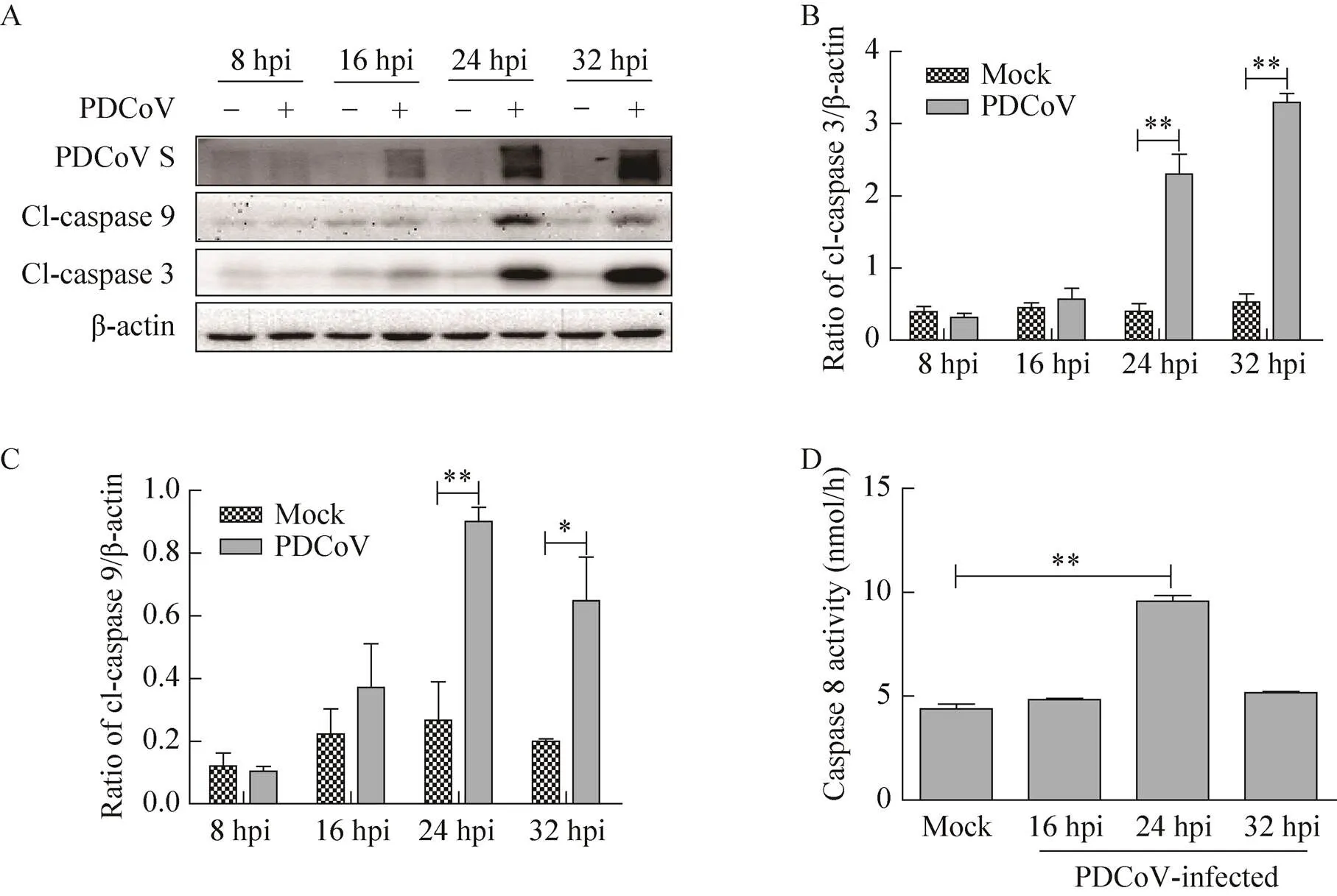
图2 PDCoV激活感染细胞内caspase 9
2.3 PDCoV感染诱导细胞色素C释放胞浆
依据上述实验结果,我们使用细胞线粒体分离试剂盒分离PDCoV感染与未感染细胞的胞浆和线粒体组分,免疫印迹分析细胞色素C和AIF变化。结果如图3所示,PDCoV感染细胞后,感染时间越长,细胞浆中细胞色素C的水平越高;而AIF则变化不显著,依然定位在线粒体内,表明PDCoV感染后可引起线粒体膜通透性增强,导致线粒体膜间隙内可溶性蛋白细胞色素C释放胞浆,从而激活下游caspase依赖的线粒体凋亡通路。此外,我们还观察到,线粒体和胞浆组分中均能检测到PDCoV的N蛋白,而S蛋白则仅存在于线粒体组分中(图3A)。
2.4 PDCoV感染不改变线粒体膜电位
线粒体膜通透性增强是内源性凋亡起始的关键[14]。目前研究表明,线粒体外膜通透性增强和线粒体内膜通透性增强均能激活线粒体凋亡通路,引起细胞凋亡[15-17]。通过JC-1染料检测线粒体膜电位,在线粒体膜电位较高时,JC-1聚集在线粒体基质中形成聚合物,浓度较高,产生红色荧光;在线粒体膜电位较低,即线粒体内外膜通透性增强时,JC-1染料逸出线粒体进入胞浆中,浓度较低,成单体形式存在,产生绿色荧光。结果如图4所示,PDCoV感染细胞与未感染细胞的红色荧光强度并无明显差异;病毒感染时间对绿色荧光强度也无影响,表明PDCoV感染后线粒体膜电位没有发生改变。

图3 PDCoV对感染细胞中细胞色素C及AIF分布的影响
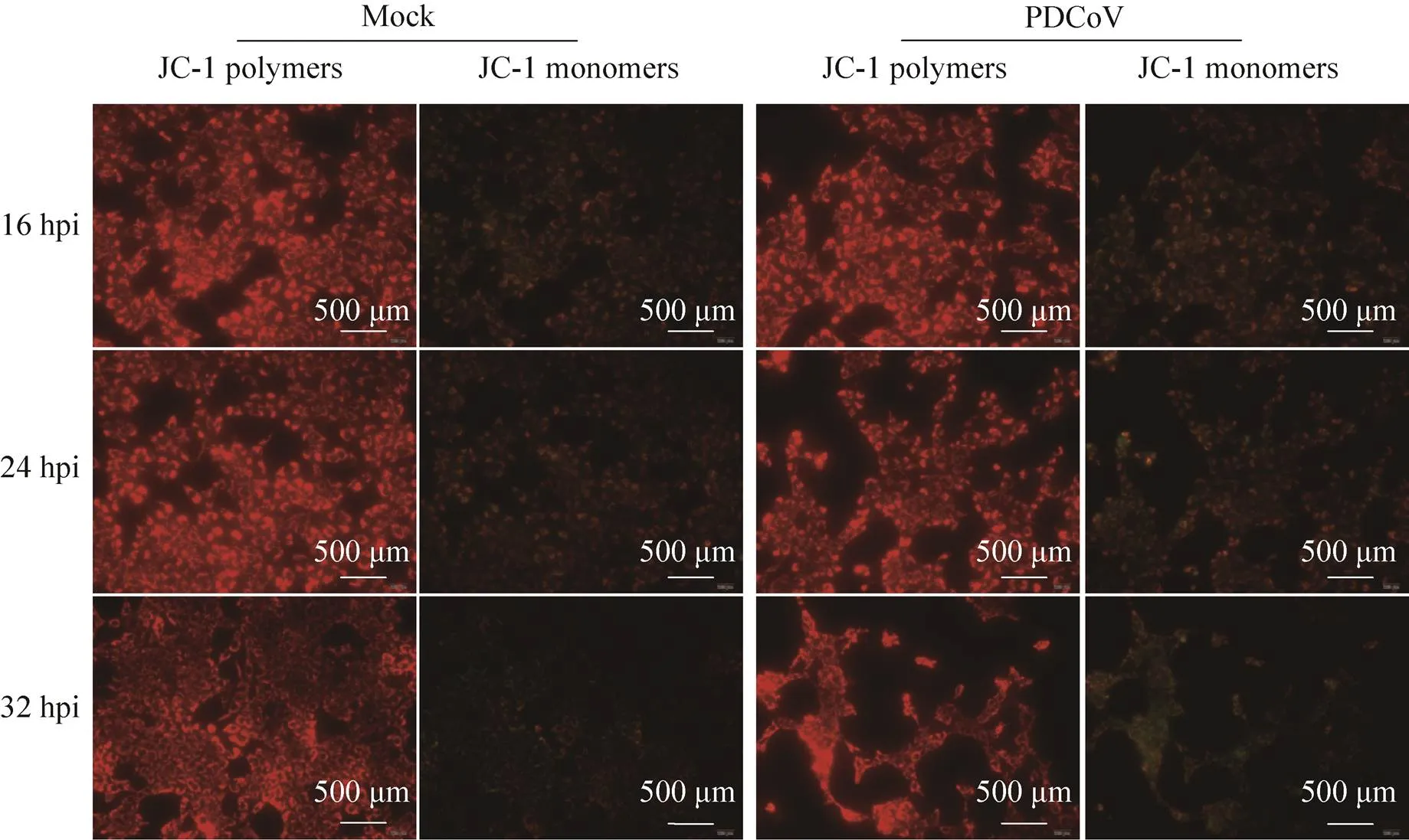
图4 PDCoV感染细胞的线粒体膜电位变化
3 讨论
病毒感染细胞的过程是病毒与宿主之间的一场博弈过程。宿主细胞在该过程中可产生凋亡或自噬等一系列免疫调节机制以保护细胞免受侵害,而病毒则会劫持利用细胞凋亡或自噬机制或进化出免疫逃避的策略以利于病毒自身复制[18]。冠状病毒是一类对人和动物有严重危害的病原,近些年重症急性呼吸综合征(Severe acute respiratory syndrome,SARS) 和中东呼吸综合征的暴发引起了人们对于冠状病毒的广泛关注[19-21]。同样,PEDV和PDCoV等冠状病毒给畜禽养殖业也造成了严重的经济损失。近年来,已有研究发现冠状病毒的致病机制与细胞凋亡密切相关。SARS通过诱导凋亡引起扩散性肺组织细胞损伤,从而使肺部组织中出现大量泡沫状巨噬细胞和多核合胞体[22-24];猪传染性胃肠炎病毒感染引起细胞氧化应激反应,可通过内质网功能性损伤诱导caspase依赖的细胞凋亡[25];PEDV通过诱导AIF移位到胞核引起细胞凋亡[12],亦有研究报道,PEDV木瓜蛋白酶可通过激活caspase 3诱导细胞凋亡[26]。本研究发现,PDCoV病毒感染不仅激活外源性凋亡(图2D),还激活内源性凋亡通路(图2A-C),并通过增强线粒体外膜通透性(图4),促进线粒体膜间隙中的可溶性蛋白细胞色素C释放入胞浆(图3),在胞浆中激活起始caspase 9 (图2A,2C),随后激活效应caspase 3 (图2A、2B),最终引发凋亡。
病毒感染细胞的整个过程都可能诱导凋亡发生。病毒黏附、入胞及其遗传物质释放过程都可调节细胞凋亡。然而,这些也仅仅是其诱导凋亡的一小部分,大部分凋亡的调节依赖于病毒复制后翻译出的病毒蛋白。例如,猪圆环病毒2型ORF4蛋白通过结合线粒体ANT3蛋白促进线粒体膜通透性增强诱导线粒体凋亡[27];人类免疫缺陷病毒1型的胞膜糖蛋白复合物(gp140和gp41)通过P53依赖反式作用于puma和bax,从而激活线粒体凋亡[28-29];丙型肝炎病毒的NS3蛋白,可结合caspase 8并增强caspase 8活性从而诱导细胞凋亡[30-31]。之前有研究显示,PDCoV激活caspase依赖的内源性凋亡由bax的线粒体募集引起[13]。bax是Bcl-2家族蛋白中最重要的凋亡效应蛋白,在凋亡信号刺激下,bax蛋白聚集在线粒体形成多聚体穿孔复合物,在线粒体外膜打开孔道,释放膜间隙可溶性蛋白,从而诱发凋亡[32]。PDCoV诱导凋亡机制已有初步研究报道[8, 13],本研究通过caspase试剂盒检测caspase 8活性,发现PDCoV可以通过外源性凋亡通路诱导ST细胞凋亡,这与报道通过使用caspase 8抑制剂获得的结论有所不同。caspase信号通路中存在复杂的反馈调节机制,外源性凋亡通路中的重要凋亡相关蛋白caspase 8涉及细胞增殖分化等多种生物学功能。我们目前先探索了内源性凋亡通路,选择检测细胞色素C和AIF的胞浆线粒体分布以及通过JC-1染料检测线粒体膜电位等方法从不同层面探讨PDCoV诱导ST细胞凋亡的机制,具体外源性凋亡通路有待进一步探讨。线粒体膜电位与线粒体内膜通透性相关,线粒体膜通透性增强是内源性凋亡起始的关键。本研究使用JC-1染料检测线粒体膜电位,详细分析了线粒体膜通透性在凋亡过程中的具体变化,证实PDCoV感染通过引起线粒体外膜通透性增强,使细胞色素C释放进入胞浆引起凋亡。有研究表明,冠状病毒在入侵宿主细胞时,通过S蛋白介导以膜融合方式将病毒基因释放入胞[33]。宿主细胞的内质网合成新的S蛋白,通过与其他病毒蛋白组装成为完整病毒粒子释放出胞,完成病毒复制过程。关于S蛋白的亚细胞定位与具体功能,目前研究还不是很透彻。在本研究中,我们首次证实PDCoV S蛋白定位于线粒体(图3A),这与我们对S蛋白的已有认知有所不同[33-34],推测PDCoV激活ST细胞线粒体凋亡与S蛋白合成相关,这可能是PDCoV凋亡诱导研究的一个重要线索,有待进一步证实。
[1] Fang PX, Fang LR, Ren J, et al. Porcine deltacoronavirus accessory protein NS6 antagonizes interferon beta production by interfering with the binding of RIG-I/MDA5 to double-stranded RNA. J Virol, 2018, 92(15): e00712–18.
[2] Woo PCY, Lau SKP, Lam CSF, et al. Discovery of seven novel mammalian and avian coronaviruses in the genus Deltacoronavirus supports bat coronaviruses as the gene source of Alphacoronavirus and Betacoronavirus and avian coronaviruses as the gene source of Gammacoronavirus and Deltacoronavirus. J Virol, 2012, 86(7): 3995–4008.
[3] Marthaler D, Jiang Y, Collins J, et al. Complete genome sequence of strain SDCV/USA/Illinois121/ 2014, a porcine deltacoronavirus from the United States. Genome Announc, 2014, 2(2): e00218–14.
[4] Le VP, Song S, An BH, et al. A novel strain of porcine deltacoronavirus in Vietnam. Arch Virol, 2018, 163(1): 203–207.
[5] Dong N, Fang LR, Zeng SL, et al. Porcine deltacoronavirus in mainland China. Emerg Infect Dis, 2015, 21(12): 2254–2255.
[6] Lee S, Lee C. Complete genome characterization of Korean porcine deltacoronavirus strain KOR/KNU14–04/2014. Genome Announc, 2014, 2(6): e01191-14.
[7] Ma YM, Zhang Y, Liang XY, et al. Origin, evolution, and virulence of porcine deltacoronaviruses in the United States. mBio, 2015, 6(2): e00064-15.
[8] Jung K, Hu H, Saif LJ. Porcine deltacoronavirus induces apoptosis in swine testicular and LLC porcine kidney cell linesbut not in infected intestinal enterocytes. Vet Microbiol, 2016, 182: 57–63.
[9] Hu H, Jung K, Vlasova AN, et al. Isolation and characterization of porcine deltacoronavirus from pigs with diarrhea in the United States. J Clin Microbiol, 2015, 53(5): 1537–1548.
[10] Norbury CJ, Hickson ID. Cellular responses to DNA damage. Annu Rev Pharmacol Toxicol, 2001, 41: 367–401.
[11] Golstein P. Cell death in us and others. Science, 1998, 281(5381): 1283.
[12] Kim Y, Lee C. Porcine epidemic diarrhea virus induces caspase-independent apoptosis through activation of mitochondrial apoptosis-inducing factor. Virology, 2014, 460–461: 180–193.
[13] Lee YJ, Lee C. Porcine deltacoronavirus induces caspase-dependent apoptosis through activation of the cytochrome C-mediated intrinsic mitochondrial pathway. Virus Res, 2018, 253: 112–123.
[14] Kroemer G, Galluzzi L, Brenner C. Mitochondrial membrane permeabilization in cell death. Physiol Rev, 2007, 87(1): 99–163.
[15] Garrido C, Galluzzi L, Brunet M, et al. Mechanisms of cytochrome C release from mitochondria. Cell Death Differ, 2006, 13(9): 1423–1433.
[16] Galluzzi L, Brenner C, Morselli E, et al. Viral control of mitochondrial apoptosis. PLoS Pathog, 2008, 4(5): e1000018.
[17] Yamamoto T, Yamada A, Yoshimura Y, et al. The mechanisms of the release of cytochrome C from mitochondria revealed by proteomics analysis. Yakugaku Zasshi, 2012, 132(10): 1099–1104.
[18] Danthi P. Viruses and the diversity of cell death. Annu Rev Virol, 2016, 3(1): 533–553.
[19] Rota PA, Oberste MS, Monroe SS, et al. Characterization of a novel coronavirus associated with severe acute respiratory syndrome. Science, 2003, 300(5624): 1394–1399.
[20] Zhong NS, Zheng BJ, Li YM, et al. Epidemiology and cause of severe acute respiratory syndrome (SARS) in Guangdong, People’s Republic of China, in February, 2003. Lancet, 2003, 362(9393): 1353–1358.
[21] Scobey T, Yount BL, Sims AC, et al. Reverse genetics with a full-length infectious cDNA of the Middle East respiratory syndrome coronavirus. Proc Natl Acad Sci USA, 2013, 110(40): 16157–16162.
[22] Yan R, Shen C, Lei L, et al. SARS-CoV infection induces apoptosis of Vero E6. Virol Sin, 2003, 18(6): 541–543 (in Chinese). 鄢然, 沈超, 雷磊, 等. SARS-CoV感染Vero E6细胞诱导细胞凋亡. 中国病毒学, 2003, 18(6): 541–543.
[23] Drosten C, Gunther S, Preiser W, et al. Identification of a novel coronavirus in patients with severe acute respiratory syndrome. N Engl J Med, 2003, 348(20): 1967–1976.
[24] Ksiazek TG, Erdman D, Goldsmith CS, et al. A novel coronavirus associated with severe acute respiratory syndrome. N Engl J Med, 2003, 348(20): 1953–1966.
[25] Eleouet JF, Chilmonczyk S, Besnardeau L, et al. Transmissible gastroenteritis coronavirus induces programmed cell death in infected cells through a caspase-dependent pathway. J Virol, 1998, 72(6): 4918–4924.
[26] Zhao Q, Chen XJ, Xing YL, et al. PEDV coronavirus induces apoptosis through activation of caspase-3 by papain-like protease. Chin J Biochem Mol Biol, 2015, 31(11): 1171–1178 (in Chinese).赵倩, 陈晓娟, 邢雅玲, 等. 猪流行性腹泻病毒通过病毒蛋白酶激活caspase 3诱导细胞凋亡. 中国生物化学与分子生物学报, 2015, 31(11): 1171–1178.
[27] Lin C, Gu JY, Wang HJ, et al. Caspase-dependent apoptosis induction via viral protein ORF4 of porcine circovirus 2 binding to mitochondrial adenine nucleotide translocase 3. J Virol, 2018, 92(10): e00238-18.
[28] Castedo M, Ferri KF, Blanco J, et al. Human immunodeficiency virus 1 envelope glycoprotein complex-induced apoptosis involves mammalian target of rapamycin/FKBP12-rapamycin-associated protein-mediated p53 phosphorylation. J Exp Med, 2001, 194(8): 1097–1110.
[29] Perfettini JL, Roumier T, Castedo M, et al. NF-κB and p53 are the dominant apoptosis-inducing transcription factors elicited by the HIV-1 envelope. J Exp Med, 2004, 199(5): 629–640.
[30] Prikhod’ko EA, Prikhod’ko GG, Siegel RM, et al. The NS3 protein of hepatitis C virus induces caspase-8-mediated apoptosis independent of its protease or helicase activities. Virology, 2004, 329(1): 53–67.
[31] Prikhod’ko GG, Prikhod’ko EA, Pletnev AG, et al. Langat flavivirus protease NS3 binds caspase-8 and induces apoptosis. J Virol, 2002, 76(11): 5701–5710.
[32] Lalier L, Cartron PF, Juin P, et al. Bax activation and mitochondrial insertion during apoptosis. Apoptosis, 2007, 12(5): 887–896.
[33] Li WT, Hulswit RJG, Kenney SP, et al. Broad receptor engagement of an emerging global coronavirus may potentiate its diverse cross-species transmissibility. Proc Natl Acad Sci USA, 2018, 115(22): E5135–E5143.
[34] Shang J, Zheng Y, Yang Y, et al. Cryo-electron microscopy structure of porcine deltacoronavirus Spike protein in the prefusion state. J Virol, 2018, 92(4): e01556–17.
Porcine deltacoronavirus induces mitochondrial apoptosis in ST cells
Shaoyong Jiao1, Cui Lin2, Liuyang Du1, Junli Liu1, Jinyan Gu1, and Jiyong Zhou2
1Institute of Immunology, Nanjing Agricultural University, Nanjing 210095, Jiangsu, China 2 Key Laboratory of Animal Virology of Ministry of Agriculture, Zhejiang University, Hangzhou 310058, Zhejiang, China
Porcine deltacoronavirus (PDCoV) is a newly emerging enteropathogenic swine coronavirus causing acute diarrhea and vomiting in pigs. The apoptosis of ST cells induced by PDCoV infection was studied in this research. In ST cells, caspase activity assay showed that the activity of caspase 3, caspase 8 and caspase 9 increased significantly with the infection of PDCoV, but not observed in UV irradiated PDCoV-infected cells, indicating that PDCoV infection activated both endogenous and exogenous apoptotic pathways in ST cells, and the induction of apoptosis depended on viral replication. To further investigate the endogenous apoptosis induced by PDCoV, cytochrome C and apoptosis-inducing factors in cytoplasm and mitochondria were detected. Compared with normal cells, the amount of cytochrome C released from mitochondria to cytoplasm increased significantly in PDCoV-infected cells, and the release increased with the prolongation of infection, while the apoptosis-inducing factor was always localized to mitochondria, suggesting that PDCoV induced apoptosis was initiated through caspase-dependent mitochondrial apoptosis pathway by promoting cytochrome C in the mitochondrial membrane gap into the cytosol. In conclusion, this study reveals the mechanism of PDCoV inducing apoptosis.
porcine deltacoronavirus, mitochondrial apoptosis, cytochrome C
December 10, 2018;
April 15, 2019
National Key Research and Development Program of China (No. 2016YFD0500102), the Priority Academic Program Development of Jiangsu Higher Education Institutions.
Jinyan Gu. Tel: +86-25-84396068-8041; E-mail: gjy@njau.edu.cn
国家重点研发计划(No. 2016YFD0500102),江苏高校优势学科建设项目资助。
2019-04-28
http://kns.cnki.net/kcms/detail/11.1998.Q.20190426.1620.001.html
10.13345/j.cjb.180512
焦少勇, 林翠, 杜柳阳, 等. 猪丁型冠状病毒诱导的细胞线粒体凋亡. 生物工程学报, 2019, 35(6): 1050–1058.
Jiao SY, Lin C, Du LY, et al. Porcine deltacoronavirus induces mitochondrial apoptosis in ST cells. Chin J Biotech, 2019, 35(6): 1050–1058.
(本文责编 郝丽芳)
