罕见大隐静脉血管平滑肌肉瘤一例及文献荟萃分析
2019-07-10王亚红陈跃鑫郑月宏
张 翔,王亚红,陈跃鑫,刘 暴,郑月宏
中国医学科学院 北京协和医学院 北京协和医院 1基本外科 2超声医学科 3血管外科,北京 100730
软组织肉瘤在恶性肿瘤中少见,起源于血管的平滑肌肉瘤则极为罕见,约占全部恶性肿瘤的1/10万[1]。血管平滑肌肉瘤好发于下腔静脉,其次是肾静脉、大隐静脉,总体5年生存率约25%~50%[2]。自1868年Aufrecht等[3]报道了首例大隐静脉(great saphenous vein,GSV)血管平滑肌肉瘤(leiomyosarcoma,LMS)至今,国内外文献仅报道41例。GSV-LMS临床表现酷似静脉炎,易误诊误治,且预后不明。北京协和医院于2017年12月25日至28日收治了1例大隐静脉血管平滑肌肉瘤,现结合文献进行荟萃分析,探讨该病的临床特点及诊治进展,以提高对该病的认识,减少误诊误治。
临床资料
患者,男,83岁,因发现右下肢肿物2年于2017年12月25日入院。2年前无意间发现右小腿内侧黄豆大小肿物,常搓揉,肿物表面皮肤逐渐发黑、发痒,体积逐渐增大。查体:右小腿内侧膝关节下方触及一肿物,大小约4 cm×3 cm,质硬,不可压缩,活动度小,伴压痛,表面及周围皮肤红肿。浅表淋巴结未及明显肿大。
辅助检查彩色多普勒超声示右下肢肿物处可探及扩张浅静脉回声(系大隐静脉小腿段主干局部扩张),其内见低回声,较宽处约1.7 cm,粗细不均,累及长度约7 cm,低回声形态不规则,内见蜂窝状无回声,彩色多普勒血流成像(color Doppler flow imaging,CDFI):内见丰富血流信号,可探及动脉及静脉频谱(图1)。考虑右下肢浅静脉内实性占位,不除外血管源性肿瘤。下腔静脉、髂总及髂内外静脉、盆腔静脉及下肢深静脉未见明显异常。胸部正侧位示右下肺片状阴影,左上肺小结节。心电图及术前常规化验未见异常。
治疗患者于2017年12月27日在局部麻醉下行右下肢肿物切除术。术中发现肿物来源于大隐静脉主干,大小约3 cm×4 cm×3 cm,大隐静脉内充填鱼肉状实性肿物,血运丰富,周围可见较多增生血管(图2)。游离肿物,上下游离与肿物相连血管至正常血管壁2~3 cm处切断结扎并完整切除肿物及周围部分脂肪组织,予蒸馏水浸泡创面。手术切口愈合I/甲。目前术后随访6个月,一般情况好,无局部复发迹象,胸部CT未见明显异常结节,肿瘤内科随诊。
病理检查肉眼可见部分区域呈囊壁状,切面灰白灰红、质硬。镜下可见肿瘤细胞呈梭形,束状排列,胞质丰富,嗜伊红,核异型性较大,考虑梭形细胞肿瘤(图2)。免疫组织化学结果显示CD31(血管+),CD34(血管+),F8-R(血管+),Desmin(+),Ki- 67(index 20%),SMA(+),AE1/AE3(-),Fli- 1(-),S- 100(-),SOX10(-),STAT6(-)。符合血管平滑肌肉瘤表现。

图1彩色多普勒超声示大隐静脉局部扩张,彩色多普勒血流成像可见丰富血流信号,探及动静脉频谱
Fig1Color Doppler ultrasonography shows the locally dilated great saphenous vein,color Doppler flow imaging shows abundant blood flow signals,with visible arteriovenous spectrum
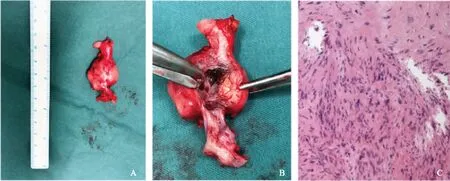
A.切除的肿瘤标本;B.切开可见肿物来源于静脉壁,大小约3 cm×4 cm×3 cm;C.病理显示梭形肿瘤细胞(HE,×200)
A.resected tumor;B.a solid mass sized 3 cm×4 cm×3 cm arising from the venous wall;C.spindled cells in the microscopic specimens(HE,×200)
图2手术标本及病理组织切片
Fig2Surgical specimen and pathological section
文献荟萃分析资料
在中国知网、万方数据库以“大隐静脉血管平滑肌肉瘤”为关键词检索2000~2018的文献报道;在MEDLINE数据库中以“leiomyosarcoma of the great saphenous vein”、“ leiomyosarcoma of the long saphenous vein”和“leiomyosarcoma of saphenous vein”为关键词检索1970至2018年的外文文献,并复习检索获得文献的参考文献,排除重复发表或病理诊断不明的文献,经筛选后共纳入1篇中文和38篇英文文献报道的病例41例,与本文报道的1例一起进行荟萃分析,共计42例(表1)。采用SPSS 23.0软件进行统计学分析,计量资料用平均值±标准差表示,利用Kaplan-Meier法进行生存资料分析。
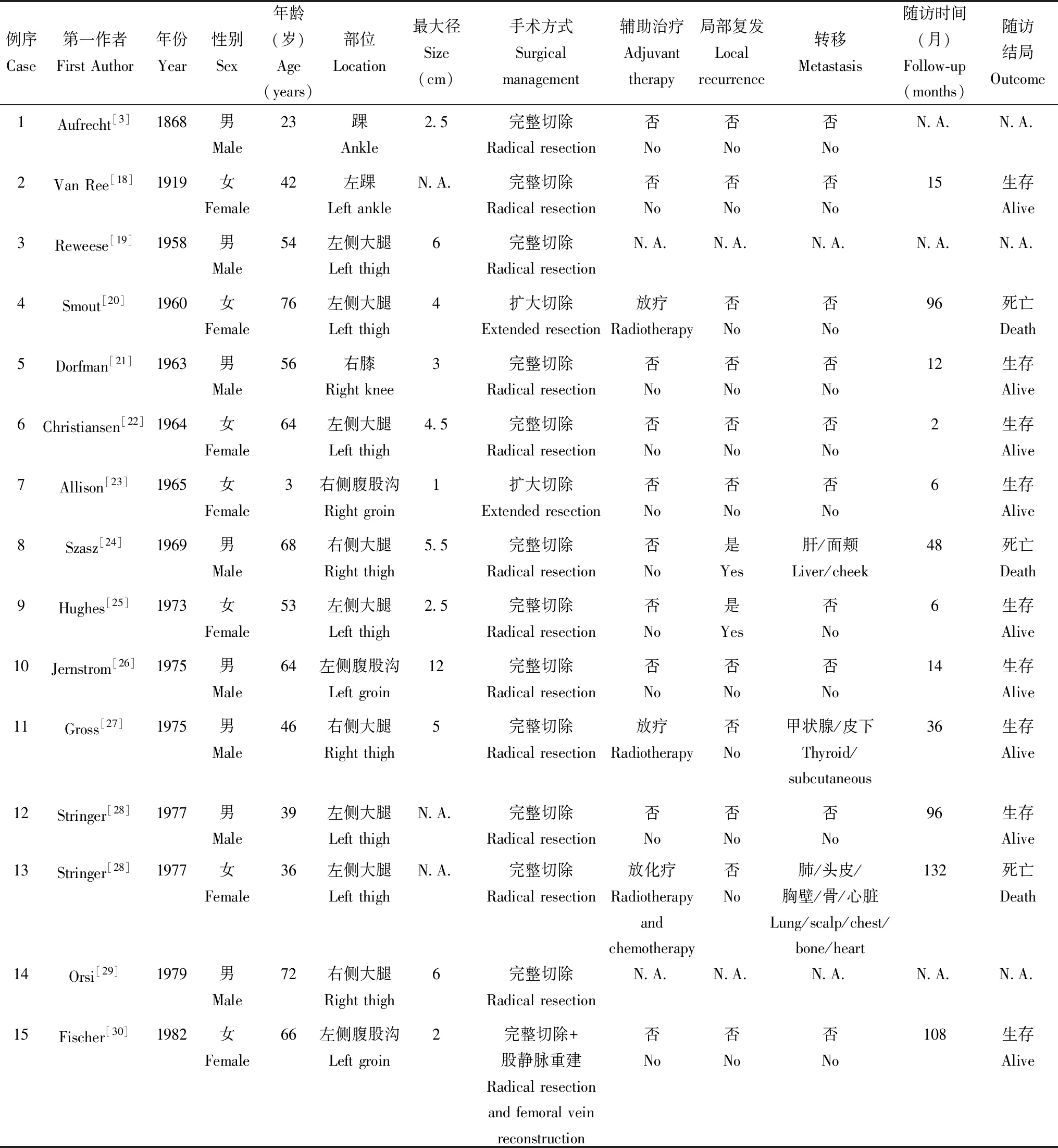
表1 42例大隐静脉血管平滑肌肉瘤患者的一般资料Table 1 Summary of 42 cases of leiomyosarcoma of the great saphenous vein described in the literature

续表1

续表1
N.A.:资料不详
N.A.:not applicable
一般情况42例患者中,男22例,女20例,男女比为11∶ 10,发病年龄2~85岁,平均年龄(55.9±18.0)岁,中位年龄59.5岁。
临床表现32例(76.2%)患者因发现肿块就诊,伴或不伴疼痛;5例(11.9%)伴发局部水肿;4例(9.5%)因下肢肿胀起病。发病部位以大腿为主,共24例(57.1%);腹股沟7例(16.7%);踝部3例(7.1%);小腿4例(9.5%);4例未报道具体部位。18例(42.9%)患者在初诊时发生误诊,最常见误诊为静脉内血栓形成(6例),其次为皮下肿物(5例)和淋巴结(4例)。
辅助检查常用的影像学检查均可用于诊断,17例(40.5%)患者在术前完善影像学检查,超声检查10例,MRI检查9例,CT检查4例,其他辅助检查包括静脉造影、穿刺活检。
治疗所有患者均接受了手术治疗,其中35例(83.3%)完整切除,7例(16.7%)行扩大切除,3例(7.1%)因肿瘤位于股隐静脉交界而同期行静脉血管重建术。切除肿物最大径为(4.25±2.14)cm。15例(35.7%)患者在术后进行了辅助治疗,单纯放疗10例,单纯化疗3例,放疗联合化疗2例。其中,3例患者因术后远处转移、1例因术后复发、1例因病理为高级别肿瘤而行辅助化疗。化疗方案主要涉及阿霉素、异环磷酰胺、达卡巴嗪等化疗药物(表2)。

表2 5例大隐静脉血管平滑肌肉瘤化疗患者的化疗方案Table 2 Chemotherapy regimens of the 5 reported GSV-LMS cases
预后35例(83.3%)患者术后进行了随访,中位随访时间12个月,随访5年以上的有9例(21.4%);7例(16.7%)患者因死亡而随访终止,其中6例(14.3%)因本病死亡,1例(病例4)于术后8年自然死亡;7例(16.7%)患者失访。3年及5年总体生存率分别为86.1%和77.5%(图3)。4例(9.5%)患者术后出现原位复发。9例(21.4%)出现远处转移,最常见的转移部位是肺(7例),其次是肝(2例),其他转移部位包括骨、脑、甲状腺等脏器。
讨 论
据文献统计,平滑肌肉瘤占所有软组织肉瘤的6%,而根据其组织来源,平滑肌肉瘤可分为皮肤、软组织和大血管等3个亚类,大、中静脉的血管平滑肌肉瘤占比不到2%[4]。下腔静脉是静脉平滑肌肉瘤最好发部位,大隐静脉虽然是下肢血管中最常见的累及部位,但迄今国内外文献报道也仅42例,且均为个案报道。该病起病隐匿,病因不明,缺乏可靠肿瘤标记物,诊断困难。肿瘤组织起源于静脉血管壁中层平滑肌,可在血管腔内延伸,也可从血管腔内向血管腔外生长[5]。在下腔静脉(inferior vena cava,IVC)平滑肌肉瘤的报道中,女性发病占76.5%,较男性高发[6],而在GSV平滑肌肉瘤的病例中,男女发病率约为1∶ 1。
该病缺乏典型症状与体征,常表现为缓慢生长的皮下肿物,当肿瘤堵塞血管腔或继发血栓时可伴有局部静脉曲张、静脉炎而出现疼痛、瘙痒、肢体肿胀等表现。考虑GSV平滑肌肉瘤时需同以下疾病相鉴别:(1)浅静脉血栓:血栓性浅静脉炎是大隐静脉曲张常见的并发症,多有长期站立或强体力劳动史,下肢静脉迂曲扩张,静脉回流压力增高,可出现皮肤硬结及色素沉着;(2)脂肪瘤等皮下肿物:通常生长缓慢,活动度大,质地较软,边界清,常通过手术切除后病理确诊。以本文报道为例,逐渐增大的右下肢痛性肿块,极易误诊为大隐静脉曲张合并血栓性浅静脉炎而出现误诊,甚至误治从而引发更为严重的后果,本组病例中42.9%发生误诊。上述疾病在临床表现与查体上难以区分,应优先考虑进一步完善无创检查,在此基础上做出合理的初诊判断。
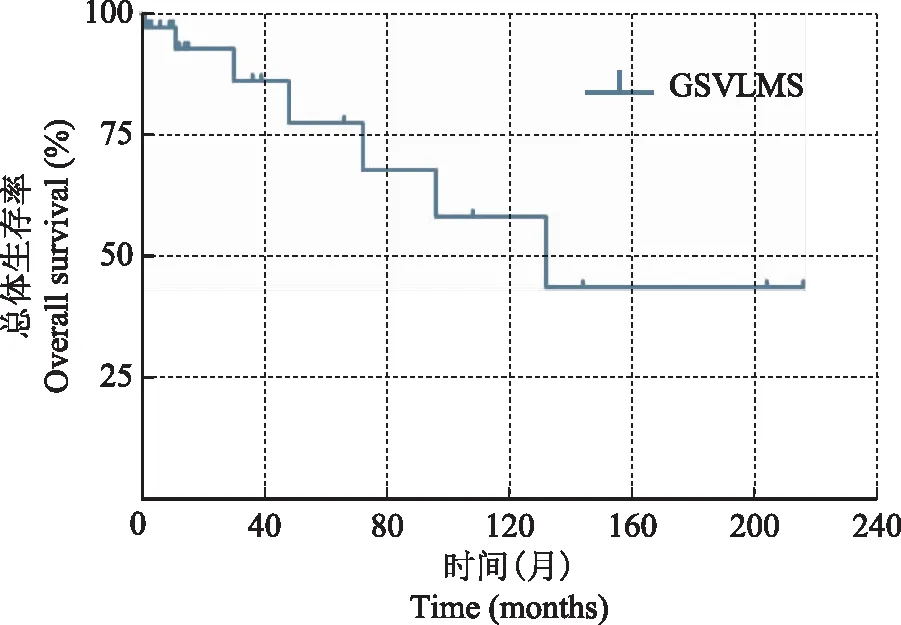
图3Kaplan-Meier生存曲线:累积生存率(随访35例,死亡7例)
Fig3Kaplan-Meier curve:cumulative survival rate
早期报道中静脉造影是该病术前诊断的有效方法[7- 8],随着无创诊断技术的逐渐发展和普及,超声、CT、MRI等影像学检查已经能为外科手术提供更多有效而详实的资料。彩色多普勒超声是常用的辅助检查手段,可显示血管腔内的低回声实性占位,结合CDFI,进一步了解肿瘤内血管的分布情况及丰富程度,有助于肿物良恶性的初步鉴别。在本组最近20年的报道中,超声是已发现下肢肿物时的重要初筛检查,GSV平滑肌肉瘤的典型超声表现为不能被探头压扁的血管腔内不规则低回声,但因难以和血栓鉴别而易被忽视。超声引导下细针穿刺可以尽量在术前明确细胞病理学性质,但因肿物来源不清且毗邻血管,存在穿刺假阴性可能[9]。MRI在GSV平滑肌肉瘤的诊断中具有重要地位,可辨别肿瘤起源于血管还是周围组织,肿瘤在T1WI表现为等或稍低信号,T2WI常表现为高信号,在T2压脂序列上可见高信号[10- 11]。本组病例中9例患者完善MRI以基本明确病变累及范围,以便在术前进一步确定手术切除方案。无论在术前或术后,若考虑病变为静脉源性恶性肿瘤,应尽快完善CT检查或PET/CT,尤其是胸部CT,明确是否已经存在远处转移灶,便于评估下一步治疗方案。
手术完整切除是目前治疗GSV平滑肌肉瘤最有效的方式,为减少局部复发,通常切除至受累静脉缘远近段各2~3 cm,尽量获得足够的阴性切缘,肿瘤与周围组织黏连紧密时,可根据术中情况扩大切除范围,包括瘤周脂肪筋膜、皮下、皮肤组织及区域淋巴结,必要时行静脉血管重建或自体静脉移植[1]。IVC平滑肌肉瘤好发于下腔静脉中下段,术中常需行直接血管修补或人工血管移植,在GSV平滑肌肉瘤的报道中仅3例(7.1%)术中行血管重建。目前尚无针对静脉平滑肌肉瘤放化疗有效性的临床试验,术后辅助放化疗的指征和疗效尚不确切,为了预防局部复发和转移,对于高级别肿瘤经验上常进行术后辅助放化疗,而本组中已发生复发和转移的病例亦是辅助化疗适应证之一,但术后接受辅助治疗的病例数尚有限。我国软组织肉瘤专家共识中指出,瘤体大、高级别肿瘤、未达安全外科边界或二次复发手术后的Ⅱ~Ⅲ期软组织肉瘤患者建议术后辅助放化疗[12]。
IVC平滑肌肉瘤总体预后较差,回顾性分析结果显示其5年生存率25%,5年无瘤生存率20%[13- 14]。本研究中,GSV平滑肌肉瘤的5年总体生存率为77.5%,远期预后情况不明,仅9例(22.5%)患者的随访时间超过5年。美国癌症联合会(American Joint Committee on Cancer,AJCC)提出的AJCC分期是目前应用较多的软组织肉瘤分期,依据是组织学分级、肿瘤大小、浸润深度、区域淋巴结侵犯和远处转移情况[15]。Humphrey等[16]认为多数GSV平滑肌肉瘤患者的AJCC分期处于ⅠA期或ⅡA期。通常认为大隐静脉平滑肌肉瘤相对表浅,进展缓慢,但其生存时间与肿瘤分期、病变位置、病变程度和治疗方案仍密切相关[17]。本组13例(31.0%)GSV平滑肌肉瘤患者出现复发或远处转移,可转移至肺、肝等脏器,Cangiano等[1]推测超过半数的静脉平滑肌肉瘤患者在开始诊治时就可能已经发生了转移。
综上,GSV平滑肌肉瘤是一种极为罕见的静脉源性恶性肿瘤,诊断困难,易与常见的血管外科疾病相混淆而发生误诊误治,临床医生需加强重视并提高警惕。本病可出现复发和转移,并影响预后,应努力提倡开展多学科诊疗模式,联合血管外科、超声医学科、放射科、放疗科、肿瘤内科、病理科专家的优势及专长,结合患者的个体化特征,才能获得诊断和治疗的最佳方案。
