SMC蛋白结构和功能的研究进展
2019-07-08计文陶权丹王时超华杰刘康伟张建祥于梅梅于恒秀
计文 陶权丹 王时超 华杰 刘康伟 张建祥 于梅梅 于恒秀
摘要:染色体不仅仅由DNA构成,还包含一些使染色体能具有特定形态特征以及在基因表达和基因组稳定性中起作用的蛋白。而使染色体能具有特定形态特征的首要物质就是染色体结构维持蛋白(structural maintenance of chromosomes,SMC)复合体。SMC复合体包含凝聚蛋白(condensin)、黏结蛋白(cohesin)和SMC5-SMC6复合体,是染色体的重要组分。SMC蛋白的表达依赖于ATP的水解以及DNA的拓扑作用。SMC复合体参与了多重染色体行为,其中尤为显著的是染色体集缩和姐妹染色单体的黏着。此外,SMC复合体在DNA修复中也有重要的作用。近年来,随着分子生物学研究技术的发展,对该类复合体的结构、功能及作用机制等方面已有较多研究并取得一些重要进展,本文对SMC蛋白结构和功能的研究进展做一综述。
关键词:染色体结构维持蛋白;凝聚蛋白;黏结蛋白;SMC5-SMC6复合体
中图分类号: S188 文献标志码: A 文章编号:1002-1302(2019)10-0032-05
构成有机体染色体组分的DNA分子通常来说比有机体本身还要长,例如在一个人类细胞中大约有4 m长的DNA。在细胞分裂的准备过程中,DNA被进一步压缩而使有丝分裂时期染色体出现一定形态特征。但DNA是如何被包裹在细胞这样小的结构中的,目前尚不清楚。染色体不仅仅由DNA构成,还包含一些在基因表达和基因组稳定性中起作用的蛋白。而使染色体能具有特定形态特征的首要物质就是染色体结构维持蛋白(structural maintenance of chromosomes,SMC)复合体,这使得SMC蛋白结构和功能的研究具有重要意义。
本文重点关注SMC复合物在染色体集缩、姐妹染色单体黏着以及DNA修复中的功能。
1 SMC蛋白研究简史
1991年NiKi等首次在大肠杆菌mukB突变体中发现了1个参与染色体分离的SMC蛋白家族成员MUKB[1]。MUKB是第一个被发现编码SMC蛋白的基因。1993年,Strunnikov等克隆了1个能够维持微染色体稳定性的芽殖酵母基因,并命名为SMC1,由此发现了具有相似结构的蛋白质SMC1[2](图1)。之后在多种生物体的基因组中发现了类似的编码SMC1蛋白的基因,如裂殖酵母中的2个编码SMC蛋白的基因cut3+和cut14+,在两者的突变体中均观察到染色体的凝聚和分离发生异常[3]。
同一时期内,对脊椎动物染色体的生化分析也发现了相似的蛋白质。在非洲爪蟾的卵子提取试验中发现2个染色体相关蛋白XCAPC和XCAPE(Xenopus chromosome-associated polypeptide),也被称为SMC2和SMC4。SMC2/SMC4复合体在染色体集缩时发挥作用[4]。在鸡细胞的染色体中发现了一种135 ku的蛋白质ScⅡ(也称作SMC2),是XCAPE的同源蛋白[5]。此外,在芽殖酵母smc2突变体中发现染色体集缩行为的缺失[6]。
在研究早期人们就认识到SMC蛋白的功能不仅仅涉及染色体形态以及分离。秀丽隐杆线虫性染色体剂量补偿的研究表明,编码SMC蛋白的dpy-27基因突变会導致胚胎中的X染色体不能下调基因表达[7]。此外,裂殖酵母中的辐射敏感蛋白RAD18,被证实是SMC蛋白的一个独特亚组,现在称作SMC5和SMC6[8]。
真核生物中SMC蛋白两两之间会形成3种异二聚体:以SMC2-SMC4为核心形成凝聚蛋白(condensin)复合体[9]、以SMC1-SMC3为核心形成黏结蛋白(cohesin)复合体、SMC5-SMC6则是多亚基DNA修复复合物的基础结构。这3种复合物对真核生物来说都是必需的,它们在部分功能上存在重叠,如黏结蛋白参与染色体集缩,黏结蛋白和凝聚蛋白均在DNA修复中发挥作用[10]。
黏结蛋白复合体能够介导姐妹染色单体的黏着,这一发现揭示了SMC复合体在真核生物染色体分离中起到重要功能。姐妹染色单体产生于S期,通过黏结蛋白维系在一起直到有丝分裂期[11]。黏结蛋白使得姐妹染色单体能够进行识别配对,并且在纺锤丝的牵引下在赤道板2侧进行排列。SCC1(sister chromatid cohesion 1)亚基水解使得黏结蛋白从染色体上脱离,从而诱发有丝分裂后期的开始[12-14]。以上这些功能以及它们在整个细胞周期中的其他许多作用,确立了SMC复合体在生物学中的重要地位。
2 SMC蛋白及其复合体的基本结构
SMC蛋白在进化上是保守的,从细菌到人体中的SMC蛋白都具有相似的基本结构,含有5个不同的结构域(图1)。SMC蛋白由1 000~1 400个氨基酸组成,其N-端结构域(约含160个氨基酸)和C-末端结构域(约含150个氨基酸)高度保守,分别含有Walker A和Walker B结构域,中间是中度保守的非螺旋的“铰链”(hinge)结构域,由2个长的卷曲螺旋分别与N端和C端连接,这2个长的卷曲螺旋也被称为SMC蛋白的2条臂[15]。
SMC蛋白复合体包含SMC蛋白二聚体、1种Kleisin蛋白以及2种HEAT蛋白。首先由单个SMC分子以分子中央的绞链(Hinge)区为中点自折叠,绞链区2侧的长螺旋(coiled-coil)区相互绞结形成长臂,N、C末端相互结合形成ATP酶区的头部;自折叠的2个分子通过绞链区相互结合,另一端的2个ATP酶区头部与非SMC蛋白亚基结合,从而形成了一个环形或“V”字形的独特结构。在原核生物中,由一种SMC同源蛋白形成同二聚体,再结合2个Kleisin同源蛋白ScpA与2个ScpB蛋白,形成唯一的一种复合体[16]。在真核生物中,以SMC1-SMC3异二聚体为核心结合Kleisin蛋白(Scc1)和HEAT重复蛋白(Scc3、Psd5)构成黏结蛋白复合体(脊椎动物中SMC1有2个亚型:SMC1α和SMC1β,可形成2种黏结蛋白复合体,分别在有丝分裂和减数分裂中行使功能[17]);以SMC2-SMC4异二聚体为核心结合特异的Kleisin蛋白和HEAT蛋白,形成凝聚蛋白复合体,且根据结合的非SMC蛋白的不同可分为Ⅰ型和Ⅱ型复合体[18];以SMC5-SMC6异二聚体为核心结合Nse蛋白(Nse1-Nse6)则形成第三类复合体——SMC5-SMC6复合体[19]。
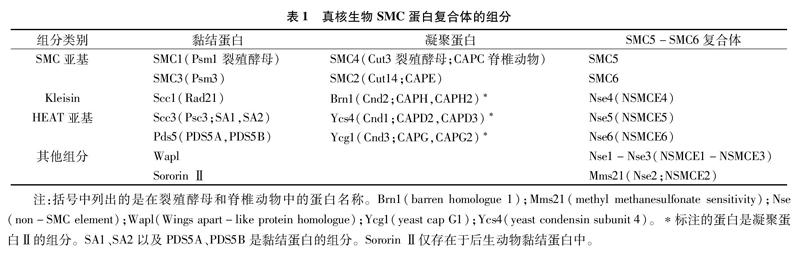
SMC二聚体的结构在绝大多数情况下是对称的,但在黏结蛋白以及细菌的SMC复合体中观察到Kleisin蛋白与SMC头部存在非对称结合。Kleisin蛋白的N末端形成螺旋结构与其中一个SMC蛋白的头部结合;C末端则附着到另一个SMC蛋白头部[20-22]。HEAT重复蛋白则是聚集在Kleisin的周围,目前已知HEAT能够与铰链区互作。表1列出了真核生物SMC复合体的主要结构组分。
标注的蛋白是凝聚蛋白Ⅱ的组分。SA1、SA2以及PDS5A、PDS5B是黏结蛋白的组分。Sororin Ⅱ仅存在于后生动物黏结蛋白中。
已有的研究表明,SMC复合体与DNA分子的相互作用最可能的模式是环抱模型(embrace model;the ring model),该模型认为黏结蛋白通过拓扑环绕结合到DNA。黏结蛋白在细胞内拓扑环绕到微染色体(minichromosomes),而在体外黏结蛋白依赖于ATP水解从而加载到DNA上[23-24]。与之相似,凝聚蛋白和SMC5-SMC6复合体在体内也是与微染色体进行拓扑结合,而细菌的SMC复合体是与其环形染色体进行拓扑性结合[25-27]。拓扑结构曾被认为对于SMC复合物功能的发挥至关重要。黏结蛋白完整的环形结构能够维持姐妹染色单体的黏着,在细胞分裂后期Scc1的脱离使得环形结构打开。凝聚蛋白完整的拓扑结构能够参与芽殖酵母染色体的分离。拓扑模型能够很好地解释SMC复合物在染色体中的功能。但也有试验表明,复合体中的蛋白分子能够与DNA链直接相互作用。SMC分子的ATP头部区域可以与DNA链直接结合,一个复合体的2个SMC分子头部分别结合2条DNA链从而将姊妹染色质的2条链或者同一染色质不同区段的2段DNA拉在一起[28]。但是这2种模型均未能解释SMC复合体是通过单个复合物分子行使作用 还是通过2个或多个复合物分子之间相互聚合来行使功能。
3 黏结蛋白的生物学特征与功能
黏结蛋白复合体最早发现于酵母细胞,该蛋白复合体含有4个亚基:即1对SMC蛋白Smc1、Smc3以及2个非SMC蛋白Rad21/Scc1和Scc3/SA构成,SA蛋白在脊椎动物体细胞中又分为SA1以及SA2这2类。其中2个SMC蛋白形成1个反向二聚体,该二聚体的起始域与Rad21蛋白互作,完成封闭环结构,Rad21再与SA结合,从而形成了完整的黏结蛋白复合体[29](图2)。黏结蛋白复合体参与姐妹染色单体的黏着、DNA修复以及细胞周期中检查点(checkpoint)的活化。
黏结蛋白在G1期加载到染色质上,Scc2和Scc4组成的蛋白复合体作为加载因子,在S期参与姐妹染色单体的黏着,对M期染色体的正确分离也有重要的作用[30]。黏结蛋白黏着力的形成需要激活“形成因子”(establishment factor)Eco1。绝大多数的黏结蛋白、相关蛋白(Wapl、Pds5等)以及加载因子(Scc2/Scc4)都在细胞分裂前期时从染色体臂上被移除,其余附着在着丝粒上的黏结蛋白在后期被去除。黏结蛋白复合体可以有效防止姐妹染色單体的提前分离,因而在维持染色体稳定性方面具有重要意义。黏结蛋白在细胞分裂过程中的机制尚不明了,但普遍认为其功能的发挥依赖于多个相关蛋白的协调作用。
关于黏结蛋白维持染色质稳定的机制,研究者主要提出了3种模型:单环模型(one ring model)、双环模型(two ring model)以及多杆状模型(multimeric rod-shaped model)[31]。单环模型认为,黏结蛋白将2个10 nm长的姐妹染色单体纤维捕获在1个三角形的环形结构中;双环模型提出,1个黏结蛋白环绕1条姐妹染色单体,在DNA复制时通过Irr1/Scc3将2个环联结在一起[32];杆状结构是由多个黏结蛋白分子之间相互作用形成,SMC在杆状结构的其中一端,而姐妹染色单体处于另一端[33]。
在人类细胞以及酵母细胞中,黏结蛋白复合体依赖H2A磷酸化富集在DNA双链断裂(DSB)位点附近[34]。H2AX对于DNA修复蛋白的聚集以及稳定性具有很重要的作用。随后,其他的DNA损伤调控子,比如MDC1以及53BP1被招募到损伤位点,进一步增强DNA损伤信号[35]。发生DNA损伤后,SMC1和SMC3通过ATM进行磷酸化,细胞的存活率降低并且染色体畸形率升高。同时SMC1和SMC3磷酸化会导致S期及G2/M期检查点功能缺失[36],有研究者提出,与黏结蛋白在DNA修复中的功能不同,它们对于检查点的作用独立于黏结蛋白自身拥有的黏着属性[36]。而SMC1和SMC3只有作为黏结蛋白复合体的亚基时,它们才能够进行磷酸化。
4 凝聚蛋白的结构与功能
大多数的真核生物具有2种凝聚蛋白,凝聚蛋白Ⅰ和凝聚蛋白Ⅱ,而原核生物和古细菌只表达一种SMC蛋白,具有原始形式的凝聚蛋白。在芽殖酵母和裂殖酵母中只发现了凝聚蛋白Ⅰ。果蝇中存在2种凝聚蛋白,但是果蝇的凝聚蛋白Ⅱ中缺少CAP-G2亚基。目前为止尚未发现只拥有凝聚蛋白Ⅱ的生物。
在真核生物中,以SMC2-SMC4异源二聚体为核心与3种非SMC蛋白一起构成5个亚基的凝聚蛋白复合物,集缩素在有丝分裂染色体集缩中发挥重要作用[3](图3)。
凝聚蛋白最早发现于蟾蜍卵提取物中,免疫试验证明在无细胞系统(cell-free system)中该蛋白复合物是染色体集缩必需的活性复合物,因此也被称为集缩蛋白,其核心组分是SMC2和SMC4蛋白。目前已有充足的证据表明凝聚蛋白参与染色体集缩。
爪蟾的凝聚蛋白复合体含有2个SMC家族蛋白,XCAP-C 以及XCAP-E,另外还有3个非SMC蛋白XCAP-D2、XCAP-G 和 XCAP-H[37]。 将爪蟾精子DNA添加到爪蟾卵细胞提取物中,精子DNA能装配成集缩的有丝分裂染色体。如果爪蟾卵细胞中凝聚蛋白发生异常或缺失,那么染色体会解集缩。因此凝聚蛋白不仅参与染色体的集缩,同时也在集缩状态维持方面发挥功能。
芽殖酵母和裂殖酵母中的凝聚蛋白亚基十分保守,是细胞存活的必需物质,如果其中凝聚蛋白亚基发生突变,染色体不能正常集缩,这些异常细胞在核分裂之前完成细胞质的分裂,有丝分裂细胞从而被一分为二。在这种细胞中观察到团在一起的DNA,即染色体不能正常分开。酵母的原位杂交试验发现,SMC蛋白亚基突变体中有丝分裂染色体不能实现正常的集缩状态[37]。近年来有研究发现,裂殖酵母核仁蛋白Dnt1通过调控凝聚蛋白实现抑制姐妹染色体的错误分离。为了保证姐妹染色体的对称分离,每条姐妹染色体的动粒体必须与分别来自两极的相同数量的纺锤体微管连接,而当1条姐妹染色单体同时与两极的纺锤体微管连接时,称这种现象为“merotelic attachment”。在酵母dnt1突变体中,染色体凝聚蛋白复合体组分Cut14的蛋白水平下降,而着丝粒区的凝聚蛋白也会主动抑制姐妹染色体的“merotelic attachment”。因而研究人员推测核仁蛋白Dnt1可能是通过调控位于着丝粒区的凝聚蛋白来抑制姐妹染色体的“merotelic attachment”,从而保证姐妹染色体的对称分离[38]。
线虫中Smc2型蛋白MIX-1纯合突变体的第2代中100%表现为胚胎致死,这些胚胎发生各种染色体畸变,最普遍的是在分裂后期出现染色体桥的现象。果蝇中凝聚蛋白的亚基蛋白DmSmc4发生突变后,大部分细胞在分裂后期或末期出现染色体桥[39]。在鸡DT40细胞中敲除凝聚蛋白亚基ScⅡ/Smc2之后,有丝分裂中染色体的集缩发生滞后,即使在中期可恢复成正常水平,但却破坏了染色体的结构完整性。
在植物中也发现存在SMC蛋白,在拟南芥中有2个编码SMC2型蛋白的基因AtCAP-E1和AtCAP-E2,这2个基因在功能上存在重复[40]。Liu等利用拟南芥种子发育过程中出现有丝分裂阻断现象的突变体,从中鉴定出titan突变体,并且发现了编码AtCAP-E1的TTN3。研究者推测titan突变体中出现的核仁异常增大现象可能是由凝聚蛋白功能的缺失引起的。在另外的研究中发现AtCAP-E1能够与酵母的 Smc2-Δ6突变体实现功能互補。这些试验均表明AtCAP-E1参与了拟南芥中染色体的集缩。
5 SMC5-SMC6复合体
SMC5-SMC6构成的复合体是真核生物必需的SMC复合体成员之一。因为能够促使重组中间体的分离,所以SMC5-SMC6在DNA修复方面有着突出的作用。SMC5-SMC6复合体最初在裂殖酵母以及芽殖酵母SMC6同系物的分离试验中被发现,分别是RAD18以及RHC18。之后在人类细胞中被定义为SMC5以及SMC6。目前SMC5-SMC6复合体在生物体中真正必要的功能尚不清楚。最近的研究发现,SMC5-SMC6复合体在有丝分裂的G2期具有重要功能[41]。有观点认为 SMC5-SMC6复合体的缺失会导致复制后期发生异常[42]。SMC5-SMC6复合体也在DNA的拓扑结构中发挥作用[43]。
SMC5-SMC6复合体与黏结蛋白及凝聚蛋白有着相似的结构,拥有一个SMC二聚体,同时与kleisin紧密相连。其HEAT重复亚基Nse5和Nse6在芽殖酵母中是必需的,但在裂殖酵母中却可有可无。与前2种SMC复合体不同的是,SMC5-SMC6的kleisin蛋白还与Nse1及Nse3构成的二聚体联结,这种结构与原核生物SMC复合体亚基MukE和ScpB中二聚体的构造十分相似(图4)[44]。这表明原核生物SMC复合体与真核生物SMC5-SMC6复合体之间可能具有相似的功能。Nse3亚基能够连接到DNA从而促使SMC5-SMC6复合体加载到染色体上[45]。SMC5-SMC6还有个独特的特征,其Nse2拥有一个叫做SUMO连接酶的亚基,该亚基作用于SMC5的铰链区(coiled-coil),但SUMO连接酶的活性对于SMC5-SMC6复合体功能的发挥而言并非必要。与之相似,Nse1是复合体的必需结构,但是Nse1的亚基泛素连接酶是否活化对于复合体并无影响[46]。SUMO以及泛素连接酶的活化可以响应外源的DNA损伤。目前已经证实DNA修复时需要大量的泛素作为底物。
DSB可以发生于DNA复制期,或者暴露在造成DNA损伤的因素下。DSB的正确修复是细胞存活以及基因组稳定性的基础。真核生物细胞主要有2种DSB修复机制:NHEJ(non-homologous end-joining)和HR(homologous recombination)。NHEJ途径是将断裂的DNA末端直接重新连接,而HR先要搜索到相似的序列,以此作为模板来修复断裂位点。在酵母以及哺乳动物细胞中,同源重组优先使用完整的姐妹染色单体作为DSB修复模板。DNA损伤的检测可以活化DNA修复路径以及检查点,以此来为修复争取到充足的时间。这些损伤响应必须相互协同来确保细胞周期的暂停,直到修复完成[47]。
SMC5-SMC6复合体可以被招募到DSB位点,从而参与同源重组修复[48]。SMC5-SMC6突变体中各种DNA损伤的修复过程都会出现异常。正常细胞中只有很少的SMC6结合到染色质上,而一旦DSB产生,断裂位点附近区域结合的SMC6数目有显著提升。除了SMC5-SMC6复合体,黏结蛋白和凝聚蛋白也会响应DNA损伤。黏结蛋白和SMC5-SMC6聚集在DSB位点作为DNA损伤响应的一部分[49-51]。
最近的研究表明,SMC5-SMC6复合体在减数分裂过程中也有一定的功能。减数分裂中的重组事件需要SMC5-SMC6复合体的参与。当减数分裂重组中间体不能正常地形成交叉或非交叉时,会出现异常的联结分子结构(joint molecules,JMs),这些JMs有可能会阻碍染色体分离[52]。RecQ家族的DNA解旋酶Sgs1能够限制JM结构的形成,结构选择性核酸酶Mus81-Mms4、Slx1-Slx4以及Yen1也可以参与消除JMs。在芽殖酵母中,SMC5-SMC6复合体通过2种机制来抵消JMs的影响:通过破坏SEI(Single End Invasions)中间体的稳定来预防JMs的产生;促进JM的分解[53]。
