Periostin对心肌梗死后中性粒细胞浸润及心肌修复的调控作用研究
2019-07-06祝双华廖延姜美花詹宇婷彭朝权
祝双华 廖延 姜美花 詹宇婷 彭朝权


【摘要】目的探讨心肌梗死后periostin对心功能的影响及其是否通过调控中性粒细胞发挥作用,为临床治疗提供一定理论基础。方法分别取正常野生型(WT)和periostin敲除(periostin-/-)C57小鼠各60只,通过心脏左前降支永久结扎的方式制备心肌梗死模型,在心肌梗死前及心肌梗死后3周检测2组小鼠心功能指标,2,3,5-氯化三苯基四氮唑(TTC)染色检测组织形态学变化,并记录2组小鼠生存情况;在心肌梗死后第1、3日通过流式方式检测2组小鼠心肌梗死区中性粒细胞聚集情况。结果心脏彩色多普勒超声显示心肌梗死前2组小鼠的LVEF、左心室缩短分数(LVFS)、左心室收缩末容积(LVESV)、左心室舒张末容积(LVEDV)比较差异均无统计学意义(P均> 0.05),而心肌梗死后3周periostin-/-f LVEF及LVFS高于WT组(P均<0.01),LVESV及LVEDV均低于WT组(P均<0.05)。TTC染色示periostin-/-组梗死灶面积较WT组更小(t=5.817、P<0.05)。Periostin子组的生存率高于WT组(log-rank P=0.046)。流式结果显示心肌梗死后第1日periostin'组心肌梗死区中性粒细胞数量多于WT组(t=5.365,P<0.01),但在第3日少于WT组(t=2.548、P<0.05)。结论心肌梗死后periostin可以抑制中性粒细胞进人梗死区清除坏死心肌,不利于后续心脏的修复以及心功能的改善。
【关键词】心肌梗死;Periostin;中性粒细胞;心肌修复
冠状动脉粥样硬化性心脏病(冠心病)作为目前多发、常见的心脏疾病,已然成为人类健康的一个重要负担。其中,AMI最为凶险,致死致残率最高,并呈现逐渐年轻化的趋势[1-2]。高血压病、糖尿病、抽烟、过度饮酒等均为冠心病的高危因素[3-4]。虽然药物和介人治疗很大程度降低了心肌梗死的致死率,但是在心肌梗死后,冠状动脉血流的急剧减少和(或)中断使得该动脉供应的心肌组织严重缺血缺氧,导致心肌细胞的大量坏死,最终引起心力衰竭等严重后果[5-7]。坏死的心肌组织促使免疫炎症反应机制的启动,大量免疫细胞向梗死区聚集,以清除坏死细胞[8-9]。
Periostin是一种细胞外基质蛋白,有研究表明,其与风湿病、哮喘、肿瘤等多种疾病有关,在正常组织中没有明显表达,当出现组织损伤特别是炎症细胞聚集时表达量明显升高[10-12]。心肌梗死早期发生急性炎症反应加重了心脏组织的缺氧损伤使梗死灶面积进一步扩大,然而,越来越多研究显示心肌梗死早期伴随的急性炎症反应可促进坏死心肌细胞的清除,有利于后期心脏组织修复[13-16]。有研究显示,心肌梗死早期发生的急性炎症反应伴随大量炎症细胞聚集,中性粒细胞作为早期炎症反应中最主要的效应细胞,在心肌梗死后第1日数量便达到高峰,随之逐渐减少[17]。而periostin蛋白在心肌梗死后的炎症反应中所扮演的角色尚不清楚。本研究通过构建periostin基因敲除(perios-/-)C57小鼠和正常野生型(WT)C57小鼠AMI模型,探讨periostin的有无对于心肌梗死后中性粒细胞聚集及心功能改变的影响,为心肌梗死后的药物治疗提供一定理论依据。
材料与方法
一、AMI小鼠模型的制备
1.Periostiri'-小鼠杂交、鉴定
无特定病原体(SPF)periostin基因敲除亲代C57小鼠购自厦门大学,实验过程符合实验动物伦理。将periostin敲除杂合雌鼠与杂合雄鼠杂交,待子代生长至10~14d,剪取小鼠爪,按照组织基因组DNA提取试剂盒(TIANGEN)说明书提取genome DNA、并进行PCR扩增,扩增体系为:ddH2O2.1μ1、2×Mix 6μl、WT下游引物0.3μl、periostin下游引物0.3 wl、WT及periostin上游引物0.3μl、cDNA 2μl,引物序列见表1。扩增后利用1%琼脂糖凝胶电泳,135V/h,软件分析条带位置。
2.AMI小鼠模型
分次选取SPF级12周龄正常野生型(WT组)(购自广东省动物实验中心)和periostin敲除(periostin-/-組)C57小鼠,每次每组各20只(分别用于生存率分析及流式检测、免疫荧光等),体质量25~30g,4%水合氯醛腹腔注射麻醉,备皮、气管插管、小鼠呼吸机正压通气,于左侧第3、4肋间位置依次剪开皮肤、肌肉及肋间隙,暴露心脏,于左前降支起始端下2一3mm处进行永久性结扎,可见结扎处以下左室前壁明显变白,造模成功,关闭胸腔,等待小鼠麻醉苏醒。
二、流式检测中性粒细胞表达
心肌梗死后第0、1、3日取Wr组及periostin}.组小鼠各6只,麻醉后取心脏组织用HBSS冲洗,剪取梗死区称重后,加入11型胶原酶、DNase I,用组织细胞匀浆仪制备成细胞悬液,离心弃上清,磷酸盐缓冲液(PBS)重悬,细胞计数。加入小鼠流式抗体CDllb-PEcy7 (1:20)(Thermo)、 Lineage-FITC(1:20)(Thermo),4℃避光孵育30min、PBS清洗、离心、重悬后,流式细胞仪检测CDllb及Lineage双阳性细胞群[18]。0
三、冰冻切片及免疫荧光染色
心肌梗死后第1、3日取2组小鼠各3只,麻醉、灌注固定后取出心脏,4%多聚甲醛4'C固定12h,30%蔗糖脱水过夜,OCT包埋组织,置于一20℃冰冻切片机至包埋剂凝固后连续冰冻切片(厚度为6μm),复温后用PBS漂洗,山羊血清封闭40min,Ly6g(1:250,BD公司)一抗4℃孵育过夜,PBS充分漂洗,荧光二抗(488抗rat1:500,Thermo)室温孵育30min,PBS充分漂洗,DAPI染核2min,PBS充分漂洗,封片,共聚焦显微镜(LSM800)观察拍照。
四、组织RNA提取、逆转录、实时荧光定量PCR(RT-PCR)
心脏组织剪碎,加入小钢珠和1ml Trizol,组织匀浆振荡器研磨后,加入200μl氯仿,充分振荡混匀15s,室温静置10min,4℃ 12000转/分离心15min,取上层水相,加入等量异丙醇,充分混匀,室温10min,4℃12000转/分离心10min,弃上清,75%乙醇4℃8500转/分离心5min、室温干燥10min、DEPC水溶解,测定RNA浓度。逆转录试剂盒(TIANGEN)合成cDNA,进行qPCR、反应体系:cDNA 3μl、DEPC水3.6μl、2×Mi×7.5μl、上下游引物各0.3μl,引物序列见表2。程序如下:94℃预变性5min,循环程序94℃变性30s,55℃退火30s,72℃延伸30s,并收集荧光信号,共40循环。
五、TTC染色
小鼠麻醉后取出心脏,清除黏连组织及血液,直接放入-20℃速冻20~30min,用刀片从心尖开始手动切厚度约1mm的切片,放入提前预热好的TTC孵育液中,37℃避光孵育30min,间隔10min轻摇组织,使其染色均匀,组织显色后加人终止液后进行拍照,正常组织呈红色,梗死区呈苍白色,计算梗死比例=(单个层面梗死区面积X厚度)/(单个层面梗死区与非梗死区总面积X厚度)。
六、心功能检测
正常小鼠及心肌梗死后3周用小鼠超声机检测LVEF、左心室缩短分数(LVFS)、左心室收缩末容积(LVESV)、左心室舒张末容积(LVEDV)。
七、统计学处理
实验数据采用Excel、Graphpad、Image J进行统计学分析,正态分布计量资料以x±s表示,2组间比较采用两独立样本t检验。采用Kaplan-Meier法绘制生存曲线,并用log-rank检验对比生存曲线。P<0.05为差异有统计学意义。
结果
一、Periostiri'-小鼠鉴定
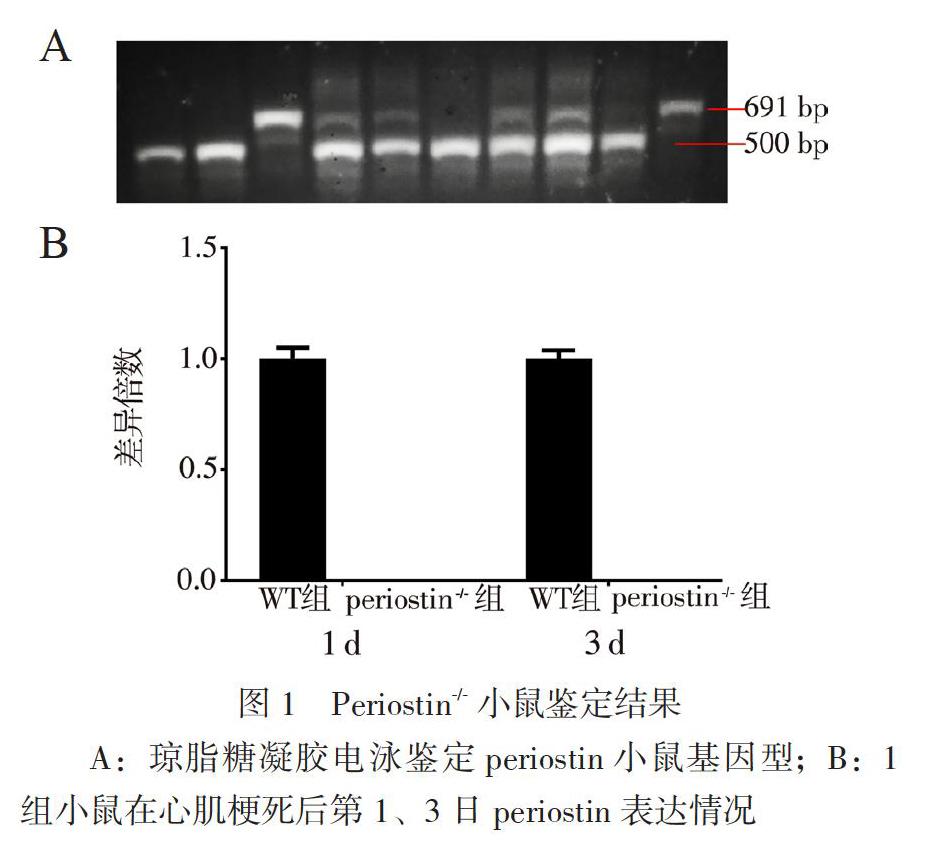
本研究采用杂合型periostin敲除雌雄鼠交配获得子代小鼠,通过琼脂糖凝胶电泳方法鉴定子代小鼠基因型。WT鼠显示一条带,条带位置691bp;纯合子显示一条带,条带位置500by;杂合子显示两条带,条带位置500 by和691by,见图1A。此外,为明确纯合小鼠是否表达periostin、RT-PCR结果显示在心肌梗死后第1、3日,periostin-/-小鼠都不表达periostin,见图1B。
二、Periostin敲除可改善心肌梗死小鼠左心功能。
为了排除periostin蛋白本身对心功能的影响,本研究比较了心肌梗死前periostin-/--小鼠和WT小鼠的心功能差异。WT组和periostin-/--组的LVEF、LVFS、LVESV、LVEDV比较差异均无统计学意义(P均>0.05)。而在心肌梗死后第3周心脏彩超显示,periostin-/-组与WT组比较,LVEF(t=7.689、P=0.005)、LVFS(t=8.366,P=0.004)升高,而LVESV(t=3.538,P=0.038)及LVEDV(t=6.366,P=0.024)则降低,见图2。
三、Periostin敲除可缩小心肌梗死后的梗死灶面积
本研究采用TTC染色反映心肌梗死小鼠梗死灶面积,结果表明心肌梗死后3周,periostin-/-组梗死灶面积小于WT组(t=5.817,P=0.004),见图3。
四、Periostin敲除可提高心肌梗死后小鼠生存率
虽然periostin-/-组与WT组相比确实改善了各项心功能指标,也确实缩小了梗死灶面积,但是其对小鼠心肌梗死后心功能的改善程度是否具有临床转化意义并不清楚。因此本研究进一步比较了periostin-/--小鼠与WT小鼠的Kaplan-Meier生存曲线。以心肌梗死后21d作为观察终点,通过生存曲线分析(log-rank检验)发现periostin-/-组的生存率要高于WT组(P<0.05),见图4。
五、Periostin可抑制心肌梗死早期梗死灶中性粒細胞浸润
心肌梗死早期急性炎症反应的主要效应细胞为中性粒细胞,因此本研究为了探究periostin在心肌梗死早期的炎症反应中发挥的作用,利用流式细胞方法检测心肌梗死后第0、1、3日的periostin-/-组以及WT组梗死灶的中性粒细胞数量。结果表明,心肌梗死后第1日periostin-/-组梗死区的中性粒细胞多于wlr组(t=5.365、P=0.003)o而在第3日periostin组梗死区中性粒细胞数量明显减少,而且要少于WT组(t=2.548,P=0.034),见图5。免疫荧光结果与流式结果一致,见图60
六、Periostin敲除可提高梗死区炎症因子表达
periostin-/-组与WT组细胞相比,心肌梗死后第1日的IL-1β(t=22.940,P < 0.001)、TNF-α(t=12.990,P<0.001)、IL-8(t=11.800,P<0.001)、IL-23α(t=7.027,P<0.001)升高,第3日2组IL-1β、TNF-α、IL-8虽无明显差异,但periostin-/-组较第1日下降明显,并且periostin-/--组的IL-23α(t=4.931,P=0.001)仍高于WT组,见图70其中IL-1β、TNF-α和IL-8均可以招募中性粒细胞,IL-23 a则招募巨噬细胞。因此,心肌梗死早期的缺氧损伤可能引起心肌梗死区固有免疫细胞以及间质细胞炎症因子表达上升,将中性粒细胞趋化至梗死区发挥效应。
讨论
本研究发现,periostin-/--组比WT组小鼠在心肌梗死后3周的心功能提高,梗死灶面积缩小,且小鼠的生存率更高。periostin-/-小鼠心肌梗死后第1日梗死灶内浸润的中性粒细胞比WT /J"鼠更多。然而第3日WT组小鼠梗死灶内的中性粒细胞反而多于periostin-/--组。此外,心肌梗死后第1日periostin-/-组小鼠比WT组的IL-1β、TNF-α、IL-8、IL-23α表达增加。以上结果提示,心肌梗死发生后periostin蛋白通过抑制可趋化中性粒细胞的炎症因子表达从而降低梗死灶内的中性粒细胞数量,使得心肌梗死后早期坏死心肌细胞清除、心肌修复受阻,梗死灶面积不缩小,进而使得心功能下降,小鼠生存率降低。
心肌梗死早期血流中断导致梗死区心肌细胞缺氧损伤坏死引起急性炎症反应,主要表现为炎症介质释放增加,炎症细胞聚集至梗死区,此时进人梗死区的主要为中性粒细胞以及促炎型巨噬细胞[5,17-18]。本结果也证实无论是periostin-/-组还是WT组小鼠心肌梗死后第1日梗死灶浸润的中性粒细胞急剧升高。但是与其他研究不同的是,心肌梗死后第3日梗死区内的中性粒细胞数量比第1日明显下降。主流观点认为心肌梗死早期炎症反应虽然清除了一部分坏死心肌,但是在此过程中产生大量的炎症介质、细胞毒性物质对梗死灶内存活的心肌细胞甚至邻近梗死区的正常心肌细胞也发挥了杀伤作用[19]。因为心肌一般被认为是不可再生的,所以心肌细胞在心肌梗死后发生的是瘢痕修复。但是心肌组织发挥生理功能依赖于心肌细胞而非瘢痕组织,况且心肌梗死早期炎症反应使得心肌细胞受到更严重损伤甚至炎性坏死。因此,大部分学者认为心肌梗死早期炎症反应不利于梗死后心脏修复,并且提出利用一些拮抗早期炎症反应的药物治疗心肌梗死[9]。然而与其他研究不同,本研究发现periostin-/-组在心肌梗死后第1日梗死区中性粒细胞上升而第3日下降,并且可改善小鼠预后。我们认为periostin蛋白缺失后,中性粒细胞在心肌梗死后第1日的时候急剧升高以便快速清除坏死细胞,在第3日的时候迅速降低以控制炎症的强度、时间、范围,尽量减少对存活心肌细胞及梗死灶邻近区正常心肌的杀伤作用,同时快速启动组织修复的过程。而且几项拮抗早期炎症反应的药物临床试验均告以失败,也从侧面反应了早期炎症对心肌梗死后组织修复并不是不利的[20-22]。
综上所述,本研究采用periostin-/-小鼠和WT小鼠建立AMI模型,直接清除periostin蛋白观察动物表型,避免了因为蛋白本底表达掩盖的现象。从建立AMI模型之后小鼠的心功能、心脏病理改变、生存预后等多方面揭示periostin-/--心肌梗死小鼠表型的改变,结合已有研究推陈出新,得到了与以往研究不同的结论,并且初步探讨了periostin-/-改善心肌梗死小鼠预后的机制。本研究的不足之处在于对于机制探索过于浅显,仅仅发现了periostin-/-小鼠心肌梗死后第1日炎症介质将大量中性粒细胞招募至梗死区,但第3日中性粒细胞却急剧下降的原因没有找到,并且中性粒细胞通过何种途径清除坏死心肌细胞同时尽量减少对存活心肌细胞的杀伤并不明确。未来可从本研究出发,深入探索急性炎症反应在心肌梗死早期心脏修复方面的分子机制,趋利避害为改善AMI的临床治疗及预后提供新的实验基础和理论支持。
参考文献
[1]Thygesen K,Alpert JS,White HD;Joint ESC/ACCF/AHA/WHF Task Force for the Redefinition of Myocardial Infarction.Universal definition of myocardial infarction.J Am Coll Cardiol,2007,50(22):2173-2195.
[2]Ford ES,Capewell S.Coronary heart disease mortality amongyoung adults in the U.S.from 1980 through 2002:concealedleveling of mortality rates.J Am Coll Cardiol,2007,50(22):2128-2132.
[3]Mehta PK,Wei J,Wenger NK.Ischemic heart disease inwomen:a focus on risk factors.Trends Cardiovase Med,2015,25(2):140-151.
[4]Thomas H,Diamond J,Vieco A,Chaudhuri S,Shinnar E,Cro-mer S,Perel P,Mensah GA,Narula J,Johnson CO,Roth GA,Moran AE.Global atlas of cardiovascular disease 2000-2016:the path to prevention and control.Glob Heart,2018,13(3):143-163.
[5]Eltzschig HK,Eckle T.Ischemia and reperfusion一一一frommechanism to translation.Nat med,2011,17(11):1391-1401.
[6]林婉文,楊坷,廖延,姜美花,彭朝权.CD51阳性心肌细胞对心肌梗死后小鼠心功能改善的作用.新医学,2015,46(6):350-355.
[7]Kalogeris T,Baines CP,Krenz M,Korthuis RJ.Cell biology ofischemia/reperfusion injury.Int Rev Cell Mol Biol,2012,298:229-317.
[8]Mezzaroma E,Toldo S,Farkas D,Seropian IM,Van TassellBW,Salloum FN,Kannan HR,Menna AC,Voelkel NF,Abbate A.The inflammasome promotes adverse cardiac remodel-ing following acute myocardial infarction in the mouse.Proc NatlAcad Sci U S A,2011,108(49):19725-19730.
[9]Hansson GK.Inflammation and atherosclerosis:the end of a con-troversy.Circulation,2017,136(20):1875-1877.
[10]Izuhara K,Nunomura S,Nanri Y,Ogawa M,Ono J,MitamuraY,Yoshihara T.Periostin in inflammation and allerg3.Cell MolLife Sci,2017,74(23):4293-4303.
[11]Kudo A,Kii 1.Periostin function in communication with extrace-llular matrices.J Cell Common Signal,2018,12(1):301-308.
[12]Sasaki H,Dai M,Auclair D,Kaji M,Fukai I,Kiriyama M,Yamakawa Y,Fujii Y,Chen LB.Serum level of the periostin,a homologue of an insect cell adhesion molecule,in thymomapatients.Cancer Lett,2001,172(1):37-42.
[13]Frangogiannis NG.The inflammatory response in myocardialinjury,repair,and remodelling.Nature reviews.Nat RevCardiol,2014,11(5):255-265.
[14]Faxon DP,Gibbons RJ,Chronos NA,Gurbel PA,SheehanF;HALT-MI Investigators.The effect of blockade of the CD11/CD 18 integrin receptor on infarct size in patients with acutemyocardial infarction treated with direct angioplasty:the resultsof the HALT-MI study.J Am Coll Cardiol,2002,40(7):1199-1204.
[15]Wang J.Neutrophils in tissue injury and repair.Cell Tissue Res,2018,371(3):531-539.
[16]Horckmans M,Ring L,Duchene J,Santovito D,Schloss MJ,Drechsler M,Weber C,Soehnlein 0,Steffens S.Neutrophilsorchestrate post-myocardial infarction healing by polarizingmacrophages towards a reparative phenotype.Ear Heart J,2017,38(3):187-197.
[17]Shapira I,Rotstein R,Fusman R,Gluzman B,Roth A,KerenG,Avitzour D,Arber N,Berliner S.Combined leukocyte anderythrocyte aggregation in patients with acute myocardial infar-ction.Int J Cardiol,2001,78(3):299-305.
[18]Anzai A,Choi JL,He S,Fenn AM,Nairz M,Rattik S,McAlpine CS,Mindur JE,Chan CT,Iwamoto Y,Tricot B,Wojtkiewicz GR,Weissleder R,Libby P,Nahrendorf M,StoneJR,Becher B,Swirski FK.The infareted myocardium solicitsGM-CSF for the detrimental oversupply of inflammatory leuk-ocytes.J Exp Med,2017,214(11):3293-3310.
[19]Vinten-Johansen J,Jiang R,Reeves JG,Mykytenko J,DeneveJ,Jobe IJ.Inflammation,proinflammatory mediators and myoca-rdial ischemia-reperfusion Injury.Hematol Oncol Clin NorthAm,2007,21(1): 123-145.
[20]Ridker PM,Everett BM,Thuren T,MacFadyen JG,ChangWH,Ballantyne C,Fonseca F,Nicolau J,Koenig W,AnkerSD,Kastelein JJP,Cornel JH,Pais P,Pella D,Genest J,Cifkova R,Lorenzatti A,Forster T,Kobalava Z,Vida-SimitiL,Flather M,Shimokawa H,Ogawa H,Dellborg M,RossiPRE,Troquay RPT,Libby P,Glynn RJ:CANTOS Trial Group.Antiinflammatory therapy with canakinumab for atheroscleroticdisease.N Engl J Med,2017,377(12):1119-1131.
[21]Ridker PM,MacFadyen JG,Thuren T,Everett BM,LibbyP,Glynn RJ:CANTOS Trial Group.Effect of interleukin-lbetainhibition with canakinumab on incident lung cancer in patientswith atherosclerosis:exploratory results from a randomised,double-blind,placebo-controlled trial.Lancet,2017,390(10105):1833-1842.
[22]Bissonnette R,Tardif JC,Harel F,Pressacco J,Bolduc C,Guertin MC.Effects of the tumor necrosis factor-alpha antagonistadalimumab on arterial inflammation assessed by positron emissiontomography in patients with psoriasis:results of a randomizedcontrolled trial.Circ Cardiovasc Imaging、2013,6(1):83-90.
(收稿日期:2019-01-18)
(本文编辑:杨江瑜)
DOI:10.3969/j.issn.0253-9802.2019.05.009
基金项目:国家自然科学基金(81370214);广东省自然科学基金(2015A030313183)
作者單位:510630 广州,中山大学附属第三医院心血管内科(祝双华,彭朝权);510060 广州,中山大学干细胞与组织工程研究中心
(廖延,姜美花);510800广州,中山大学附属肿瘤防治中心(詹宇婷)
通信作者,彭朝权,E-mail:pengcq123456@163.com
