生物有机肥中微生物的分离鉴定及液体菌剂的构建
2019-07-05陈扬波卞杰松刘彩霞汤鑫鑫
陈扬波,卞杰松,刘彩霞,汤鑫鑫
(1.湘南学院化学生物与环境工程学院/湘南稀贵金属化合物及其应用湖南省重点实验室,湖南 郴州 423000)
【研究意义】化肥的广泛使用在一定程度上促进了作物的生长,但是不应该低估对土壤和环境的危害,化肥的大量使用导致土壤板结,减少了土壤有机质含量和有益微生物数量[1],导致农作物产量减少,又因为化肥中氮含量过高,使得农作物中NO3-、NO2-等离子浓度增加,对人畜会产生很大的毒害作用[2]。而生物有机肥是将家禽粪便、植物秸秆等通过无公害处理再往其中加入各种微生物菌种,因此微生物是生物有机肥的核心部分,微生物肥料具有增加微生物的数量,提升土壤中有机质的含量,提高土壤营养成分等优点[3];许多功能微生物能显著改善土壤理化性质,调节生态平衡[4];微生物的一些代谢产物也能增强作物对恶劣环境的适应性,微生物产生的抗生素能够对大多数有害菌产生拮抗作用[5];使得最终的农作物风味也会得到极大的改善[6]。通过实验研究了解生物有机肥中具体成分,完善生物肥料的作用机制,为生物有机肥的发展提供部分理论基础。
【前人研究进展】微生物肥料已经有百余年历史,国际上最早使用的是由根瘤菌组成的生物肥料,我国在20世纪40年代才开始研究微生物肥料,最初都是在肥料中加入根瘤菌而成[7];50年代早期逐渐在其中加入更多菌种,如固氮菌、磷细菌等;60年代开始使用添加了放线菌的“5406”微生物菌肥;70年代中期开始研发泡囊-丛枝菌根(AM菌根)[8]。可见,我国微生物肥料经历了3次发展,但都没有延续过长的时间,由于当时缺乏这方面的监管,各品种良莠不齐,没有一个适合的标准[9]。在20世纪90年代和21世纪初,当时化肥大量使用,导致环境破坏严重,大家又重新将目光放到生物肥料上来。【本研究切入点】目前微生物肥料发展迅速,所能添加的微生物已有数十种,生物有机肥逐渐从单一变得复杂,其功能也越来越多[10],现在我国提倡发展绿色农业,而生物肥正是安全,无污染的肥料,我国幅员辽阔,耕地面积广,今后生物肥料必定会有广阔的前景[11]。【拟解决的关键问题】本研究主要从3个部分进行,分别为微生物分离与鉴定、探究菌种间的拮抗实验、各菌种都适合生长的液体培养基的配制。希望通过此次对生物有机肥的研究,能为后续微生物肥料的发展提供理论依据。
1 材料与方法
1.1 试验材料
试验于2018年10月至2019年1月在湘南学院化学生物与环境工程学院实验楼进行。
1.1.1 供试菌种 供试各菌种都分离自生物有机肥肥料,生物有机肥购自郴州市同兴南生物技术有限公司。
1.1.2 培养基 固体培养基(牛肉膏蛋白胨琼脂培养基):牛肉膏3.0 g,蛋白胨10.0 g,NaCl 5.0 g,琼脂18.0 g,水1 000 mL,pH 7.2~7.5。液体培养基(牛肉膏蛋白胨培养基):牛肉膏3.0 g,蛋白胨10.0 g,NaCl 5.0 g,水1 000 mL。两种培养基均经过高压蒸汽灭菌30 min后使用。
1.1.3 主要设备 分析天平、超净工作台、电热鼓风干燥箱、光学显微镜、可见分光光度计、酶标仪、高压蒸汽灭菌锅、高速冷冻离心机,pH酸度计、恒温摇床、打孔器、培养皿、冰箱、电磁炉。
1.2 细菌鉴定
1.2.1 形态观察 将生物有机肥样品进行梯度稀释后涂布到平板培养基上,37 ℃培养48 h,得到4种菌落,将其编号为CZ1、CZ2、CZ3、CZ4。挑取单个菌落进行纯化,然后采用平板划线法观察单个菌落形态[12]。菌体形态观察采用革兰氏染色法,参照文献[13]的步骤。
1.2.2 分子生物学鉴定 DNA提取参照文献[14]的步骤。PCR扩增:以提取出来的细菌基因组DNA为模板,采用引物R-F(AGAGTTTGATCCTGGCTCAG)和R-R(TACGGCTACCTTGTTACGACGACTT)进行特异性扩增。引物购买于武汉擎科测序公司,所用的50 μL PCR反应体系包括:基因组DNA 2 μL;引物R-F(10 μmol/L)2 μL;引物R-R(10 μmol/L)2 μL;TaqDNA 聚合酶 25 μL;加 H2O 至 50 μL。
PCR反应程序:94 ℃预变性2 min,94 ℃变性30s,57 ℃退火30 s,72 ℃延伸30 s,30个循环;最后72 ℃延伸2 min。PCR完成后将PCR产物进行琼脂糖凝胶电泳检测[15]。
PCR产物鉴定:将电泳检测后的PCR产物进行测序,获得16SrDNA基因序列,测序结果在美国国家生物技术信息中心(National Center of Biotechnology Information, NCBI)进行分析比对,根据同源序列搜索结果,导出相关菌株的16SrDNA基因序列,与实验菌株一起用MEGA7构建系统发育树[16]。
1.3 拮抗试验
研究菌种间的拮抗关系采用菌饼法[17],具体操作步骤如下:用接种环分别制作上述4种菌悬液,然后用移液管分别吸取0.5 mL于相应的固体培养基上并用涂布器涂抹均匀,置于37 ℃恒温培养箱中培养2 d,然后用1 cm的打孔器在已培养2 d的4种培养基上制取多块菌饼,然后将该菌饼放置在刚涂布有另一种菌的平板上,放置3块,并在培养基上放一块无菌饼块作对照[18]。试验设计见表1。

表1 各菌种间拮抗实验设计Table 1 Experimental design of antagonism among various strains
1.4 液体菌剂构建
将牛肉膏蛋白胨液体培养基的初始pH调节为6.0、6.5、7.0、7.5、8.0,并将4种菌按1∶1∶1∶1的比例分别接种于不同pH的液体培养基中,置于37℃恒温培养振荡器中培养48 h,然后通过稀释涂布平板法测定有效活菌数。选择菌种长势较好的pH值作为该混合菌种的最适pH值[19]。
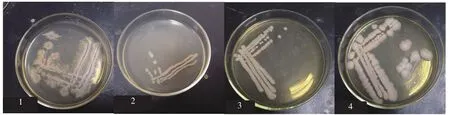
图1 各菌种菌落形态Fig.1 Colony morphology of various stains

图2 各菌种菌体形态Fig.2 Morphology of various stains
2 结果与分析
2.1 细菌鉴定
2.1.1 形态观察 通过平板划线法观察到单个的菌落,其形态特征如下:CZ1,菌落粗糙,不透明,粘着,扩展,边缘粗糙;CZ2,菌落表面粗糙,不透明,污白色或微黄色,边缘整齐;CZ3,菌落呈白色或微黄色,表面光滑,边缘整齐;CZ4,菌落凸起,微白色,湿润,边缘整齐,菌落背面为黄色(图1)。
菌体形态通过革兰氏染色法以及显微镜观察,结果见图2。在油镜下观察到的菌体形态特征如下:CZ1,有芽孢,无荚膜,不成链能运动,革兰氏染色呈紫色,细胞直径为0.6~0.9 μm×1.0~1.5 μm;CZ2,有芽孢,无荚膜,周生鞭毛,能运动,革兰氏染色呈紫色,细胞直径为0.7~0.8 μm×2~3 μm;CZ3,有芽孢,菌体末端圆,单个或呈短链排列,革兰氏染色呈紫色,细胞直径为 1.2~1.5 μm×2.0~4.0 μm;CZ4,无芽孢,菌体形态呈直或弯的杆状单个、成对或呈链状排列,革兰氏染色呈紫色,细胞直径为0.9~1.2 μm×3.0~8.0 μm。镜检发现4种细菌的颜色都为紫色,说明4种菌均为革兰氏阳性菌。
2.1.2 分子生物学鉴定 通过16SrDNA基因序列同源性比对,构建4种细菌的系统发育进化树见图3。从图3可以看出,CZ1与地衣芽孢杆菌属(B.licheniformis)同源性达100%,CZ2与枯草芽孢杆菌属(B.subtilis)同源性达100%,CZ3与巨大芽孢杆菌属(B.megaterium)同源性达100%,CZ4与植物乳杆菌属(L.plantarum)同源性达100%。因此可以确定CZ1为地衣芽孢杆菌,CZ2为枯草芽孢杆菌,CZ3为巨大芽孢杆菌,CZ4为植物乳杆菌。

图3 4种菌的16SrDNA序列系统发育树Fig.3 Phylogenetic tree for 16SrDNA sequences of four species of bacteria
2.2 各菌种间的拮抗作用
试验采用C值表示抑菌作用的大小,C值是指抑菌圈直径与菌饼直径的比值,地衣芽孢杆菌对枯草芽孢杆菌和植物乳杆菌有拮抗作用,它们的C值分别为1.18和1.15;枯草芽孢杆菌对巨大芽孢杆菌和植物乳杆菌有拮抗作用,它们的C值分别为1.12和1.19;巨大芽孢杆菌和植物乳杆菌对其他菌种均无拮抗作用。
由图4可知,地衣芽孢杆菌、枯草芽孢杆菌和植物乳杆菌均用同一种培养基培养,对营养物质需求基本一致,但由于试验中地衣芽孢杆菌已先在培养基培养2 d,因此数量上会有一定的优势,在营养物质和生存空间等的竞争上会占据一定的优势,从而对枯草芽孢杆菌和植物乳杆菌产生一定的抑制作用;同样的,枯草芽孢杆菌已先在培养皿中培养2 d,因此枯草芽孢杆菌的数量会比巨大芽孢杆菌和植物乳杆菌多一些,在营养物质、生长空间等的竞争中取得一定的优势,从而对巨大芽孢杆菌和枯草植物乳杆菌的生长产生一定的抑制效果,而且对于植物乳杆菌而言,枯草芽孢杆菌对其抑制作用较大,可能是因为枯草芽孢杆菌的代谢产物对植物乳杆菌的生长产生一定的抑制作用;其他菌种之间均无拮抗作用,因为C值均为1,它们可以共同生长。

图4 各菌种拮抗试验结果Fig.4 Result of antagonistic test of various strains
2.3 液体菌剂的构建
2.3.1 pH对混合菌种生长的影响 按地衣芽孢杆菌∶枯草芽孢杆菌∶巨大芽孢杆菌∶植物乳杆菌=1∶1∶1∶1的比例混合接种在不同pH的液体培养基中,用稀释涂布平板法测定有效活菌数,结果见表2。从表2可以看出,当培养基pH为7.0时,各菌种均生长良好,有效活菌数比其他pH下明显要多,说明该混合菌剂的最适pH为7.0。因此,使用牛肉膏蛋白胨液体培养基,将pH调至7.0,从而得到一种高效的液体菌剂。

表2 不同pH液体培养基中的有效活菌数(×108个/mL)Table 2 Number of effective living bacteria in liquid media with different pH (×108 cell/ mL)
3 讨论
生物有机肥为当下较热门的问题,搞清楚其中的菌种刻不容缓。本试验经过菌体、菌落、分子手段三方面的鉴定,力求能做到精确,在清楚其中菌种类型之后,考虑到可以配置液体菌剂,且这种菌剂比固体生物有机肥有益生菌数量多、效力强等优点,通过拮抗实验检测各菌种之间的共存关系,表明这4种菌之间均无拮抗作用,可以共同生长,这为构建液体菌剂提供了一个极好的理论基础。液体菌剂要求菌种数量要足够多,同时也需要各菌种较均衡,不能一枝独秀,由于这4种菌都属于细菌,因此选择牛肉膏蛋白胨液体培养基作为实验环境。影响液体菌剂构建的因素包括pH、营养成分、菌种初始比例等,本试验中牛肉膏蛋白胨的成分是一致的,而不同菌种的最适pH不同,混合培养时的最适pH更加值得探究,因此pH是最主要的一个影响因素,在牛肉膏蛋白胨液体培养基中添加其他营养成分对混合微生物生长的影响会在今后的试验中加以研究。通过菌饼法证实没有拮抗,因此采用地衣芽孢杆菌∶枯草芽孢杆菌∶巨大芽孢杆菌∶植物乳杆菌=1∶1∶1∶1的比例进行最适pH的测定。对各菌悬液进行吸光度测试,保证初始菌种数量基本一致,避免因某种菌数量过多而影响其他菌生长发育。生物有机肥的具体作用机制目前尚未明朗,可以肯定其具有巨大的发展前景,应更深入其作用机理研究,完善科研手段和科研设备,增加微生物肥料的种类,更大限度提高农作物产量。
4 结论
本试验从生物有机肥中分离出4种菌,经鉴定分别为地衣芽孢杆菌、枯草芽孢杆菌、巨大芽孢杆菌和植物乳杆菌。通过菌饼法和平板涂布法对各菌种之间的拮抗作用以及培养条件进行研究,表明这4种菌之间均无拮抗作用,虽然地衣芽孢杆菌对枯草芽孢杆菌和植物乳杆菌有拮抗作用(C值分别为1.18和1.15),枯草芽孢杆菌对巨大芽孢杆菌和植物乳杆菌也有拮抗作用(C值分别为1.12和1.19),但C值均小于1.2,因此将它们之间的拮抗忽略不计,因为菌饼上的菌已培养生长了2 d,在数量上有一定的优势,会由于数量的差异而产生一定的抑菌作用,所以忽略不计。巨大芽孢杆菌和植物乳杆菌对其他菌种均无拮抗作用。
由于这4种菌之间均无拮抗作用,将地衣芽孢杆菌∶枯草芽孢杆菌∶巨大芽孢杆菌∶植物乳杆菌按1∶1∶1∶1添加到不同pH的牛肉膏蛋白胨培养基液体培养基中进行培养,并用稀释涂布平板法测定有效活菌数,最终得到最适pH为7.0,即使用牛肉膏蛋白胨液体培养基,将pH调至7.0时各菌种都能很好的的生长,由此可得到一种高效的液体菌剂。
