蒲公英植酸对沙门氏菌抑制作用及其抑菌机理研究
2019-06-25高飞雄梁引库李云祥
高飞雄,梁引库,李云祥
陕西理工大学生物科学与工程学院,汉中 723000
蒲公英(TaraxacummongolicumHand-Mazz)是一种药食两用的多年生草本植物,具有广谱抗菌、保肝利胆、抗内毒素、健胃和免疫促进作用。现代医药学研究确认,蒲公英同属植物中含有多种生物活性成分,主要包括黄酮类、倍半萜内酯类、香豆素类、三萜类、植物甾醇类、胡萝卜素类、色素类、挥发油等[1,2]。根据相关研究发现,蒲公英花中含有较丰富的酚酸类和黄酮类物质[3,4],而这些物质在抗菌消炎、抗氧化、抗肿瘤等方面均具有较强的生物活性[5]。目前,中国食品添加剂种类繁多,但多数为化学添加剂,具有一定的安全隐患,而安全性高、无毒副作用且具有一定保健功能的植物天然食品添加剂较少。因此开发无毒、天然、安全且具有保健作用的食品添加剂是当今食品添加剂发展的新趋势[6,7]。植酸是从植物种子中提取的一种有机磷酸类化合物,广泛应用于食品、医药和日用化工等行业[8],尤其是在食品行业中,植酸因其良好的抗氧化性能和高度络合金属离子的特性,常用于水产品、酒类、新鲜果蔬等的稳定剂和保鲜剂[9,10]。
沙门氏菌(Salmonella)是一种常见食品污染源,是引起食物中毒和食源性疾病爆发的主要病原菌之一。据统计,沙门氏菌引起的食物中毒常居世界首位[11]。研究表明,全世界每年因沙门氏菌感染而导致死亡的病例就达到了约300万起[12]。因此开发对沙门氏菌具有一定抑制作用的天然食品添加剂就成为可能。
本研究从广谱抗菌植物蒲公英中提取了蒲公英植酸,分析了蒲公英植酸对沙门氏菌的抑制作用,并分析了蒲公英植酸对沙门氏菌的生长动力学、细胞通透性和细胞膜的影响,以期为沙门氏菌的防治提供理论基础以及为天然食品添加剂的研发提供参考。
1 实验材料
1.1 实验材料与试剂
蒲公英,购于汉中药材市场,经陕西理工大学李新生教授鉴定为菊科蒲公英(Taraxacummongolicum)。植酸标品(纯度≥94%,购于上海源叶生物有限公司)。沙门氏菌(Salmonellatyphimurium,ATCC14028)由中国药品生物制品检定所中国医学细菌保藏中心提供,-20 ℃低温冰箱冻存。实验前复苏传代使用。
蛋白胨、酵母浸粉、琼脂(购自北京奥博星生物技术有限责任公司);碘化丙啶(PI)(购自sigma公司);氯化钠(购自天津市盛奥化学试剂有限公司)
1.2 仪器与设备
ACQUITY高效液相色谱仪(美国安捷伦公司);摇摆式粉碎机(永康市天祺盛世工贸有限公司);旋转蒸发仪(上海爱郎仪器有限公司);JD-150E型超声波清洗机(宁波金达超声波仪器厂);电热恒温鼓风干燥箱(上海跃进医疗器械有限公司);SHB-III型循环水式多用真空泵(郑州长城科工贸易有限公司);HH-S4型电热恒温水浴锅(北京科伟永兴仪器有限公司);THZ-82气浴恒温振荡器(常州市国立实验设备研究所) FA2204B型电子天平(上海精密科学仪器有限公司);TGL-20台式高速离心机(湖南湘仪实验室仪器开发有限公司);UV2550型分光光度计(日本岛津公司);DHP-9162型电热恒温培养箱(上海一恒科学仪器有限公司);SJ-CJ-2FD双人单面洁净工作台(苏州苏洁净化设备有限公司);LDZX-50KBS立式压力蒸汽灭菌锅(上海申安医疗器械厂);VEGA3-XMU扫描电镜(沈阳华仪时代科技有限公司);倒置荧光显微镜XSP-63XDV(上海光学仪器一厂)。
2 实验方法
2.1 蒲公英植酸的提取与纯化
取粉碎后过筛蒲公英30 g,加12倍量的水,调pH为2,于25 ℃下搅拌7~8 h。过滤取滤液,用石灰水调节pH为4,然后加入10% NaOH,使最终pH值为6.5。静置1 h后抽滤,弃滤液,用蒸馏水洗涤沉淀2~3次,得粗品蒲公英植酸钙。向提取的植酸钙中加少量水和稀盐酸,搅拌30 min,过滤后取滤液。将上述所得的可溶性植酸盐上阳离子交换柱,流速12 mL/min,收集过柱液即为蒲公英植酸,70~80 ℃条件下浓缩蒲公英植酸至瓶内溶液呈稀稠状,然后冷冻干燥48 h,即为植酸干粉[13]。
2.2 高效液相测定蒲公英植酸
分别配制2 mg/mL的植酸标品溶液和样品溶液,过0.22 μm超滤膜,进行高效液相色谱分析,色谱条件如下:色谱柱为DiKMA Diamonsil C18柱(250 mm×4.6 mm,5 μm),柱温30 ℃,等度洗脱,流动相5 mmol/L NaAc,流速0.5 mL/min,UV254 nm[14]。
2.3 蒲公英植酸对沙门氏菌的抑制作用
利用滤纸片法[15,16]分析蒲公英植酸对沙门氏菌的抑制作用。配制2 mg/mL的植酸样品溶液,将高压蒸汽灭菌的无菌滤纸片浸入其中,备用。将冻存的沙门氏菌菌种于室温时转涂LB固体培养基,37 ℃过夜活化,4 ℃冰箱保存备用。挑活化后单菌落于LB液体培养基中37 ℃、170 rpm摇床中培养5 h至OD600 nm为0.6,取100 μL涂布于LB固体培养基上。然后用镊子将分别蘸有植酸和无菌水的无菌滤纸片贴于培养基平板表面,作为实验组和对照组。在37 ℃倒置培养24 h后测定抑菌圈直径大小,以抑菌圈直径为指标评价提取液的抑菌效果。
2.4 蒲公英植酸最小抑菌浓度测定
实验采用倍比稀释法[17]。按照2.3的方法,将活化后的单菌落在摇床中培养12 h,用液体LB培养基将菌液浓度调到107CFU/mL。分别向装有2 mL LB培养基的10 mL试管中加入蒲公英植酸样品,让植酸样品与一定量的LB液体培养基在试管中进行倍比稀释,最终使菌液中植酸浓度为0、0.1、0.2、0.4、0.6、0.8 mg/mL,以0 mg/mL作为对照,分别于37 ℃、170 rpm 培养24 h,测OD600 nm值,与对照比较,OD600 nm下降一半及以上的第一个稀释浓度为蒲公英植酸的最低抑菌浓度,设为MIC[18]。
2.5 蒲公英植酸对细胞通透性影响
按照2.4的方法培养沙门氏菌,将浓度为107CFU/mL的沙门氏菌菌液于6 000 rpm离心10 min,收集菌体,PBS(pH5.8)洗三次。用含0.01% Tween80的PBS悬浮菌体,使其浓度为109CFU/mL。分别向装有2 mL悬浮菌体的10 mL试管中加入蒲公英植酸提取物,使溶液中蒲公英植酸提取物最终浓度为0×MIC、0.5×MIC、1×MIC、2×MIC。以0×MIC作为空白对照,再设不加菌液对照组,其中无菌液但含有2×MIC浓度的植酸,37 ℃、180 rpm培养,分别于0、1、2、4、6 h取样200 μL,8 000 rpm离心5 min后测上清液OD260nm值。
2.6 植酸对沙门氏菌生长曲线的影响
按照2.4的方法培养沙门氏菌。分别向装有4 mL LB液体培养基的10 mL试管中加入蒲公英植酸,使培养基中植酸最终浓度为0、1、3×MIC,以0×MIC作为对照,按体积分数4%(V/V)接入备用菌液,分别于37 ℃、200 rpm培养,每隔3 h取样200 μL,测其OD600 nm值。根据测量结果,绘制生长动力学曲线。
2.7 扫描电镜(SEM)分析蒲公英植酸对沙门氏菌的抑制作用
按照2.4的方法培养沙门氏菌。分别取2 mL悬浮菌体,加入蒲公英植酸,使溶液中蒲公英植酸最终浓度为0、0.5、1、2×MIC,以0×MIC作为对照,37 ℃、200 rpm培养5 h,取1 mL的菌体样品,8 000 rpm离心5 min,用PBS(pH5.8)洗涤2次,然后加入2.5%戊二醛(以25%戊二醛、去离子水和PBS为1∶4∶5的比例配制成体积分数为2.5%的戊二醛溶液)固定4 h,使用呈梯度浓度的乙醇脱水(50%、60%、70%、80%、90%、100%乙醇,重悬浸泡10 min,8 000 rpm离心5 min),用真空冷冻干燥机干燥12 h。镀金后上SEM观察[19-21]。
2.8 荧光染色观察
按照2.3的方法培养活化后的沙门氏菌3 h至其OD600 nm为0.4。分别将直径15 mm无菌盖玻片放入多孔细胞培养皿4孔中,每孔加0.5 mL悬浮菌体和1.5 mL LB液体培养基,37 ℃下过夜培养24 h后,更换培养基,分别加入蒲公英活性成分植酸,使溶液中蒲公英植酸最终浓度为0、0.25、0.5、1×MIC,以0×MIC作为对照。培养至5 h时,用PBS洗玻片2次。然后在黑暗条件下,用PI染色5分钟,PBS洗玻片2次去除残留染液,使用荧光显微镜观察。
2.9 数据分析
利用SPSS 22.0、Origin 8.0软件进行数据的分析、图表的制作等,数据进行统计学评估,使用单因素方差分析比较差异组,*P<0.05和**P<0.01分别代表差异性显著和极显著,抑菌机理实验重复三次,实验结果取平均值。
3 结果与讨论
3.1 植酸的提纯与鉴定
高效液相色谱分析植酸标准品和蒲公英植酸样品,如图1表明,蒲公英植酸样品液相色谱图(图1A)在4.8 min有一色谱峰,与植酸标准品液相色谱图(图1B)相同,这表明提取的蒲公英样品为蒲公英植酸,通过面积法计算蒲公英提取液中蒲公英植酸的纯度为86.51%。

图1 液相色谱分析蒲公英植酸Fig.1 Analysis of dandelion phytic acid by liquid chromatography注: A为植酸标品液相色谱图,B为植酸样品液相色谱图。Note:A is the liquid chromatogram of phytic acid standard,B is the liquid chromatogram of phytic acid sample.

图2 植酸对沙门氏菌的抑菌效果Fig.2 Antibacterial effect of phytic acid on Salmonella注:A和B为无菌水对照,C和D为植酸实验组。Note:A and B are sterile water controls, and C and D are phytic acid experimental groups.
3.2 蒲公英植酸对沙门氏菌的抑制作用
由图2可知,对照组无菌水纸片周围没有抑菌圈,表明水对细菌的生长没有影响。实验组蒲公英植酸纸片周围出现抑菌圈,其抑菌圈直径可达13.38 mm,表明蒲公英植酸对沙门氏菌是具有一定的抑菌效果。
3.3 最小抑菌浓度测定
浓度梯度分析沙门氏菌的最小抑菌浓度,由表1可知,随着蒲公英植酸浓度的增加,蒲公英植酸对沙门氏菌的生长抑制能力逐渐加大,当植酸的浓度为0.2 mg/mL时,沙门氏菌OD600nm下降≥50%,可见,蒲公英植酸对沙门氏菌的最小抑菌浓度为0.2 mg/mL。

表1 蒲公英植酸对沙门氏菌的最小抑菌浓度测定(mg/mL)Table 1 Determination of the minimum inhibitory concentration of dandelion phytic acid on Salmonella
注:“-”指与生长对照比较OD600 nm下降<50%,“+”指与生长对照比较OD600 nm下降≥50%。
Note:"-" refers to a decrease of OD600 nmof <50% compared to the growth control,"+" means a decrease of OD600 nmby ≥50% compared to the growth control.
3.4 植酸对沙门氏菌细胞膜通透性的影响
细胞膜是细菌的重要组成部分,具有重要的屏障作用,但当菌体处于不利生长条件或者受到抑菌剂作用时,其细胞膜就会遭到破坏,使细胞内的大分子物质(如DNA、RNA等)通过细胞膜外泄到菌悬液中,而核酸物质在260 nm处有吸收峰,导致菌悬液在260 nm处的吸光度增大。因此,可以通过测定菌悬液在260 nm处的吸光度值来判断菌体细胞膜的完整性[22]。由图3可知,空白对照组的菌悬液在培养6 h时间内,其在260 nm波长的紫外吸收光度值变化较小。不加菌液对照组基本处于平稳状态,可排除植酸对吸光度的影响。实验组菌悬液在同一时间内与对照组相比在260 nm波长的紫外吸收变化较大,差异达到显著水平,而且这一变化随着时间的推移而增大。这表明植酸使沙门氏菌细胞内容物外泄,导致培养液中细胞内容物浓度增加。因此可推测蒲公英植酸是破坏沙门氏菌细胞膜,使沙门氏菌内部的核酸等大分子物质外泄,进而导致沙门氏菌死亡而达到抑制沙门氏菌生长的作用。
3.5 植酸对沙门氏菌生长曲线的影响
蒲公英植酸对沙门氏菌生长影响(图4)表明,对照组沙门氏菌生长符合细菌的典型生长规律,即S型生长。在菌液中加入蒲公英植酸后,细菌的生长曲线呈现出明显的差别。在1倍和3倍MIC浓度植酸作用下,2 h后菌液在600 nm处的OD值显著低于对照组。这表明蒲公英植酸对沙门氏菌有抑制作用,并且浓度不同,抑制效果也不同,较高浓度的植酸是可以极大地抑制沙门氏菌的生长,因此其生长曲线始终处于较低的平稳状态。而低浓度的植酸虽然也能够有效抑制细菌活性,但效果不如较高浓度,从而导致其菌液OD值有所上升。

图3 植酸对沙门氏菌细胞膜通透性影响Fig.3 Effect of phytic acid on cell permeability of Salmonella注:不加菌液对照组:无菌液,含有浓度为2×MIC的植酸。Note:No bacterial control group:sterile solution containing phytic acid at a concentration of 2 MIC.
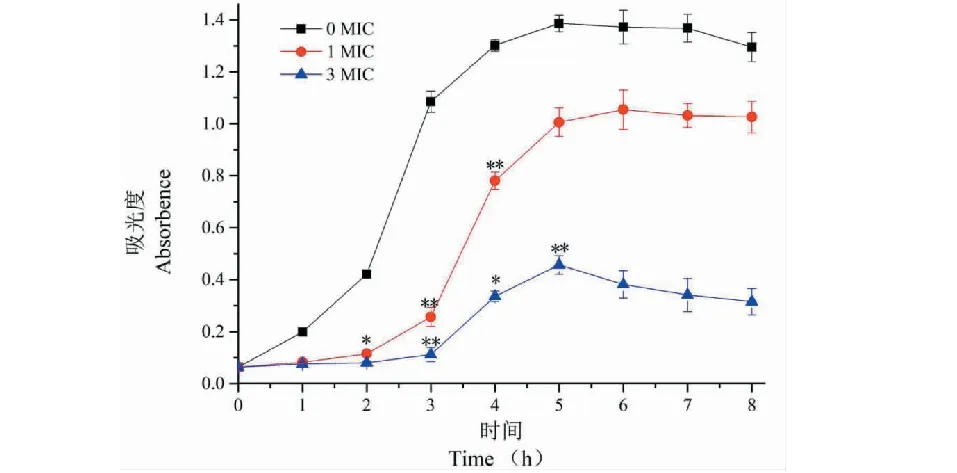
图4 不同浓度植酸作用下沙门氏菌的生长曲线Fig.4 Growth curve of Salmonella with different concentrations of phytic acid
3.6 扫描电镜(SEM)
不同浓度植酸对沙门氏菌进行处理,扫描电镜观察发现,对照组沙门氏菌其结构比较完整,形态饱满,呈现典型的短杆状(图5A)。而植酸处理后的沙门氏菌菌体欠饱满(图5B),部分细胞表面褶皱,形态扭曲变形(图5C),并且在细胞表面出现孔洞(图5D)。由此可见,植酸对沙门氏菌的细胞膜具有损坏作用,同时,高浓度的植酸比低浓度的植酸对细胞更具有破坏力,从而导致细胞膜受损,造成细胞内容物的外泄,这与沙门氏菌膜通透性分析一致。
3.7 荧光染色观察
PI是一种细胞核染料,可以对坏死细胞的DNA和RNA进行染色并呈现红色荧光[23],当细胞受损后细胞内DNA和RNA外泄可导致红色荧光出现。利用此原理,通过PI对沙门氏菌进行单染后显微镜观察(图 6)。结果表明,对照组无红色荧光(图 6A),表明沙门氏菌菌液在没有加入植酸时,无细胞坏死。图 6B、C和D中有红色荧光出现,并且随着植酸浓度的增加,红色荧光出现的范围也在增大,这表明植酸可以通过改变沙门氏菌膜通透性促使细胞凋亡,导致细胞内的核酸物质外流,从而被PI荧光染料染成红色,且植酸浓度越大,对细胞膜通透性影响越大。
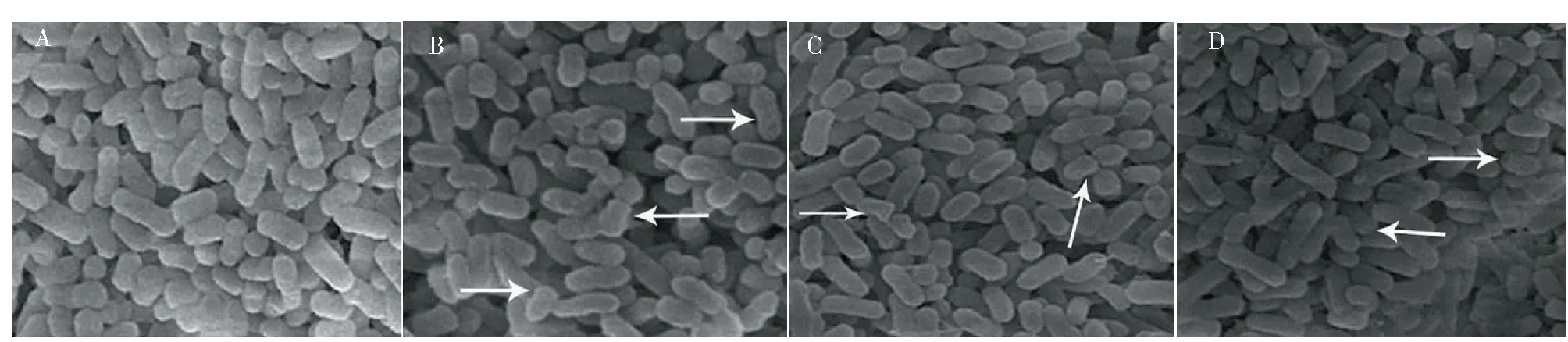
图5 菌株扫描电镜图(10 000×)Fig.5 Scanning electron microscope image of strains(10 000×)注:A为空白对照组;B、C、D实验组植酸浓度依次是0.5MIC、1MIC、2MIC。Note:A is a blank control group;the phytic acid concentrations of the B,C,and D experimental groups are 0.5 MIC,1 MIC,and 2 MIC.

图6 PI染色荧光图(40×)Fig.6 PI staining fluorescence map(40×)注:图A为空白对照组;图B、C、D实验组植酸浓度依次为0.25MIC、0.5MIC、1MIC。Note:Fig.A is the blank control group;the phytic acid concentrations in the experimental groups B,C,and D are 0.25 MIC,0.5 MIC,and 1 MIC.
4 结论
本研究表明,蒲公英植酸对沙门氏菌具有较强的抑制和杀灭作用,通过多组实验表明,蒲公英植酸浓度在2 mg/mL时对沙门氏菌的抑菌圈直径为13.38 mm。通过对其抑菌机理研究发现,植酸通过破坏沙门氏菌细胞膜通透性从而达到抑菌甚至是灭菌的效果,并且浓度越高,其抑菌效果越好。最小抑菌浓度分析表明,植酸对沙门氏菌的最小抑菌浓度为0.2 mg/mL。通透性影响和生长动力学实验证明植酸对沙门氏菌的抑制是通过破坏细胞膜的完整性,使细胞渗透性增加,导致菌体细胞质外渗,进而使细胞凋亡,而且植酸浓度越高,细胞膜破坏就越严重,菌体细胞质外渗也就越明显。扫描电镜和荧光染色进一步证明了植酸可以使细菌表面褶皱,甚至破裂,进而造成细胞凋亡以及内容物的外泄,并且这种现象随着植酸含量的增加变得越来越严重。本研究揭示了蒲公英植酸对沙门氏菌的抑菌性能及抑菌机理,以期为沙门氏菌的防治提供理论基础以及为基于天然食品添加剂的研发提供参考。
