建兰花叶病毒RT-LAMP检测方法的建立
2019-06-11樊荣辉黄敏玲钟淮钦罗远华
樊荣辉 黄敏玲 钟淮钦 罗远华

摘 要 建兰花叶病毒(Cymbidium mosaic virus,CyMV)是侵染兰花的主要病毒,严重影响其观赏价值,建立快速、灵敏的检测方法显得尤为重要。根据CyMV的外壳蛋白基因序列设计4对特异性引物,经过优化反应条件,建立该病毒的RT-LAMP 检测方法,并进行LAMP检测的特异性、敏感性检测。该方法能特异扩增CyMV,与其他4种病毒(齿兰环斑病毒、菜豆黄花叶病毒、黄瓜花叶病毒和小苍兰花叶病毒)不发生反应;灵敏度为RT-PCR的10倍。田间检测20份样品中,RT-LAMP和RT-PCR检测结果一致,检出率为60%。在产物中加入荧光染料SYBR GreenⅠ,直接用肉眼观察就可判断样品是否感染CyMV,可省去电泳分析的时间。针对CyMV建立的RT-LAMP方法具有特异性强、灵敏度高、操作简单、快速等特点,适用于在进境检疫及种苗繁育过程中的检测鉴定。
关键词 建兰花叶病毒;RT-LAMP;检测
中图分类号 S436.8 文献标识码 A
建兰花叶病毒(Cymbidium mosaic virus,CyMV)是兰花中最严重的病毒之一,洋兰(蝴蝶兰、石斛兰、文心兰等)主要由CyMV病毒单独侵染为主[1]。兰花受CyMV侵染后出现花叶、畸形、坏死及花瓣变色等症状,导致品质下降,影响观赏价值,制约兰花产业发展[2-3]。目前尚缺乏有效防治建兰花叶病毒的药剂,最有效方法是培育无毒种苗,而这就需要对种苗进行病毒检测及鉴定。因此,建立快速、灵敏的检测技术尤为重要。目前,对CyMV的检测主要集中在酶联免疫法(ELISA)和RT-PCR技术。2006年,Lee等[4]建立了CyMV与其他病毒的多重RT-PCR检测技术,2008年,Lee等[5]建立了CyMV的抗血清技术。这些技术能有效检测CyMV,并对后续新技术出现提供借鉴。酶联免疫法是目前较常用的一种方法[6],但也存在灵敏度不高、易出现假阳性等缺点。PCR技术已成为常规检测手段[7],但由于实验设备要求比较高,不利于向基层检验部门推广。环介导等温核酸扩增技术(Loop-me diated isothermal amplification,LAMP)应用4条特异性引物,通过Bst DNA聚合酶,在水浴锅中对靶基因进行的一种恒温扩增技术[8],该技术具有扩增特异性强、灵敏度高、操作快速简便、检测简单等特点,摆脱了对PCR仪等昂贵仪器的依赖[9-11],在基层的检测更加方便。本研究对CyMV的保守外壳蛋白(CP)基因设计4条特异性引物,并对其灵敏性和特异性进行验证,建立了可特异检测该病毒的RT-LAMP检测方法,以期为兰花种苗筛选提供可靠简便的检测方法,也利于基层检疫部门进行进出口检测。
1 材料与方法
1.1 材料
感染了建兰花叶病毒(Cymbidium mosaic virus, CyMV)、黄瓜花叶病毒(Cucumber mosaic virus,CMV)、小苍兰花叶病毒(Freesia mosaic virus,FreMV)、齿兰环斑病毒(Odontoglossum ringspot virus,ORSV)、菜豆黄花叶病毒(Bean yellow mosaic virus,BYMV)的阳性样品及健康对照样品的叶片均由本实验室保存。
荧光染料SYBR GreenⅠ购自北京鼎国公司;Bst聚合酶、MgSO4购自New England Biolabs(美国);EcoR I、PMD18-T載体、JOM109 感受态细胞均购自TaKaRa;甜菜碱购自Sigma(美国)。
1.2 方法
1.2.1 RT-LAMP 体系的建立 取感染病毒的叶片,按照多糖多酚植物总RNA提取试剂盒(北京百泰克生物技术有限公司)方法提取样品的总RNA。
根据GenBank公布的CyMV较保守的CP基因序列为靶标基因(AY429021、HQ644132、GU295168、AF016914、EU672821和GQ507023),设计得到6区域的4条特异性引物,其中F3和B3为外引物,FIP和BIP为内引物(表1)。引物由上海生工生物工程有限公司合成。
反应体系(25 μL):10×Bst buffer 2.5 μL、 25 mmol/L MgSO4 4 μL、5 mmol/L Betaine 4 μL、2.5 mmol/L dNTPs 4 μL 、8 U/μL Bst聚合酶1 μL、20 μmol/L FIP 2 μL、20 μmol/L BIP 2 μL、10 μmol/L F3 0.5 μL、10 μmol/L B3 0.5 μL、 ddH2O 2 μL、cDNA 2.5 μL。反应条件为:65 ℃、60 min,80 ℃、5 min。进行琼脂糖凝胶电泳分析;同时产物中加入SYBR GreenⅠ,目视观察结果。
1.2.2 RT-LAMP 产物酶切鉴定 为了进一步验证LAMP扩增的正确性,在设计LAMP引物时加入了EcoRⅠ酶切位点(gaattc)。将LAMP反应产物电泳后,梯形条带进行胶回收,再用EcoR Ⅰ37 ℃酶切过夜,连接于PMD18-T载体上,用JOM109感受态细胞转化,测序。
1.2.3 特异性和灵敏度验证 对感染ORSV、FreMV、CMV、BYMV、CyMV的阳性样品,分别提取总RNA,应用RT-LAMP检测,琼脂糖凝胶电泳进行分析。
对感染CyMV阳性样品的总RNA,进行10、102、103、104、105倍梯度稀释,分别进行RT-LAMP 和 RT-PCR灵敏度检测。
运用RT-LAMP和RT-PCR技术,对田间随机采集的10份建兰和10份文心兰样品进行特异性检测和验证。
2 结果与分析
2.1 RT-LAMP
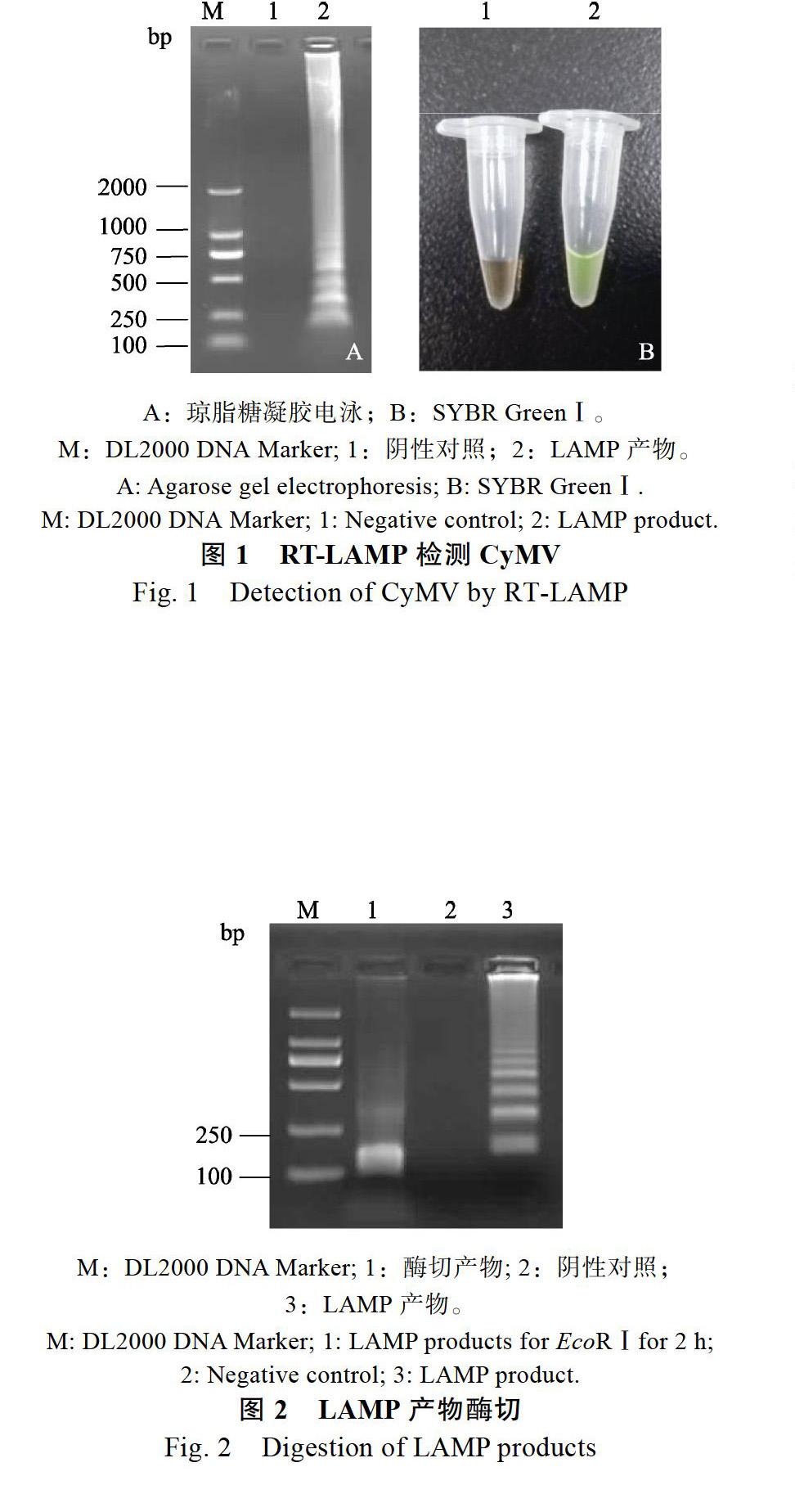
通过反应体系的优化,建立了能扩增CyMV的RT-LAMP 反应体系(图1),RT-LAMP反应产物有阶梯状的条带,阴性对照未发现条带;加入 SYBR GreenⅠ,混匀,RT-LAMP反应产物为黄绿色,阴性对照为橙色。
2.2 RT-LAMP反应产物的酶切验证
将LAMP产物胶回收后,用EcoRⅠ酶切如图2,并进行转化测序,最终得出,酶切出的片段为目标基因的F2-B2的序列,包括酶切碱基在内大小为165 bp。证明该体系扩增产物为靶基因。
2.3 特异性验证
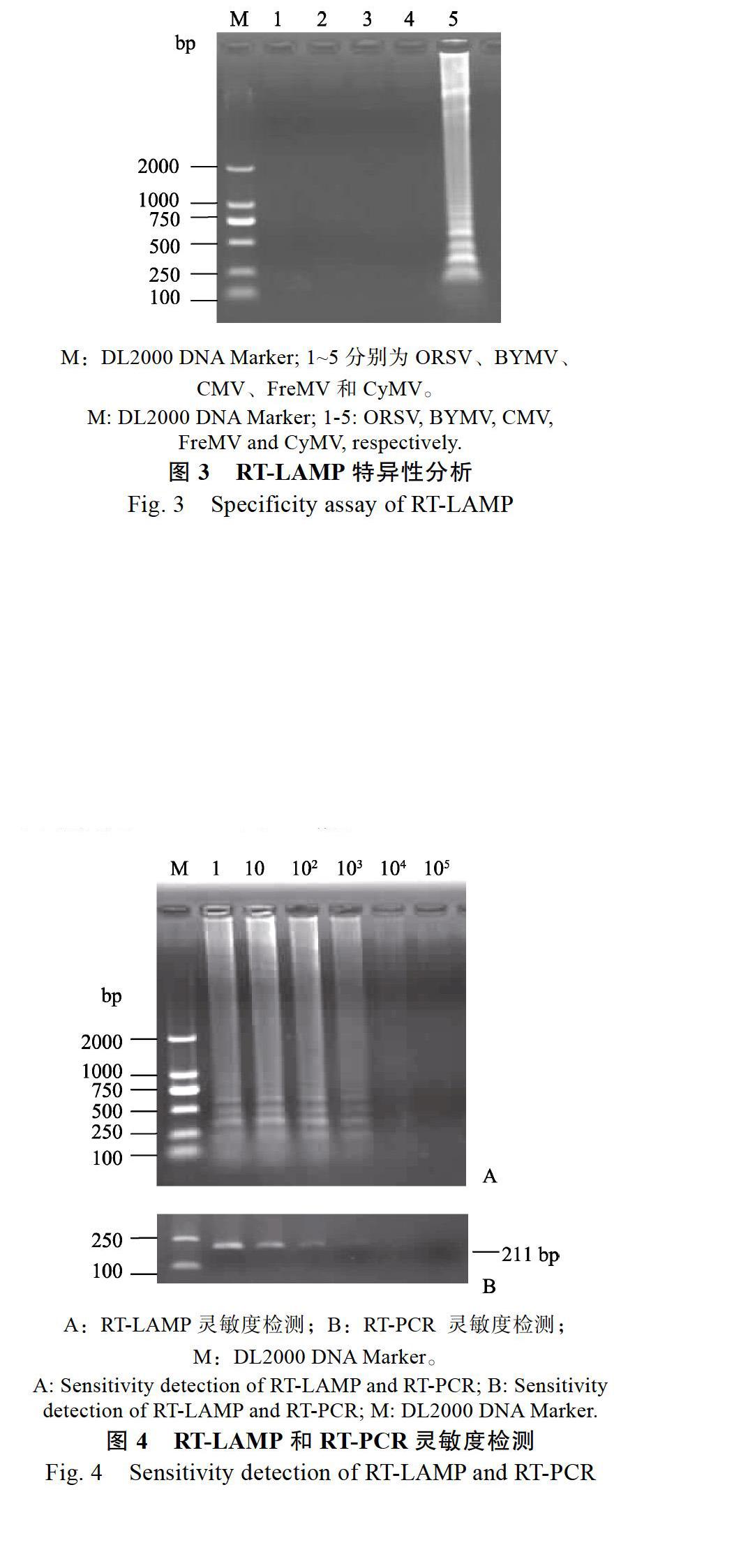
以分别感染ORSV、BYMV、FreMV、CMV和CyMV的样品总RNA为模板,进行RT-LAMP 扩增。如图3所示,只有CyMV有梯状条带,检测结果为阳性,其他不产生条带,说明建立的检测体系对CyMV检测有较好特异性。
2.4 灵敏度检测
对不同浓度稀释后的RNA,分别进行 RT-LAMP和RT-PCR反应。结果显示,RT-LAMP在稀释1000倍时,仍能检测出CyMV,而RT-PCR在稀释100倍还能检测出CyMV,稀释1000倍时,未检出(图4),表明RT-LAMP检测CyMV的靈敏度是RT-PCR的10倍。
2.5 田间样品测定
随机采取建兰和文心兰样品各10份,分别进行RT-LAMP和RT-PCR检测,结果显示,两者检测结果一致,建兰有4份样品呈阳性,文心兰有8份样品呈阳性(表2),表明RT-LAMP检测技术能应用于田间样品。
3 讨论
兰花是中国四大名花之一,代表高贵、典雅,具有极高的观赏和收藏价值。但当病毒病侵染时,植株会出现畸形、坏死,从而造成品质下降,这是制约兰花大规模生产的重要因子。为满足消费需求,培育无病毒苗是防止病毒病的重要措施,因此,建立快速、准确、高效的检测方法,对阻止病毒病的传播有良好作用;或对脱毒苗进行检测,从根源上预防病毒病也具有重要意义。本试验针对建兰花叶病毒建立的环介导等温扩增技术具有扩增快速高效、特异性好、操作简便、不需要特殊仪器等优点,可以针对性地对兰花脱毒种苗进行检测,从种源遏制病毒病的发生。本研究技术具有较高的应用价值,在基层和现场检测中有很好的应用前景。
目前,病毒检测的常用方法是PCR和ELISA技术,均且具有较好的检测效果,但也存在耗时长,成本高的特点,不太适用于基层检测。与常规PCR方法相比,本研究所建立的LAMP技术,在保持PCR技术优点的基础上,不需特殊仪器,成本低,且由于不需要热循环,整个过程可以在60 min内完成,更加省时,检测结果若采用加入SYBR GreenⅠ目测的方式,检测更快捷方便。因此该方法特别适合在基层中应用。
LAMP 技术使用4~6条引物,会进一步增强反应的特异性[12-13]。引物设计至关重要,也较复杂和困难,除要遵循一般引物设计原则外,还有LAMP 引物设计自身要注意的事项[14],特别是对于病毒多个生理小种间保守的CP基因差异明显或GC含量较高序列设计更加困难[15]。本研究针对建兰花叶病毒CP基因设计引物,经验证该引物的特异性良好。同时,本研究建立的检测CyMV的RT-LAMP方法灵敏度较高,比常规PCR灵敏度高10倍,对于病毒含量很少的脱毒苗的快速检测方面有一定的优势。LAMP方法灵敏度高,容易出现假阳性,因此本研究采用在RT-LAMP 反应管盖上滴加SYBR green I染色剂,待反应结束后在不开盖的情况下直接使染色剂与扩增产物混合,以此减少反复开盖而造成的污染问题。
参考文献
Rubies A C,Autonell C,Ballante M, et al. Viral infections in melon crops of cenral northern Italy[J]. Informatore Fitopatologieo, 1999, 46: 6-10.
Zettler F W, Ko N J, Wisler G C, et al. Viruses of orchids and their control[J]. Plant Disease, 1990, 74(9): 621-626.
Wong S M, Cheng C G, Lee Y H, et al. Incidence of Cymbidium mosaic and Odontoglossum ringspot viruses and their significance in orchid cultivation in Singapore[J]. Crop Protection, 1994, 13: 235-239.
Lee S C, Chang Y C. Multiplex RT-PCR detection of two orchid viruses with an internal control of plant nad5 mRNA[J]. Plant Pathology Bulletin, 2006, 15: 187-196
Lee S C, Chang Y C. Performances and application of antisera produced by recombinant capsid proteins of Cymbidium mosaic virus and Odontoglossum ringspot virus[J]. European Journal of Plant Pathology, 2008, 122: 297-306.
梁敏国, 刘光华. 广东兰花病毒病调查和病原检测[J] . 江西植保, 2004, 27(3): 97-100.
柳爱春, 赵 芸, 刘 超, 等. 双重一步法RT-PCR检测2种主要兰花病毒[J]. 安徽农业科学, 2009, 37(27): 12960-12961, 13009.
Notomi T, Okayma H, Masubuchi H, et al. Loop-mediated isothermal amplification of DNA[J]. Nucleic Acids Research, 2000, 28(12): e63.
Harper S J, Ward L I, Clover G R. Development of LAMP and real-time PCR methods for the rapid detection of Xylella fastidiosa for quarantine and field applications[J]. Phytopathology, 2010, 100(12): 1282-1288.
Singh P, Mirdha B R, Ahuja V, et al. Loop-mediated isothermal amplification (LAMP) assay for rapid detection of Entamoeba histolytica in amoebic liver abscess[J]. World Microbiol Biotechnol, 2013, 29(1): 27-32.
Ranjan R, Kanjayan M, Subramaniam S, et al. Development and evaluation of a one-step reverse transcription-loop mediated isothemal amplication assay (RT-LAMP) for rapid detection of foot and mouth disease virus in India[J]. Virus Disease, 2014, 25(3): 358-364.
高宏偉,徐 彪,朱来华,等. 应用LAMP检测方法检测肉制品中的单增李斯特菌[J]. 食品安全质量检测技术, 2010, 27(1): 12-17.
Zhang Y Q, Shan X X, Shi L, et al. Development of a fim Y-based loop-mediated isothermal amplification assay for detection of Salmonella in food[J]. Food Research International, 2012, 45(2): 1011-1015.
王 永, 兰青阔, 赵 新, 等. 转基因作物外源转基因成分环介导等温扩增技术检测方法的建立及应用[J]. 中国农业科学, 2009, 42(4): 1473-1477.
Chen L, Guo J, Wang Q, et al. Development of the visual loop-mediated isothermal amplification assay for seven genecitally modified maize events and their application in practical samples analysis[J]. Journal of Agricultural and Food Chemistry, 2011, 59(11): 5914-5918.
