TRIM21调控人结直肠癌细胞增殖分子机制研究*
2019-06-10柯东平毛俊倩郭甲民马龙安
柯东平,毛俊倩,刘 琪,郭甲民,马龙安△
1.陕西省肿瘤医院普外科 (西安710061);2.陕西省杨凌示范区医院普外科(杨凌712100)
结直肠癌(Colorectal cancer, CRC)具有高发病率、高病死率等特点。国际癌症研究中心(IARC)在2018年9月发布的全球癌症统计数据显示,结直肠癌在所有癌症中发病率排在第三位,癌症相关病死率排名第二位。肿瘤细胞的增殖、生长、浸润与许多基因的突变、异常表达密切相关,研究CRC中相关分子机制并找寻有效分子标记有利于CRC的及早诊断和治疗。TRIM21是三元基序蛋白(Tripartite motif-containing protein, TRIM)家族成员,该家族一般含有RING结构域,具有E3泛素连接酶活性。人类的TRIM21位于第11号染色体上11p15.4区域,共475个氨基酸,包含四个结构域:RING结构域、B-box结构域、Coiled-coil结构域和PRYSPRY结构域。TRIM21最早在系统性红斑狼疮中被鉴定。后来的研究表明TRIM21与多种肿瘤的发生也密切相关[1-3]。研究发现,TRIM21在人肠癌中表达显著降低,TRIM21缺失小鼠结肠癌的发生更明显[5]。本研究将进一步探讨TRIM21在结直肠癌中的作用机制,通过干扰结直肠癌细胞中的TRIM21表达,明确TRIM21对结直肠癌细胞增殖、凋亡及TGF-β1-Smad2/3信号通路活化的影响。
材料与方法
1 试剂与材料 RPMI-1640培养基(Gibco,31800-014);胎牛血清(BI,04-001-1ACS);MTT检测试剂盒(万类生物,WLA021a);细胞凋亡检测试剂盒(万类生物,WLA001c);Super M-MLV反转录酶(BioTeke,PR6502);2×Power Taq PCR MasterMix(BioTeke,PR1702);SYBR Green(Solarbio,SY1020);TRIM21抗体(Bioss,bs-0635R);TGF-β1抗体(万类生物,WL01076R);p-Smad2/3抗体(万类生物,WL02305);Smad2/3抗体(万类生物,WL01520)CyclinD1抗体(万类生物,WL01435a);羊抗兔IgG-HRP(万类生物,WLA023);β-actin抗体(万类生物,WL01845)。
2 实验方法
2.1 细胞培养:人结直肠癌细胞HCT116细胞株用含有10 %胎牛血清的RPMI-1640培养基,在37 ℃、5 % CO2、饱和湿度条件下的细胞培养箱中培养。
2.2 TRIM21 siRNA转染:HCT116细胞常规培养至细胞密度为70 %进行转染。在室温下混合无血清培养基稀释的Lipofectamine 2000和siRNA干扰片段或阴性对照,静置15 min。将上述溶液缓慢滴入培养的HCT116细胞中,不断轻轻振荡,置于37 ℃、5 % CO2培养箱中培养4 h后换液继续培养。细胞共分三组:未转染组、阴性对照(NC)组、TRIM21 siRNA转染组。
2.3 MTT检测细胞增殖:分别于转染后24 h、48 h、72 h和96 h收集各组细胞,弃去培养基,每孔加入20 μl MTT染色液,置于37 ℃、5 % CO2培养箱中孵育4 h。4 h后小心吸去上清,加入150 μl DMSO,避光静置10 min后用酶标仪测定570 nm处OD值。
2.4 Annexin V-FITC/PI法检测细胞凋亡:转染后48 h收集各组细胞,离心收集细胞沉淀,用PBS洗涤两次,每管细胞用500 μl Binding Buffer重悬,依次加入5 μl Annexin V-FITC/PI和 10 μl PI混匀,室温避光孵育15 min后上流式细胞仪检测。
2.5 实时荧光定量PCR:分别于转染后24 h、48 h收集细胞,加入TRIpure裂解液提取总RNA,Nano 2000测定RNA浓度。上述RNA样本进行反转录得到对应的cDNA进行后续实验。本实验利用ERxicycler TM96荧光定量仪进行荧光定量分析,引物序列如下:TRIM21-F:5’- GCTCCAGGTGGCATTAGG-3’;TRIM21-R:5’-TGCACAAACTCTGCGTGA-3’;TGF-β1-F:5’-CCTGCCTCCGCTCCTAGT-3’;TGF-β1-R:5’-CATGGAAGATGGCAAATTAC-3’;Smad2-F:5’-CAGTGTTAGATACCCTCTTCGT-3’;Smad2-R:5’-TTGTTCATGTCCACAGACTAGATA-3’;Smad3-F:5’-AGAGGAGTGCTGGTGACTGGAT-3’;Smad3-R:5’-GGAAGGTGCTGAAGACAAGGAT-3’;Cyclin D1-F:5’-GAACACGGCTCACGCTTAC-3’;Cyclin D1-F:5’-CGATACACACAACATCCAGG-3’;β-actin-F:5’-CACTGTGCCCATCTACGAGG-3’;β-actin-R:5’-TAATGTCACGCACGATTTCC-3’。
2.6 Western blot:转染后48 h收集细胞加入裂解液抽提总蛋白,BCA法对蛋白进行定量。取40 μg蛋白进行SDS-PAGE,电泳结束后转膜、封闭;加入相应一抗4 ℃孵育过夜,二抗37 ℃孵育45 min,之后进行ECL底物显色反应,暗室曝光,胶片用Gel-Pro-Analyzer软件分析光密度值。

结 果
1 TRIM21 siRNA转染效果验证 在转染后24 h和48 h分别通过实时荧光定量PCR和Western blot检测HCT116细胞中的TRIM21在mRNA和蛋白水平上的表达,结果显示,与阴性对照组相比,TRIM21 siRNA转染组中TRIM21在mRNA水平和蛋白水平上的表达均显著下降,差异具有统计学意义(图1)。
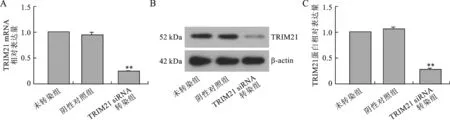
图1转染后细胞中的TRIM21表达(A:Real-time PCR检测TRIM21在mRNA水平上的相对表达量;B、C:Western blot检测TRIM21在蛋白水平上的相对表达量与阴性对照组比,**P<0.01)
2 TRIM21 siRNA转染后的细胞增殖 分别于转染24 h、48 h、72 h和96 h后采用MTT检测HCT116细胞的增殖情况,结果显示(图2),24 h、48 h、72 h和96 h时TRIM21 siRNA转染组细胞活力均高于阴性对照组,差异具有统计学意义(P<0.05)。Real-time PCR检测细胞中增殖相关蛋白Cyclin D1表达,结果显示(图3),与阴性对照组比,TRIM21 siRNA转染组Cyclin D1的相对表达量明显升高,差异具有统计学意义(P<0.01)。
3 TRIM21 siRNA转染后的细胞凋亡 细胞转染48 h后采用Annexin-V/PI法检测细胞凋亡情况,结果显示(图4),TRIM21 siRNA转染组细胞凋亡比例为(6.27±0.05)%,显著低于阴性对照组的(7.76±0.12)%,差异具有统计学意义(P<0.01),见表1。

图2MTT检测转染后的细胞增殖 (与阴性对照组比较,*P<0.05,**P<0.01)

图3Cyclin D1的相对表达量 (A:Real-time PCR检测Cyclin D1在mRNA水平上的相对表达量;B、C:Western blot检测Cyclin D1在蛋白水平上的相对表达量;与阴性对照组比,**P<0.01)

表1 转染后的细胞凋亡比例
注:与阴性对照组比,*P<0.01
4 TRIM21 siRNA转染后细胞TGF-β1-Smad2/3通路活化情况 在转染后48 h,采用实时荧光定量PCR和Western blot检测TGF-β1、Smad2、Smad3的表达量,结果显示(图5),与阴性对照组相比TRIM21 siRNA转染组的TGF-β1在mRNA和蛋白水平的表达量均有所下降,差异具有统计学意义(P<0.01);各组间Smad2/3在mRNA和蛋白水平的表达没有差异,但采用Western blot检测Smad2/3的磷酸化,结果显示TRIM21 siRNA转染组的p-Smad2/3水平低于阴性对照组,差异具有统计学意义(P<0.01)。

图4 流式细胞术检测转染后的细胞凋亡(A:未转染组;B:阴性对照组;C:TRIM21 siRNA转染组)

图5TRIM21 siRNA转染后HCT116细胞TGF-β1-Smad2/3通路相关蛋白表达 (A:Real-time PCR检测TGF-β1、Smad2和Smad3在mRNA水平上的相对表达量;B、C:Western blot检测TGF-β1、Smad2/3、p-Smad2/3在蛋白水平上的相对表达量;与阴性对照组比,**P<0.01)
讨 论
目前的研究已经证实,TRIM21在多种癌症中存在异常表达,在不同的癌症中扮演不同的角色。在CRC中,有研究曾报道了TRIM21与结肠炎相关结肠癌的发生[4]、CRC细胞顺铂敏感性[3]相关。本研究在此基础上探讨了TRIM21与CRC细胞增殖、凋亡的相关性,结果显示在HCT116细胞中干扰TRIM21的表达使HCT116细胞增殖能力增强,同时凋亡细胞比例下降,说明TRIM21在CRC中可能发挥类似抑癌基因的作用,沉默TRIM21的表达使肿瘤细胞增殖能力进一步增强。此外,转染TRIM21 siRNA的细胞中增殖相关蛋白Cyclin D1的表达也显著升高。
TGF-β是一类多功能的细胞因子,通过与受体结合发挥功能。通常TGF-β1首先与TGF-βRⅡ结合,然后再与TGF-βRⅠ结合,形成的具有活性的复合物可以磷酸化Smads蛋白,如Samd1、Smad2、Smad3、Smad5、Smad8等,它们与co-Smad(Smad4)结合形成复合体,该复合体转位至细胞核可以调控下游靶基因的转录[5]。TGF-β1-Smads通路是肿瘤中较为经典的信号通路,在不同类型、不同发展阶段的肿瘤中功能不同,与肿瘤细胞的增殖、转移能力密切相关。一方面,TGF-β1诱导周期依赖性激酶(Cycle dependent kinase, CDK)抑制剂p15的合成,阻止CDK和Cyclin的作用,抑制细胞增殖[6];另一方面,在肿瘤的发展晚期,TGF-β1信号通路诱导上皮-间质转化,促进肿瘤的侵袭和迁移[7]。在CRC发展期间,TGF-β1的功能也存在类似的变化[8]。
有文献曾报道,TRIM21正调控TGF-β信号通路[9]。本研究主要探讨TRIM21通过TGF-β1通路影响CRC增殖的机制。研究表明,在CRC早期,BAG-1通过抑制TGF-β1促进肿瘤细胞存活[10];阿司匹林通过诱导TGF-β1抑制CRC细胞增殖[11]。本研究中,在HCT116细胞中转染TRIM21 siRNA后,细胞中的TGF-β1表达量显著下降,同时Smad2/3的磷酸化水平降低,说明干扰TRIM21的表达可以抑制TGF-β1—Smad2/3通路的活化,同时Western blot结果显示细胞增殖相关蛋白Cyclin D1的表达水平也明显下降,Cyclin D1是由p-Smad2/3调控的下游基因之一,提示TRIM21可能通过调控TGF-β1—Smad2/3通路的活化水平进而影响增殖相关蛋白的表达,从而影响CRC细胞增殖和凋亡,参与CRC发展进程。
