生物炭添加对半干旱区土壤细菌群落的影响
2019-06-06孙层层周际海王彤彤郑纪勇
王 颖,孙层层,周际海,王彤彤,郑纪勇,3*
生物炭添加对半干旱区土壤细菌群落的影响
王 颖1,孙层层1,周际海2,王彤彤1,郑纪勇1,3*
(1.西北农林科技大学资源环境学院,陕西 杨凌 712100;2.南昌工程学院,江西 南昌 330099;3.西北农林科技大学,黄土高原土壤侵蚀与旱地农业国家重点试验室,陕西 杨凌 712100)
以半干旱区固原生态试验站生物炭修复4a的表层土壤为对象,采用高通量测序技术研究了不同添加类型(槐树皮生物炭、锯末生物炭)和比例(1%、3%、5%,质量百分比)的生物炭对土壤细菌多样性及群落结构的影响.结果表明,生物炭应用提高了土壤细菌群落的多样性,锯末生物炭优于槐树皮生物炭,且3%锯末生物炭对细菌群落的多样性影响最佳,其香农指数为6.22;优势门主要为放线菌门(Actinobacteria)、变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteria)和Saccharibacteria,相对丰度共占76.80%~85.31%;优势纲有放线菌纲(Actinobacteria)、α-变形菌纲(Alphaproteobacteria)、酸杆菌纲(Acidobacteria),其相对丰度占48.13%~57.08%;属水平上,施加生物炭增加了芽孢杆菌属()、硝化螺旋菌属()的相对丰度,降低了土微菌属()、根瘤菌属()的相对丰度;层级聚类及冗余分析(RDA)发现,施加生物炭对细菌群落结构有影响,其中,微生物量碳、含水率、铵态氮、有机碳对细菌群落结构的影响较大.细菌优势门与环境因子相关性热图分析表明,铵态氮与放线菌门、绿弯菌门呈显著相关性.铵态氮是影响细菌群落的主要理化因子.
生物炭;土壤细菌;多样性;群落结构;高通量测序
生物炭在污染物吸附、土壤改良和结构改善等方面广泛应用[1-4].微生物是维系土壤生态系统功能稳定的主导因子[5-6].且微生物对土壤环境的变化非常敏感[7-8],由于生物炭的施用改变了土壤理化性质,进而导致了微生物的变化[9-10].
研究表明,生物炭施用对土壤细菌群落产生影响,主要会改变细菌群落的α-多样性和群落结构[11-13].Hu等[14]发现生物炭添加到土壤96d改变了土壤细菌群落结构,增加了细菌多样性,且丰富了主要的细菌类群,如放线菌门. Dai等[15]研究发现热解温度和土壤类型的变化对主要类群影响不大.也有学者研究发现与对照相比,生物炭诱导形成了不同的细菌群落,且不同种类生物炭的诱导程度不同[16].目前大多数关于生物炭对土壤微生物群落影响的文献报道都是短期试验(1a以内),而生物炭中存在直接影响土壤微生物群落的不稳定物质,在短时间内可以被微生物迅速矿化[17],但也不能排除其长期应用后对环境的潜在影响.然而,与生物炭的短期效应相比,生物炭对土壤微生物长期影响研究较少,这限制了对生物炭长期应用后对生态效应的全局把控.
生物炭作为土壤添加剂,被广泛应用于水土流失严重、生态环境脆弱的黄土高原半干旱地区[18].因此,本研究以半干旱区固原生态试验站为定位试验平台,采用MiSeq测序技术和冗余分析方法,基于对单次施用生物炭后并保持4a的土壤细菌群落的研究,探讨了不同添加类型和比例的生物炭对土壤细菌多样性和物种组成的变化规律,阐述了环境因子对土壤细菌群落结构的影响,以期为科学施加生物炭,提高半干旱区地力和维持土壤微生物多样性等提供参考.
1 材料与方法
1.1 试验地概况与试验设计
试验区域概况及试验设计方法参照文献[19]. 2012年4月于中国科学院固原生态试验站进行长期定位试验小区的布设,该地区位于黄土高原中部偏西,属于半干旱地带,植被由半干旱典型草原向灌丛草原过渡.年均日照时数2518h,年降雨量472mm,无霜期 152d.土壤以黑垆土和湘黄土为主,颗粒组成为砂粒(0.02~2mm)含量为45.85%,粉粒(0.002~0.02mm)含量为34.47%,黏粒(<0.002mm)含量为19.68%.试验所用的生物炭以槐树皮、梧桐锯末为原料高温(550℃)热解形成,均由陕西亿鑫生物能源科技开发有限公司提供,其基本理化性质如表1所示.
槐树皮生物炭(HB)和锯末生物炭(JB)均设置3个添加比例(1%、3%、5%,质量百分比),试验共设6个处理及一个空白对照,记为HB1、HB3、HB5、JB1、JB3、JB5、CK,每个处理3个重复,共有21个试验小区.各小区采用完全随机布设,小区规格为2.4m× 2.4m.生长季前清除土表杂草等杂物,剥离表层20cm深的土壤,将生物炭按设定比例完全混合再原位回填,生物炭一次性施用.
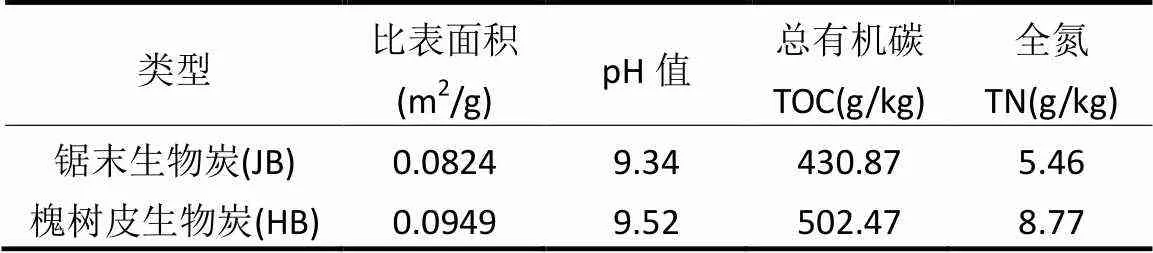
表1 供试生物炭基本理化性质
1.2 土壤样品的采集
于2016年11月采集去除表层枯落物等杂物后的土壤(0~10cm),每个小区按照对角线采样法采集5个点,混合并过2mm的筛,将部分土样置于离心管中,用液氮罐保存,运回实验室并储存于-80℃冰箱中,用于土壤微生物的测定.另一部分鲜土样用于硝态氮、铵态氮、含水量等土壤理化性质的测定.
1.3 指标测定
1.3.1 土壤理化性质测定 土壤含水量采用烘干法,土壤pH值采用电位法(水土比=2.5:1),土壤速效磷采用0.5mol/LNaHCO3浸提-钼锑抗比色法,土壤全氮含量采用半微量凯氏定氮法,土壤总有机碳测定采用浓硫酸-重铬酸钾消煮-硫酸亚铁滴定法.土壤铵态氮和硝态氮用1mol/L KCl 溶液浸提鲜土样后,采用流动分析仪测定[20].微生物量碳采用氯仿熏蒸直接浸提法[21].
1.3.2 土壤DNA提取和16S rRNA基因高通量测序 土壤总DNA 使用美国OMEGA 公司的试剂盒,每个样品称取约0.5g新鲜土壤,按照试剂盒提取步骤进行.用338F(5’-ACTCCTACGGGAGGCAG- CAG-3’)806R(5’-GGACTACHVGGGTWTCTAAT-3’)引物对V3~V4区进行PCR扩增,每个样品的上游引物5′端添加一段长度为8bp的特异性多肽 (barcode),用于区分样品[22-23].用2%的琼脂糖凝胶电泳检测提取DNA 的纯度和完整性,用核酸定量仪(Nano Drop ND-1000)检测提取DNA的浓度和纯度.根据Illumina MiSeq平台(Illumina, SanDiego, USA)标准操作规程进行双末端(Paired-end)测序,将纯化后的扩增片段构建PE 2*300的文库.PCR 采用TransGen AP221-02: TransStart Fastpfu DNA Polymerase; PCR仪为ABI GeneAmp® 9700型;每个样本3个重复,将同一样本的PCR产物混合后用2%琼脂糖凝胶电泳检测,使用AxyPrepDNA凝胶回收试剂盒(AXYGEN公司)切胶回收PCR产物,Tris_HCl洗脱.测序服务委托上海美吉生物医药科技有限公司完成.
1.4 数据处理与统计分析
1.4.1 基本数据处理 所有数据经过Excel 2013处理,利用SPSS 20.0进行单因素方差分析(One Way by ANOVA)和最小显著差异法(LSD)比较,利用Origin8.5进行作图.土壤因子与细菌种群分布特征之间的关系利用Canoco 4.5进行冗余分析(RDA),研究土壤性质对细菌分布特征的影响.
1.4.2 测序数据处理 MiSeq测序得到的是双端序列数据,根据PE reads之间的overlap关系,将成对的reads拼接(merge)成一条序列,同时对reads的质量和merge的效果进行质控过滤,根据序列首尾两端的barcode和引物序列区分样品得到有效序列,并校正序列方向,得到优化数据.将优质序列聚类成操作分类单元(OTU),阈值设置为97%,软件平台: Usearch (vsesion 7.0 http://drive5.com/uparse/).为了得到每个OTU对应的物种分类信息,采用RDP classifier贝叶斯算法对97%相似水平的OTU代表序列进行分类学分析,并分别在各分类学水平统计各样本的群落组成,将不能聚类在任何分类水平已知类群的序列定义为未分类.
2 结果与分析
2.1 土壤理化性质
不同生物炭处理下的土壤理化性质如表2所示,与对照相比,在pH值、总有机碳、速效磷、全氮、硝态氮、铵态氮、含水率7项指标中生物炭处理组均呈现出增大趋势.施加生物炭4a后,土壤pH值、总有机碳、全氮随着生物炭添加量的增加而显著提高;铵态氮含量随着生物炭添加量的增加而降低;无论HB或JB,添加量为3%时,速效磷含量最大;其他指标无统一变化规律.在相同添加量时,pH值、总有机碳、全氮、铵态氮和含水率5项指标均表现为HB大于JB;速效磷表现为HB小于JB.

表2 不同生物炭处理下的土壤理化性质
注:同列不同字母表示差异显著(<0.05).
2.2 细菌α多样性指数
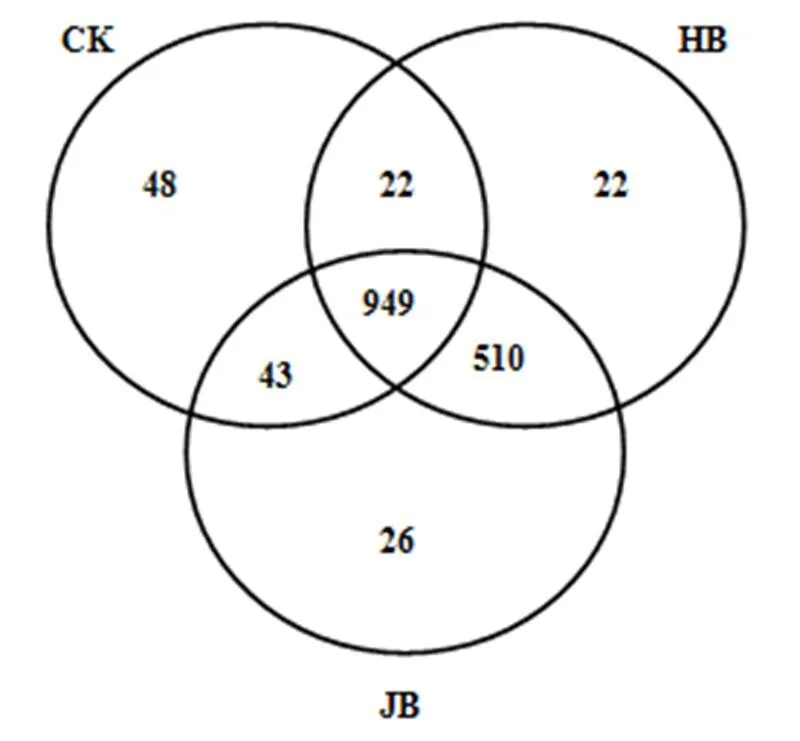
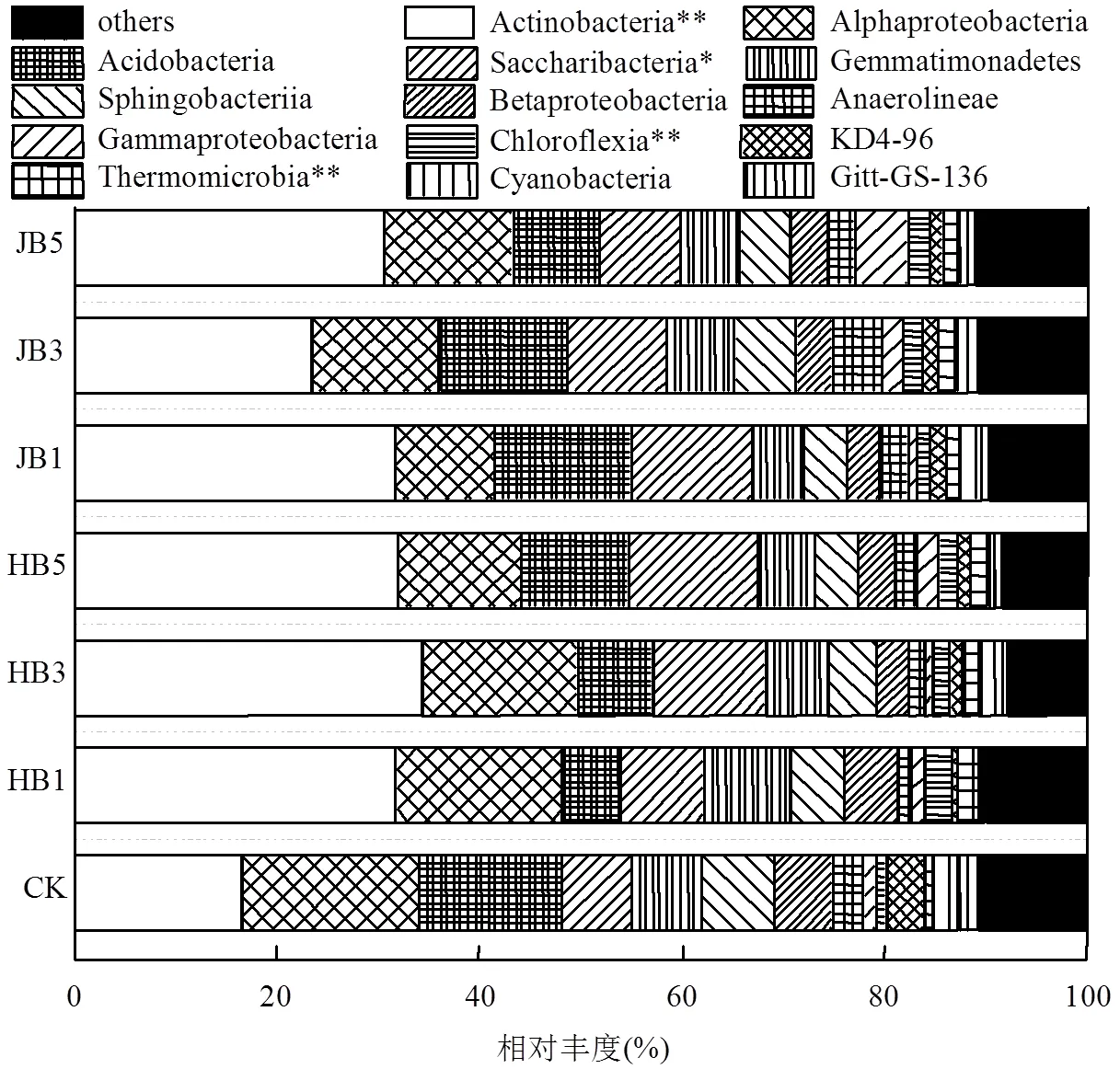
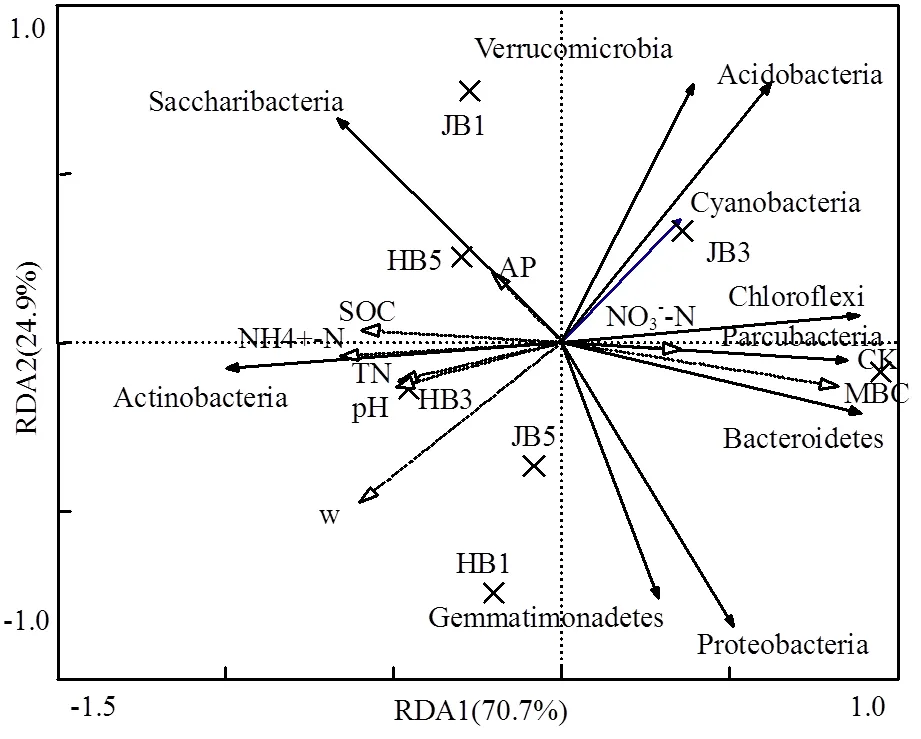
高通量测序数据及细菌多样性指数如表3所示.ACE指数和Chao1指数可以表征物种的丰富度,对其而言,与对照相比生物炭处理组呈增大趋势,说明生物炭可以提高细菌群落的物种丰富度;随着施炭比例的增加,2种生物炭处理的丰富度指数均在3%施炭量达到最大.香农指数(Shannon)可以估算细菌群落的多样性,表3呈现为JB3>HB1>JB5>JB1>HB5>CK>HB3,说明施加生物炭可以提高细菌群落的多样性,其中,3%JB对细菌群落多样性的影响效果最佳,为6.22.通过计算多样性指数的平均值(JB=6.05, HB=5.91)、极大值(JB=6.22, HB=6.09)和中值(JB=6.02, HB= 5.88)发现JB>HB,说明相对而言JB更优.Smith Wilson's指数可以反应群落的均匀度,表2呈现为JB 表3 细菌16S r RNA 基因 Illumina Mi Seq 高通量测序数据及细菌多样性指数 将所有样品分为3组,槐树皮生物炭(HB),锯末生物炭(JB)和不施加生物炭(CK),如图1所示. 3组微生物总OTUs数分别为1503,1528,1062个;3个处理组公有OTUs(949个)占HB、JB、CK 3个处理中总OTUs的比例分别为63.14%、62.11%和89.36%.HB、JB、CK 3个处理各自特有的OTUs数量占相应样品总OTUs的比例为1.46%、1.70%和4.52%.由此可见,施加生物炭增加了土壤微生物物种的数量,与未施生物炭处理对比,施加生物炭处理土壤微生物组成相似性更高. 图1 不同生物炭处理下细菌组成的Venn图 *代表差异显著(<0.05);**代表差异极显著(<0.01),下同 在门水平上,共获得35个类群,将相对丰度小于0.5%的类群归类为其他,可得到13个类群,如图2所示.其中,放线菌门(Actinobacteria)、变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteria)和Saccharibacteria为优势门,其相对丰度分别为16.42%~34.36%、15.28%~25.56%、10.06%~14.20%、5.68%~14.08%、6.91%~12.90%,这5类群微生物占CK、HB1、HB3、HB5、JB1、JB3、JB5相应处理总类群的76.80%、80.77%、83.28%、85.31%、83.15%、79.59%、82.70%.通过Illumina MiSeq高通量测序也检测出相对丰度较小的细菌门,它们的相对丰度为0.5%~8%,如拟杆菌门(Bacteroidetes)、芽单胞菌门(Gemmatimonadetes)、硝化螺旋菌门(Nitrospirae)、厚壁菌门(Firmicutes).与空白对照(CK)相比,生物炭施用显著提高了放线菌门(<0.01)、Saccharibacteria、硝化螺旋菌门、厚壁菌门(<0.05)的相对丰度,降低了酸杆菌门和疣微菌门的相对丰度. 在纲水平上,共获得72个类群,将相对丰度小于2%的类群归类为其他,共得到15个类群,如图3所示.其中,放线菌纲(Actinobacteria)、-变形菌纲(Alphaproteobacteria)、酸杆菌纲(Acidobacteria)为主要类群,相对丰度分别为16.42%~34.36%、9.91%~ 17.63%、5.68%~14.08%,合计为48.13%~57.08%.与空白对照(CK)相比,施加生物炭显著增加了Saccharibacteria、绿弯菌纲、热微菌纲(Thermomicrobia)、放线菌纲的相对丰度(<0.05).-变形菌纲、酸杆菌纲、-变形菌纲的相对丰度随着生物炭添加量的增加有降低的趋势. 图3 不同生物炭处理纲水平细菌组成 如图4所示,施用生物炭增加了芽孢杆菌属()、硝化螺旋菌属()、气微菌属()的相对丰度,降低了土微菌属()、细杆菌属()、根瘤菌属()的相对丰度,而慢生根瘤菌属()则无明显变化规律.随着HB施用量的增加,芽孢杆菌属、硝化螺旋菌属、土微菌属、根瘤菌属、鞘氨醇单胞菌属()的相对丰度均呈现下降趋势,仅气微菌属呈上升趋势;随着JB施用量的增加,气微菌属呈现下降趋势,与HB变化规律相反,说明生物炭对细菌属水平的影响与生物炭种类相关. 图4 不同生物炭处理8个属水平功能细菌的相对丰度 图5 不同生物炭处理细菌群落结构的层级聚类树 如图5所示,与对照相比,施加生物炭对细菌群落结构的影响显著.其中, JB3、HB3、JB53个处理距离较近,说明对土壤细菌群落结构的影响相似.JB1和HB5处于一个分支,说明不同种类的生物炭在不同添加比例下对土壤细菌群落结构的影响可达到相同效果. HB1、HB3、HB5和JB1、JB3、JB5均处于不同的分支,说明生物炭的不同添加量对细菌群落结构有影响. 图6 环境因子对细菌群落结构影响的冗余分析 如图6所示,第一主轴和第二主轴分别解释了微生物群落结构与土壤理化性质关系总变异的70.7%和24.9%.不同处理的样本点相对较分散,说明不同生物炭处理对细菌群落结构的影响不同.除JB3样本点外,生物炭处理的其他样本点与对照组CK在RDA1轴方向上明显分离.此外,在所选环境因子中,微生物量碳的解释度最高,达到了25.85%,含水率、铵态氮和有机碳分别解释了16.78%、16.61%、13.68%.如图7所示,铵态氮与放线菌门呈显著正相关关系,与绿弯菌门呈显著负相关关系.含水量与芽单胞菌门(Gemmatimonadetes)、硝化螺旋菌门(Nitrospirae)、拟杆菌门(Bacteroidetes)呈负相关关系,有机碳和全氮与绝大部分菌群呈负相关关系. 图7 细菌优势门与环境因子相关性热图 生物多样性指数用于描述生物类型数和均匀度,它可反映生物群落中物种的丰富度及其各类型的分布比[24].本研究结果显示,生物炭添加提高了土壤细菌的丰富度且3%添加量的提高程度最大,生物炭添加提高了土壤细菌的多样性,1%HB和3%JB添加量最佳,但这和丰富度的结果不一致,主要是因为细菌多样性由物种丰富度和均匀度共同决定,细菌多样性结果会因丰富度和均匀度二者所占比重而有所不同[25].Doan等[26]、Nguyen等[27]研究生物炭施用对土壤细菌特性的影响发现添加生物炭后土壤细菌的多样性提高,均与本研究结果相似.此外,生物炭的添加在一定程度上可改善土壤微环境,这可能有益于个别类群的生长,从而引起细菌群落个体大小或数量的差异,群落结构发生变化且均匀度降低,进而导致多样性指数减小,细菌群落的多样性降低[28-29].由于生物炭巨大的比表面积和疏松多孔的结构为细菌生存提供生长空间和附着位点[30],同时生物炭添加也改变了土壤的理化性质,从而影响细菌的生长代谢,直接或间接地改变了土壤的细菌多样性.通过计算多样性指数的平均值、极值和中值发现,JB>HB,说明生物炭种类不同,其内部结构不完全一样,微生物对不同生物炭引起的环境变化的适应性会有差异,所以,生物炭对细菌多样性的影响结果不同.生物炭对细菌多样性的影响程度也因为作用时间不同而产生差异.研究结果显示,生物炭短期施用会显著改变细菌的多样性[27],而随着时间的推移,生物炭对细菌多样性影响程度降低,这可能由于生物炭短期应用于土壤中,会对土壤有激发效应,土壤中氮磷钾含量均会显著提高[31],促进了土壤微生物的发育繁殖;长期应用后,土壤环境和外源生物炭逐渐融合,生物炭成为土壤环境的一部分且达到一个稳定的状态,可能不再满足某类微生物的生长繁殖,微生物多样性很难再发生变化. 生物炭对不同分类学层次菌群组成的影响不完全相同.本研究中,门水平优势菌群为放线菌门、变形菌门、绿弯菌门、酸杆菌门和Saccharibacteria,这和黄土高原地区以及东北地区关于土壤细菌群落的研究结果均相似[32].与对照相比,生物炭添加显著提高了放线菌门、硝化螺旋菌门、厚壁菌门的相对丰度,降低了酸杆菌门和疣微菌门的相对丰度,原因可能是放线菌门类群随着土壤pH值下降而丰度降低[33],且放线菌门为富营养类群,能利用速效碳源快速生长[34].生物炭的施用提高了土壤pH值,从而使放线菌门类群在含有生物炭的土壤环境中较好的生长繁殖;硝化螺旋菌门是参与亚硝酸盐的氧化和碳氮循环的主要类群,生物炭通过改变土壤基本理化性质及在土壤中的降解过程,直接或间接的增加了硝化螺旋菌门的相对丰度[35];酸杆菌门的细菌多属于寡营养类群[36],土壤的富营养状态不利于该类菌群的生长[37],生物炭施用改善了土壤养分状况,虽未达到富营养状态,但土壤环境较之前发生了变化,也抑制了该类群微生物的生长,另一方面,酸杆菌门细菌更喜欢酸性环境[38],生物炭本身具有较高的pH值,施加生物炭改变了土壤环境的酸碱度,所以酸杆菌门的相对丰度降低.本研究中纲水平优势菌群变化与门水平类似.其中,生物炭施用降低了-变形菌纲、-变形菌纲的相对丰度,且-变形菌纲的相对丰度大于-变形菌纲,这与前人研究结果一致[39].变形菌纲细菌可在酸性环境中利用难降解的碳源并转化为中间小分子物质为其他微生物提供养分[40],而该半干旱区土壤呈碱性且生物炭也增加了土壤pH值,阻碍了-变形菌纲菌群的发展,从而使-变形菌纲的相对丰度降低.此外,本研究还发现生物炭添加改变了部分功能属水平细菌的相对丰度,如生物炭增加了芽孢杆菌属、硝化螺菌属、气微菌属的相对丰度,降低了土微菌属、细杆菌属、根瘤菌属的相对丰度.研究表明,芽孢杆菌属是一种能将植物难以吸收利用的磷转化为可吸收利用的形态[41]、促进植物生长、防治植物病害[42]的一种根际菌属.水分和植被是影响芽孢杆菌的两个重要生态因子[43],生物炭施用增加了土壤的含水量,促进了植物生长,间接增加了芽孢杆菌属的相对丰度,这与Yao等[11]的研究结果相似.慢生根瘤菌属和根瘤菌属一般与草本豆科植物关联在一起,Zahran等[44]研究发现草本植物在生长过程中易与相容的根瘤菌属菌株形成有效的根瘤共生体,具有很好的固氮作用.慢生根瘤菌属与根瘤菌属变化趋势不同,因为其与根瘤菌属在系统发育关系中并不属于同一个分支[45];鞘氨醇单胞菌属具有很强的生物降解能力且对芳香化合物具有高代谢能力,该菌株被广泛应用于污染物修复方面[46].生物炭添加对鞘氨醇单胞菌属相对丰度的影响可能与生物炭的种类相关,槐树皮生物炭促进了该菌群的生长,相反地,锯末生物炭对鞘氨醇单胞菌属产生了抑制作用,相对丰度稍有降低,这与陈泽斌[47]的研究结果相似.功能菌群的改变对土壤生态功能和土壤环境健康状况的影响值得注意,但生物炭影响细菌菌群相对丰度变化的原因复杂且各不相同,还需更进一步研究. 细菌的群落结构的变化会影响生态系统的稳定和健康[31].本研究中,冗余分析图的RDA1轴将施用生物炭处理和未施用生物炭处理明显地分隔为两部分,说明生物炭添加对土壤细菌群落结构有明显的影响,这与前人的研究结果一致[28].生物炭连续施用4a对土壤的理化性质产生了显著的影响.研究表明,生物炭能有效提高土壤pH值、总有机碳、全氮含量[27,31],与本研究结果相似.而有机碳显著提高一方面可能是由于供试生物炭HB和JB的有机碳含量较高且HB大于JB,混入土壤后提高了土壤总有机碳含量,提高的幅度与施用量呈正相关,另一方面生物炭在施入土壤后可能改变土壤有机碳的有效性,增加土壤对有机碳的固持作用,从而有利于土壤有机碳的固定[48].土壤的基本特性又与土壤微生物生长密切关联.Yao等[11]研究发现土壤pH值最大程度的解释了细菌群落结构的变化.Huang等[49]研究发现土壤含水量、有机碳可以增强或削弱树种对土壤微生物的影响,是土壤微生物群落结构组成的决定因素.但在本研究中,微生物量碳,含水率、铵态氮、有机碳对细菌群落结构的影响较大,这与刘洋等[32]、zhang等[50]的研究结果相似,只是在重要性排序上略有不同,可能因为不同土壤类型的生物组成不同,环境因子对不同类群微生物的影响程度存在差异.优势细菌菌群与环境因子的相关性热图显示,铵态氮与放线菌门、绿弯菌门这两种主要类群存在显著相关关系,表明铵态氮是影响细菌群落结构的关键因子.本试验结果表明,生物炭施用量和种类对细菌群落结构的影响无明显规律,环境因子对微生物群落结构的影响也各不相同,这种群落结构的差异是否会导致土壤肥力、健康状况变化有待于进一步研究. 4.1 生物炭施加对黄土高原半干旱区4a后的土壤细菌群落有明显影响,提高了细菌多样性.主要表现为:ACE指数和Chao1指数随着生物炭添加量的增大而先增后减,在3%达到最大,香农指数在施加生物炭后呈现增加趋势,且3%JB对细菌群落的多样性影响最佳为 6.22, JB优于HB. 4.2 生物炭添加改变了部分细菌菌群的相对丰度,在不同分类学水平上均有体现.其中,主要的优势门为放线菌门(Actinobacteria)、变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)、酸杆菌门( Acidobacteria)和Saccharibacteria;主要的优势纲为放线菌纲(Actinobacteria)、α-变形菌纲(Alphaproteobacteria)、酸杆菌纲(Acidobacteria);部分属水平功能细菌的相对丰度也发生了变化,施用生物炭增加了芽孢杆菌属()、硝化螺旋菌属()的相对丰度,降低了土微菌属()、根瘤菌属()的相对丰度. 4.3 生物炭施用4a对土壤理化性质产生了显著影响,理化性质改变进一步影响了细菌群落结构.微生物量碳、含水率、铵态氮、有机碳对细菌群落结构的影响较大,铵态氮与放线菌门、绿弯菌门呈显著相关性,铵态氮是影响细菌群落结构的关键因子. [1] Reddy K R. Characteristics and applications of biochar for environmental remediation: A review [J]. Critical Reviews in Environmental Science & Technology, 2015,45(9):939-969. [2] Gunes A, Inal A, Sahi N O, et al. Variations in mineral element concentrations of poultry manure biochar obtained at different pyrolysis temperatures, and their effects on crop growth and mineral nutrition [J]. Soil Use & Management, 2016,31(4):429-437. [3] Gul S, Whalen J K, Thomas B W, et al. Physico-chemical properties and microbial responses in biochar-amended soils: mechanisms and future directions [J]. Agriculture Ecosystems & Environment, 2015, 206:46-59. [4] 高超群.生物炭在土壤环境中的应用[J]. 安徽农学通报, 2017, 23(23):55-57. Gao C Q. Application of biochar in soil environment [J]. Anhui Agricultural Science Bulletin, 2017,23(23):55-57. [5] Falkowski P G, Fenchel T, Delong E F. The microbial engines that drive Earth's biogeochemical cycles [J]. Science, 2008,320(5879): 1034-1039 [6] Zhong W H, Gu T, Wang W, et al. The effects of mineral fertilizer and organic manure on soil microbial community and diversity [J]. Plant and Soil, 2010,326(1/2):523. [7] Zheng J, Chen J, Pan G, et al. Biochar decreased microbial metabolic quotient and shifted community composition four years after a single incorporation in a slightly acid rice paddy from southwest China [J]. Science of the Total Environment, 2016,571:206-217. [8] Xu N, Tan G, Wang H, et al. Effect of biochar additions to soil on nitrogen leaching, microbial biomass and bacterial community structure [J]. European Journal of Soil Biology, 2016,74:1-8. [9] Cui E, Wu Y, Zuo Y, et al. Effect of different biochars on antibiotic resistance genes and bacterial community during chicken manure composting [J]. Bioresource Technology, 2016,203:11-17. [10] Luo L, Gu J D. Alteration of extracellular enzyme activity and microbial abundance by biochar addition: Implication for carbon sequestration in subtropical mangrove sediment [J]. Journal of Environmental Management, 2016,182:29. [11] Yao Q, Liu J, Yu Z, et al. Changes of bacterial community compositions after three years of biochar application in a black soil of northeast China [J]. Applied Soil Ecology, 2017,113:11-21. [12] Liao N, Li Q, Zhang W, et al. Effects of biochar on soil microbial community composition and activity in drip-irrigated desert soil [J]. European Journal of Soil Biology, 2016,72:27-34. [13] Chen J, Li S, Liang C, et al. Response of microbial community structure and function to short-term biochar amendment in an intensively managed bamboo (Phyllostachys praecox) plantation soil: Effect of particle size and addition rate [J]. Science of the Total Environment, 2017,574:24-33. [14] Hu L, Cao L, Zhang R. Bacterial and fungal taxon changes in soil microbial community composition induced by short-term biochar amendment in red oxidized loam soil [J]. World Journal of Microbiology & Biotechnology, 2014,30(3):1085. [15] Dai Z, Barberán A, Li Y, et al. Bacterial community composition associated with pyrogenic organic matter (biochar) varies with pyrolysis temperature and colonization environment [J]. Msphere, 2017,2(2):e00085-17. [16] Andert J, Mumme J. Impact of pyrolysis and hydrothermal biochar on gas-emitting activity of soil microorganisms and bacterial and archaeal community composition [J]. Applied Soil Ecology, 2015, 96:225-239. [17] Lehmann J, Rillig M C, Thies J, et al. Biochar effects on soil biota – A review [J]. Soil Biology & Biochemistry, 2011,43(9):1812-1836. [18] Wang T T, Stewart C E, Sun C C, et al.Effects of biochar addition on evaporation in the five typical Loess Plateau soils [J]. CATENA, 2018,162:29-39. [19] 郭艳亮,王丹丹,郑纪勇,等.生物炭添加对半干旱地区土壤温室气体排放的影响[J]. 环境科学, 2015,36(9):3393-3400.Guo Y L, Wang D D, Zheng J Y, et al. Effect of biochar on soil greenhouse gas emissions in semi-arid region [J]. Environmental Science, 2015,36(9):3393-3400. [20] 鲍士旦.土壤农化分析.3版[M]. 中国农业出版社, 2000. Bao Shidan. Soil agro-chemistrical analysis 3 [M]. China Agriculture Press, 2000. [21] Vance E D, Brookes P C, Jenkinson D S. An extraction method for measuring soil microbial biomass C [J]. Soil Biology & Biochemistry, 1987,19(6):703-707. [22] Mcbain A J, Bartolo R G, Catrenich C E, et al. Microbial characterization of biofilms in domestic drains and the establishment of stable biofilm microcosms [J]. Applied & Environmental Microbiology, 2003,69(1):177-85. [23] 杨亚东,王志敏,曾昭海.长期施肥和灌溉对土壤细菌数量、多样性和群落结构的影响[J]. 中国农业科学, 2018,51(2):290-301.Yang Y D, Wang Z M, Zeng Z H.Effects of long-Term different fertilization and irrigation managements on soil bacterial abundance, diversity and composition [J].Scientia Agricultura Sinica, 2018,51(2): 290-301. [24] 王亚男,曾希柏,王玉忠,等.设施蔬菜种植年限对氮素循环微生物群落结构和丰度的影响[J]. 应用生态学报, 2014,25(4):1115-1124.Wang Y N, Zeng X B, Wang Y Z, et al. Effects of vegetable cultivation years on microbial biodiversity and abundance of nitrogen cycling in greenhouse soils [J].Chinese Journal of Applied Ecology, 2014,25(4): 1115-1124. [25] 刘根林.转基因大豆对根际土壤微生物群落的影响及其多样性指数的度量[D]. 南京:南京大学, 2012.Liu G L. Effects of transgenic soybeans on the rhizospheric soil microbial communities and their diversity indices measurement [D]. Nanjing: Nanjing University, 2012. [26] Doan T T, Bouvier C, Bettarel Y, et al. Influence of buffalo manure, compost, vermicompost and biochar amendments on bacterial and viral communities in soil and adjacent aquatic systems [J]. Applied Soil Ecology, 2014,73(2):78-86. [27] Nguyen T T N, Wallace H M, Xu C Y, et al. The effects of short term, long term and reapplication of biochar on soil bacteria [J]. Science of the Total Environment, 2018,636:142-151. [28] 乌英嗄,张贵龙,赖 欣,等.生物炭施用对华北潮土土壤细菌多样性的影响[J]. 农业环境科学学报, 2014,33(5):965-971.Wu Y G, Zhang G L, Lai X, et al. Effects of biochar applications on bacterial diversity in fluvor-aquic soil of north china [J]. Journal of Agro-Environment Science, 2014,33(5):965-971. [29] 张玉洁,吴 婷,赵 娟,等.生物炭添加对秸秆还田土壤细菌群落结构和多样性影响[J]. 环境科学学报, 2017,37(2):712-720.Zhang Y J, Wu T, Zhao J et al. Effect of biochar amendment on bacterial community structure and diversity in straw-amended soils [J]. Acta Scientiae Circumstantiae, 2017,37(2):712-720. [30] 李 力,刘 娅,陆宇超,等.生物炭的环境效应及其应用的研究进展[J]. 环境化学, 2011,30(8):1411-1421.Li L, Liu Y, Lu Y C, et al. Review on environmental effects and applications of biochar [J]. Environmental Chemistry, 2011,30(8): 1411-1421. [31] 陈 坤,徐晓楠,彭 靖,等.生物炭及炭基肥对土壤微生物群落结构的影响[J]. 中国农业科学, 2018,51(10):1920-1930.Chen K, Xu X N, Peng J, et al. Effects of biochar and biochar-based fertilizer on soil microbial community structure [J]. Scientia Agricultura Sinica, 2018,51(10):1920-1930. [32] 刘 洋,黄懿梅,曾全超.黄土高原不同植被类型下土壤细菌群落特征研究[J]. 环境科学, 2016,37(10):3931-3938.Liu Y, Huang Y M, Zeng Q C. Soil bacterial communities under different vegetation types in the loess plateau [J]. Environmental Science, 2016,37(10):3931-3938. [33] Lauber C L, Hamady M, Knight R, et al. Pyrosequencing-based assessment of soil pH as a predictor of soil bacterial community structure at the continental scale [J]. Applied & Environmental Microbiology, 2009,75(15):5111. [34] Zeng J, Liu X, Song L, et al. Nitrogen fertilization directly affects soil bacterial diversity and indirectly affects bacterial community composition [J]. Soil Biology & Biochemistry, 2016,92:41-49. [35] 张 星,张晴雯,刘杏认,等. 施用生物炭对农田土壤氮素转化关键过程的影响[J]. 中国农业气象, 2015,36(6):709-716.Zhang X, Zhang Q W, Liu X R, et al. Effects of biochar on the key soil nitrogen transformation processes in agricultural soil [J]. Chinese Journal of Agrometeorology, 2015,36(6):709-716. [36] Bergmann M J, Driscoll D C, Emerson D T. Indium gallium nitride-based Ohmic contact layers for gallium nitride-based devices: US, US7943924 [P]. 2011. [37] 韩东东,郝振宇,高广海,等.寡营养细菌及其生态作用和应用的研究进展[J]. 微生物学通报, 2012,39(4):526-535.Han D D, Hao Z Y, Gao H G, et al. Ecological function of oligotrophic bacteria and their Applications in the environment [J]. Microbiology China, 2012,39(4):526-535. [38] Wu C, Shi L Z, Xue S G, et al. Effect of sulfur-iron modified biochar on the available cadmium andbacterial community structure in contaminated soils [J]. Science of the Total Environment, 2019,647: 1158–1168. [39] Zhang T, Shao M F, Ye L. 454pyrosequencing reveals bacterial diversity of activated sludge from 14sewage treatment plants [J]. Isme Journal, 2012,6(6):1137-1147. [40] Campbell B J, Polson S W, Hanson T E, et al. The effect of nutrient deposition on bacterial communities in Arctic tundra soil [J]. Environmental Microbiology, 2010,12(7):1842. [41] Zaidi A, Khan M S, Ahemad M, et al. Plant growth promotion by phosphate solubilizing bacteria [J]. Acta Microbiologica Et Immunologica Hungarica, 2009,56(3):263. [42] Chen Z Y, Zhang J. Research progress on antimicrobial mechanism and genetic engineering of Bacillus for plant diseases biocontrol [J]. Acta Phytopathologica Sinica, 2003. [43] 张华勇,李振高.土壤芽孢杆菌及其资源的持续利用[J]. 土壤, 2001,33(2):92-97. Zhang H Y, Li Z G. Sustainable use of Bacillus and its resources in soil [J]. Soil, 2001,33(2):92-97. [44] Zahran H H. Rhizobium-Legume symbiosis and nitrogen fixation under severe conditions and in an arid climate [J]. Microbiology & Molecular Biology Reviews, 1999,63(4):968-989. [45] 聂 刚,陈卫民,韦革宏.神木地区耐旱灌木和草本豆科植物根瘤菌遗传多样性[J]. 应用生态学报, 2014,25(6):1674-1680. Nie G, Chen W M, Wei G H. Genetic diversity of rhizobia isolated from shrubby and herbaceous legumes in Shenmu arid area, Shaanxi, China [J]. Chinese Journal of Applied Ecology, 2014,25(6):1674- 1680. [46] 徐慧敏,闫 海,马 松,等.鞘氨醇单胞菌USTB-05对微囊藻毒素的生物降解[J]. 中国环境科学, 2014,34(5):1316-1321.Xu H M, Yan H, Ma S, et al. Biodegradation of microcystins by Sphingopyxis sp. USTB-05 [J].China Environmental Science, 2014, 34(5):1316-1321. [47] 陈泽斌,高 熹,王定斌,等.生物炭不同施用量对烟草根际土壤微生物多样性的影响[J]. 华北农学报, 2018,33(1):224-232.Chen Z B, Gao X, Wang D B, et al. Effects of different biochar application rates on rhizosphere soil microbial diversity of tobacco [J].Acta Agriculturae Boreali-Sinica, 2018,33(1):224-232. [48] 罗 梅,田 冬,高 明,等.紫色土壤有机碳活性组分对生物炭施用量的响应[J]. 环境科学, 2018,(9):4327-4337.Luo M, Tian D, Gao M, et al. Soil organic carbon of purple soil as affected by different application of biochar [J]. Environmental Science, 2018,(9):4327-4337. [49] Huang Z, Wan X, He Z, et al. Soil microbial biomass, community composition and soil nitrogen cycling in relation to tree species in subtropical China [J]. Soil Biology & Biochemistry, 2013,62(5):68- 75. [50] Zhang X F, Zhao L, Xu S J, et al. Soil moisture effect on bacterial and fungal community in Beilu River (Tibetan Plateau) permafrost soils with different vegetation types [J]. Journal of Applied Microbiology, 2013,114(4):1054-1065. 致谢:本研究的现场采样工作由马江波硕士和谭连帅硕士协助完成,在此表示感谢. Effects of biochar addition on soil bacterial community in semi-arid region. WANG Ying1, SUN Ceng-ceng1, ZHOU Ji-hai2, WANG Tong-tong1, ZHENG Ji-yong1,3* (1.College of Natural Environment and Resources, Northwest A&F University, Yangling 712100, China;2.Nanchang Institute of Technology, Nanchang 330099, China;3.State Key Laboratory of Soil Erosion and Dryland Farming on the Loess Plateau, Northwest A&F University, Yangling 712100, China)., 2019,39(5):2170~2179 Using surface soils collected from Guyuan Ecological Experiment Station in Semi-arid Region restored by biochar for 4years as research objects, th effects of two types of biochar (locust tree bark biochar、sawdust biochar) at three different mass percentages (1%、3% and 5%) on soil bacterial community diversities and structures were investigated by using Miseq high-throughput sequencing technology. The results showed that the diversity of soil bacterial community was increased with biochar addition, and the diversities were higher in the treatment with sawdust biochar than that in the treatment with locust tree bark biochar. Further, 3% sawdust biochar addition had the best effect on bacterial community diversities, and its Shannon index was 6.22. The dominant taxa at phyla level were Actinobacteria, Proteobacteria, Chloroflexi, Acidobacteria and Saccharibacteria,with relative abundance of 76.80%~85.31%. The dominant taxa at class level were Actinobacteria, Alphaproteobacteria, Acidobacteria, with relative abundance of 48.13%~57.08%. At genus level, the relative abundance of the,increased, while the relative abundance of the,decreased after biochar treatmetns. Hierarchical clustering and redundancy analysis (RDA) indicated that the application of biochar greatly affected the bacteria community structures. The microbial biomass carbon, water content, ammonium nitrogen (NH4+-N), organic carbon contents had great influences on the variations of bacterial community structure. The heatmap of the correlation between taxa of dominant bacteriaand environmental factors further indicated that NH4+-N concentration was significantly correlated with Actinobacteria and Chloroflexi. Therefore, the change in NH4+-N concentration caused by biochar addition was the key factor leading to the variations of soil bacterial communities. biochar;soil bacteria;diversity;community structure;high-throughput sequencing X172 A 1000-6923(2019)05-2170-10 王 颖(1994-),女,宁夏石嘴山人,西北农林科技大学硕士研究生,研究方向为土壤污染与修复.发表论文2篇. 2018-10-23 国家自然科学基金资助项目(41571225,41661065);“十三五”国家重点研发计划项目(2016YFC0501702,2017YFC0504504);中国科学院STS项目(KFJ-STS-ZDTP-012) *责任作者, 副研究员, zhjy@ms.iswc.ac.cn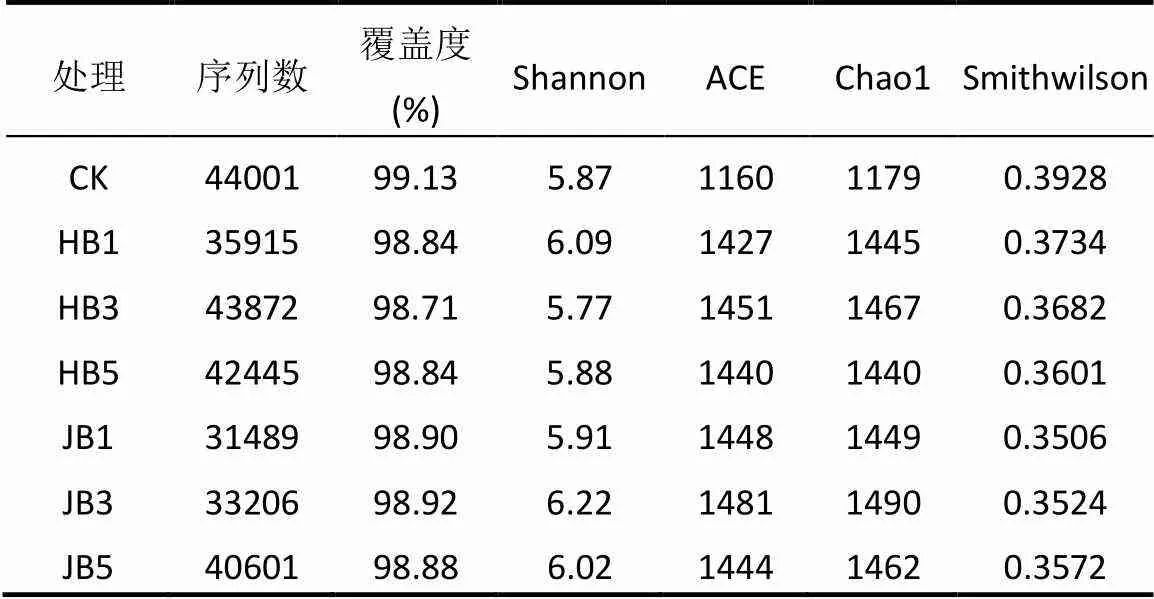
2.3 细菌群落组成

2.4 不同生物炭处理的细菌群落结构及其与环境因子的关系


3 讨论
4 结论
