全反式维甲酸对肝癌细胞系HepG2中肿瘤干细胞相关基因蛋白表达的影响
2019-05-29朱新锋白建华高红强
朱新锋,张 霞,白建华,高红强
(1.华中科技大学同济医学院附属武汉中心医院肝胆胰外科,武汉430000;2.昆明医科大学附属甘美医院肝胆胰外科,昆明 650011)
肝癌是临床上常见的恶性肿瘤之一,具有发病率高、病死率高等特点。早期肝癌常症状无特异性,随病情进展可导致肝区疼痛、乏力、消瘦等症状,严重者可引起肝衰竭,甚至引起死亡[1]。目前,肝癌的治疗方法有多种,由于多数患者被发现时已处于中晚期阶段,手术治疗疗效欠佳,化疗、放疗等治疗成为了其极重要的治疗方法,但由于肝癌的化疗耐药明显,易导致疗效欠佳,故如何提高患者的疗效具有重要的临床意义[2-3]。而全反式维甲酸(ATRA)是临床上常用的一种分化剂,已逐渐被应用于恶性肿瘤的治疗中,有利于增加癌细胞对化疗药物的敏感性,同时加速肿瘤细胞分化和凋亡[4]。对此,本研究对在肝癌细胞系HepG2中应用ATRA进行实验,探讨其对肿瘤干细胞相关基因的影响,现报道如下。
1 材料与方法
1.1材料
1.1.1材料与仪器 肝癌细胞系HepG2细胞株购于中国科学院昆明动物研究所,ATRA和二甲基亚砜(DMSO)和四甲基偶氮唑蓝(MTT)购于美国Sigma公司,双抗(青霉素/链霉素)购于上海Hyclone公司,DMEM培养基购于上海Gibico公司,0.25%胰蛋白酶购于上海Hyclone公司,细胞因子EGF、FGF2、B27购于德国Miltenyi公司,磷酸盐缓冲液(PBS)购于北京Solarbio公司,CD133磁珠、MACS分选柱、磁珠分选套装购于德国Miltenyi公司,新生胎牛血清购于杭州四季青生物工程材料有限公司,鼠抗人Cyclin D和STAT3抗体购于上海联世生物科技有限公司,显色试剂盒购于美国Pierce公司,其中ATRA通过二甲基亚砜(DMSO)溶解配制成20 mmol/L,-20 ℃避光保存,使用时通过完全培养基稀释至使用浓度。
1.1.2仪器 超净工作台(苏州净化设备厂),680型酶标仪(美国Bio-Rad公司),CO2培养箱(美国Thermo公司),倒置显微镜和共聚焦荧光显微镜(日本Olympus公司),核酸蛋白测定仪和化学发光凝胶成像仪(美国GE公司)。
1.2方法
1.2.1肝癌细胞培养 将复苏后的人肝癌细胞系HepG2细胞通过含10%胎牛血清的DMEM培养基于37 ℃、5%CO2的培养箱中进行培养,在显微镜下观察细胞生长状态和密度,选择生长状态良好和密度达到85%以上的细胞进行传代培养。
1.2.2HepG2肝癌细胞株中CD133+细胞的磁珠分选 取出培养箱中的HepG2进行胰酶消化后,在细胞冲洗液里加入FcR Blocking 20 μL和CD133磁珠抗体20 μL,混匀后在4 ℃孵育30 min后进行磁珠抗体孵育,再进行磁珠分选,分选出CD133+的HepG2肝癌干细胞。
1.2.3干细胞培养、纯化和鉴定 肝癌干细胞(HepG2/CD133+)的培养基为不含酚红的DMEM/F12,含有20 ng/mL EGF、10 ng/mL FGF2和1%B27生长因子以维持干细胞的干性和生长;细胞培养于悬浮细胞6孔培养皿中,当细胞生长到5 d形成干细胞球后,300 r/min离心收集细胞;移除上清液,加入1 mL胰酶进行重悬,静置5 min;用移液器反复吹打直至细胞球变成单个细胞,PBS清洗后再次300 r/min离心收集细胞;去除上清液,将细胞重悬于干细胞培养基中,按1∶2比例传代于新的6孔悬浮细胞培养板中;每天观察细胞状态,防止污染;CD133+细胞每培养3代后(每代5~7 d),用CD133磁珠抗体进行分离纯化,保证CD133的高阳性率,分离纯化后进行流式细胞鉴定CD33+细胞纯度。
1.2.4细胞增殖实验(MTT法) 取培养后肝肿瘤相关间充质干细胞样细胞以2.5×107/L密度接种于96孔板,调整细胞浓度为5×103/mL、每孔200 μL、边缘孔200 μL的PBS填充,按1∶1比例分为高量组、低量组、对照组,待细胞贴壁后弃去培养液,PBS轻洗3次,高量组加入10 μmol/L ATRA,低量组加入1 μmol/L ATRA,对照组不作任何处理,按 1、5、10 d共3个时相培养,每孔加入10 μL的MTT(5 g/L)孵育 4 h后,每孔加入100 μL DMSO终止,振荡10 min,全自动酶标仪检测570 nm波长吸光度(A),每个浓度设置6个复孔,3次实验,取平均值。
1.2.5Cyclin D和STAT3基因蛋白检测(蛋白质印迹法) 提取细胞总蛋白、测定蛋白浓度后定量、加上样缓冲液99 ℃变性10 min、蛋白上样后,电泳、转硝酸纤维素膜,5%脱脂牛奶封闭2 h后,按分别加入1∶1 000的Cyclin D和1∶20 000的GAPDH一抗,4 ℃过夜杂交,第2天洗膜后分别加入羊和鼠二抗室温杂交1 h,洗膜后加入显影液显影,以对照组1.00为对照,3次实验,取平均值,以相同的方法测定STAT3基因蛋白表达情况。

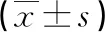
表1 ATRA对HepG2肝癌干细胞增殖能力的影响
2 结 果
2.1ATRA对HepG2肝癌干细胞增殖能力的影响 HepG2肝癌干细胞在1、5、10 d细胞增殖能力方面,高量组、低量组、对照组呈逐渐上升趋势,但高量组上升值明显低于低量组,低量组上升值明显低于对照组,差异有统计学意义(P<0.05),见表1、图1。
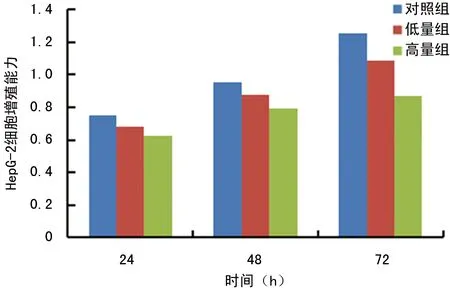
图1 ATRA对HepG2肝癌干细胞增殖能力的影响
2.2ATRA对HepG2肝癌干细胞Cyclin D基因蛋白表达的影响 蛋白质印迹法结果表明,与对照组比较,高量组、低量组Cyclin D基因蛋白表达水平不断下降,但高量组下降值明显高于低量组,差异有统计学意义(P<0.05),见表2、图2~3。
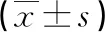
表2 ATRA对HepG2肝癌干细胞Cyclin D基因蛋白表达的影响
2.3ATRA对HepG2肝癌干细胞STAT3基因蛋白表达的影响 蛋白质印迹法结果表明,与对照组比较,高量组、低量组STAT3基因蛋白表达水平不断下降,但高量组下降值明显高于低量组,差异有统计学意义(P<0.05),见表3、图4和5。
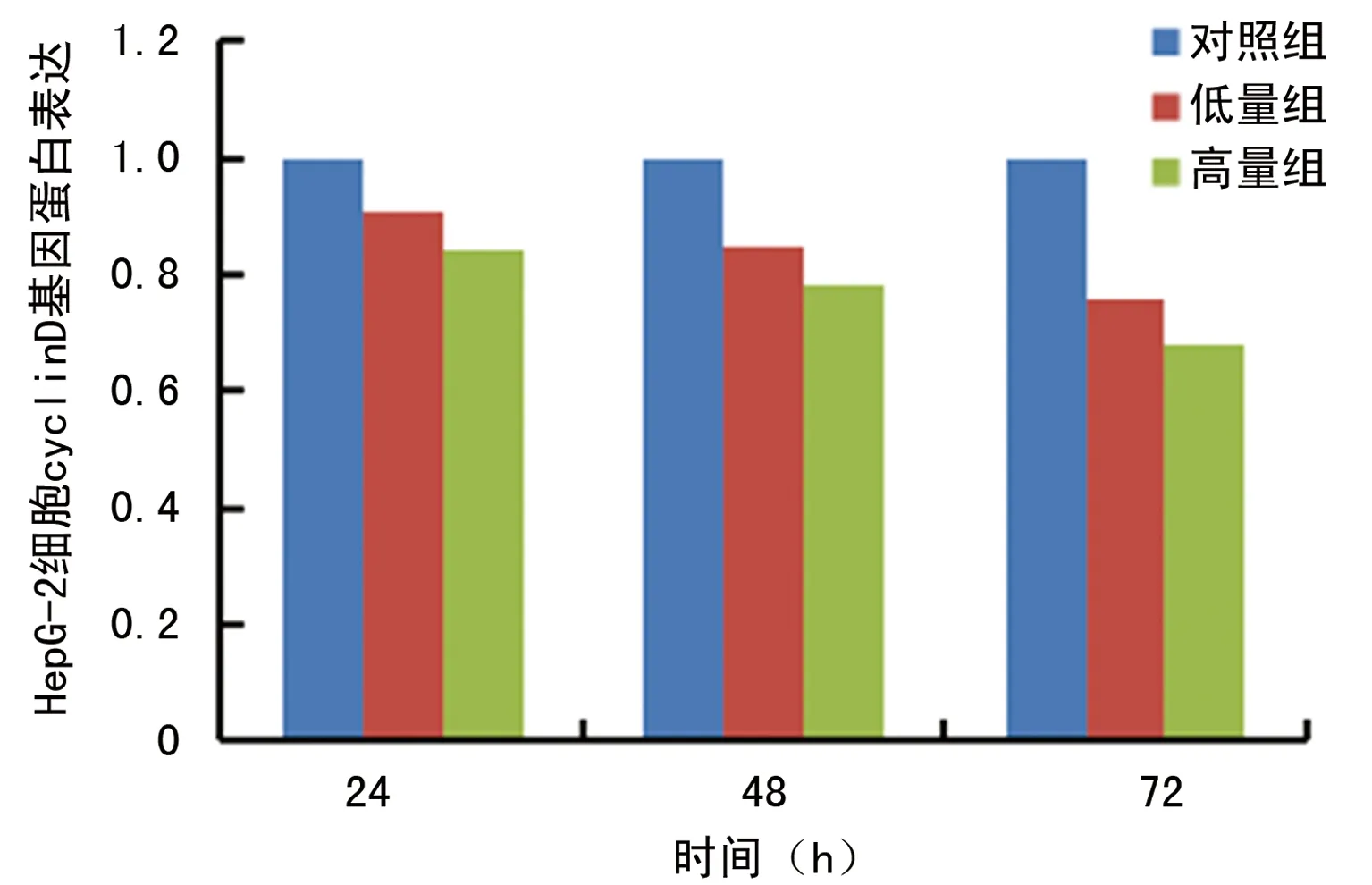
图2 ATRA对HepG2肝癌干细胞Cyclin D基因蛋白表达的影响
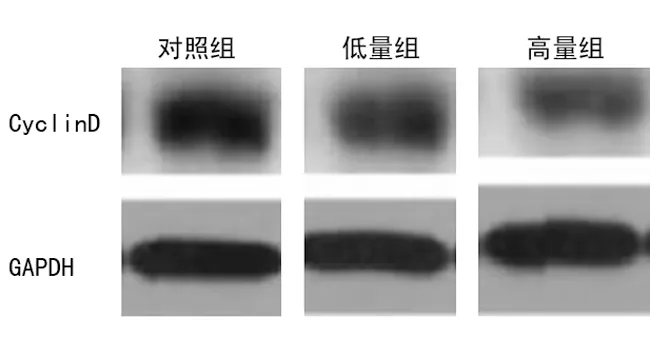
图3 Cyclin D基因蛋白蛋白质印迹法

组别孔数(n)1 d5 d10 d下降值对照组321.00±0.001.00±0.001.00±0.000低量组320.94±0.080.88±0.060.82±0.050.20±0.03高量组320.87±0.070.79±0.050.70±0.040.31±0.04F20.43626.75138.92753.612P<0.05<0.05<0.05<0.05
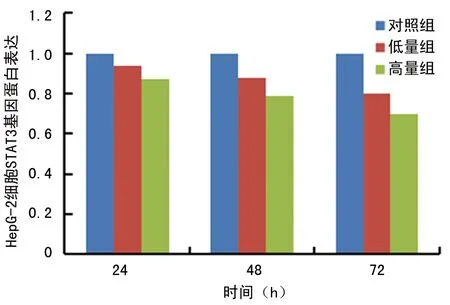
图4 ATRA对HepG2肝癌干细胞STAT3基因蛋白表达的影响
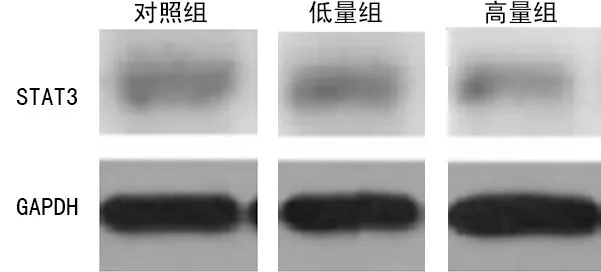
图5 STAT3基因蛋白蛋白质印迹法
3 讨 论
肝癌是指发生在肝脏部位的恶性肿瘤病变,其病因尚未明确,是一个多因素、多步骤的复杂过程,主要与病毒感染、环境、肝硬化等有关,患者在早期一般无临床症状亦难以察觉,临床确诊时多已至中晚期,导致无法接受手术切除治疗[5]。而化疗是临床上治疗肝癌的重要方法之一,通过化疗药物的细胞毒作用可有效灭杀肝癌细胞,但由于肝癌细胞易出现化疗耐药,影响患者的治疗效果,故如何有效确保患者的临床疗效具有重要的价值[6]。
有研究表明,肿瘤组织中存在一类具有干细胞性状的肿瘤细胞即肿瘤干细胞,有自我更新、多能分化、高速增殖等特性,这类细胞在肿瘤细胞中占有的比例虽小,但可高表达耐药相关基因,以对抗肿瘤细胞凋亡及改变肿瘤细胞表面的药物作用靶点,还可将化疗药物泵出肿瘤细胞,使细胞毒类药物对静息期的肿瘤干细胞及活跃期肿瘤细胞的杀伤作用下降,从而对化疗药物产生抗性[7]。目前已明确的肝癌干细胞标志有CD133、EpCAM、CD44、OV6、CK19、CD90 和甲胎蛋白(AFP)等,其中CD133最具代表性[8],本研究选用肝癌公认且最常见的CD133抗原作为分选标记。
而有研究表明,细胞周期检测点是细胞增殖调控的关键位点,Cyclin D蛋白则是调节G1期细胞增殖信号的关键蛋白,可与CDK4或CDK6形成激酶复合物,在细胞增殖过程中发挥重要作用,如加快释放转录因子E2F、使关键底物 PRb磷酸化等,进而促使细胞生长周期加快,在肿瘤干细胞中呈高表达状态,在诱导细胞恶性增殖中发挥重要的作用[9]。同时,有研究显示STAT3基因是肿瘤发生、发展的关键转录因子,可参与调节肿瘤细胞的增殖、凋亡、转移等一系列生物学行为的信号通路,其基因表达可促使肿瘤细胞增殖、抗凋亡、缺氧反应、转移、血管生成等多种相关基因的表达,从而增强肿瘤细胞增殖、转移、侵袭等生物学行为的能力[10]。
ATRA是临床上常用的一种分化剂,是动物体内维生素A的代谢中间产物,具有诱导肿瘤细胞分化和凋亡、增加癌细胞对化疗药物敏感性、促进免疫细胞增殖、增强免疫细胞对肿瘤细胞杀灭作用等作用,已逐渐被应用于多种恶性肿瘤治疗中,且具有良好的疗效[11]。
本研究通过在肝癌细胞系HepG2中应用ATRA进行实验,在HepG2肝癌干细胞1、5、10 d的A570值方面,高量组、低量组、对照组呈逐渐上升趋势,但高量组上升值明显低于低量组,低量组上升值明显低于对照组,表明ATRA可有效抑制HepG2肝癌干细胞的增殖,且其药物浓度越高,抑制作用越显著。这可能是由于ATRA可诱使肿瘤干细胞分化,使异常的肿瘤干细胞分裂方式增加细胞数量的复杂过程得以恢复,并使其分化[12-13],尤其是使其中的肝肿瘤干细胞分化而失去干细胞自我更新、多能分化、高速增殖等特性,进而被ATRA诱导和分化为肝癌细胞,从而有效抑制HepG2肝癌干细胞的增殖。同时,随着时间的推移,可能因为增殖周期(2~3 d)比肝癌干细胞短(5~7 d),肝癌细胞又可再被ATRA分化为增殖周期接近正常的细胞[13-14],从而有效降低了肿瘤细胞侵袭及迁移能力及抑制了肿瘤的复发与转移,并有效减少了干细胞高表达耐药相关基因的作用,有利于提高疗效。同时研究中发现蛋白质印迹法ATRA的1、5、10 d结果表明,与对照组比较,高量组、低量组Cyclin D和STAT3基因蛋白表达水平不断下降,但高量组下降值明显高于低量组,表明ATRA可有效降低肝癌细胞系HepG2中肿瘤干细胞Cyclin D、STAT3等基因蛋白表达水平。这可能是ATRA能够有效激发肝肿瘤干细胞的分化潜能,使肝肿瘤干细胞周期得以调节,导致肝肿瘤干细胞无法获得自主生长信号,尤其是可能通过抑制调节G1期细胞增殖信号的关键蛋白Cyclin D的表达,使肝肿瘤干细胞增殖周期延长,并可能通过抑制STAT3基因的活化,使肝肿瘤干细增殖、抗凋亡、缺氧反应、转移、血管生成等多种相关基因的表达下降[15],有效抑制了HepG2肝癌干细胞的增殖并诱导其向肝肿瘤细胞分化,并随着ATRA的持续分化作用,能够进一步促使肝肿瘤细胞趋向分化为接近正常的细胞,从而减弱肝肿瘤细胞增殖、转移、侵袭等生物学行为的能力。但本研究仍存在不足,ATRA如何下调Cyclin D、STAT3的机制及相关通路仍不清楚,还需做大量的研究以作探讨。
综上所述,ATRA可有效降低HepG2肝癌干细胞Cyclin D、STAT3等基因蛋白表达水平,有利于抑制HepG2肝癌干细胞的增殖。
