镉、汞暴露在中华绒螯蟹卵巢中的富集及其氧化应激反应
2019-05-29陈润琦叶方源林锦煌周佳仪蔡佳佳应雪萍
陈润琦 叶方源 林锦煌 周佳仪 蔡佳佳 应雪萍
(温州大学生命与环境科学学院, 温州 325027)
随着沿海经济的快速发展, 水体日趋严重的重金属污染将对水生动物产生一定的毒害作用[1—3]。研究显示, 海洋环境中Cd2+、Hg2+、Cr2+、Pb2+等重金属含量较高, 其中Hg2+和Cd2+被列为重点重金属污染物之一[2,4]。Cd2+和Hg2+暴露会使动物组织产生活性氧自由基(Reactive Oxygen Species, ROS),ROS可以与体内脂质、蛋白质和核酸反应, 引发脂质过氧化, 导致细胞氧化损伤[5—8]。其中, 丙二醛(MDA)、过氧化氢(H2O2)、一氧化氮(NO)被认为是检测细胞氧化损伤以及凋亡的重要指标[9—11]。生物体在进化过程中具备有效的抗ROS防御体系,如超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GPx)、过氧化氢酶(CAT)等[9,12—13]。研究表明,Cd、Hg等重金属可以改变动物体内抗氧化酶(SOD、GPx、CAT)活性, 降低细胞对自由基及其产物的清除能力[6,14—15]。金属硫蛋白(Metallothionein, MT)是一类富含半胱氨酸的胞内蛋白质,具有较强的重金属解毒和调节机体抗氧化能力[16],MT在转录水平上易被重金属所诱导, 且与重金属浓度相关, 能有效地反映动物受重金属胁迫程度[17—19]。
重金属对水生动物雌性生殖细胞的毒性较为敏感且影响深远[1,20—22]。汞和镉会影响水生动物卵巢结构、延迟卵巢的发育和成熟、降低卵的孵化率, 并使卵巢产生氧化损伤[21—26]。中华绒螯蟹(Eriocheir sinensis)又称河蟹, 属甲壳纲(Crustacea),方蟹科(Grapsidae), 绒螯蟹属(Eriocheir), 是我国重要的经济水产品。研究表明, 中华绒螯蟹体内有一定量的重金属富集, 且具有性别和组织差异性[2,27]。Cd2+会影响中华绒螯蟹卵黄蛋白的合成, 干扰血淋巴中孕酮向雌二醇的转化, 进而抑制卵巢的发育[28]。但在重金属诱导下中华绒螯蟹卵巢是否会产生氧化损伤? 以及机体的抗氧化酶和MT将产生怎样的氧化应激反应? 针对这2个问题, 本文用不同浓度的Cd2+和Hg2+对中华绒螯蟹进行急性染毒, 研究Cd2+和Hg2+在中华绒螯蟹卵巢中的富集情况以及对相关氧化应激指标的影响, 阐明Cd2+和Hg2+浓度与中华绒螯蟹卵巢氧化应激相关指标的剂量——效应关系, 探讨MT和抗氧化酶在Cd2+或Hg2+诱导下可能的氧化应激机理, 为甲壳动物的生殖毒理提供基础资料。
1 材料与方法
1.1 材料
实验用的二龄雌性中华绒螯蟹成体于2016年11月取自温州乐清南塘养殖场, 共500多只, 随机取100只文蛤, 测量其大小及重量。其甲壳长、宽、高分别为(48.83±0.62) mm (44.87—54.02 mm)、(45.32±0.46) mm (43.25—49.14 mm)、(24.78±0.32) mm(22.82—27.10 mm), 体重为(52.61±1.33) g (42.25—67.16 g)。
1.2 染毒处理
根据Cd2+和Hg2+对中华绒螯蟹的96hLC50分别为40.28和3.64 mg/L[29]的1/64、1/32、1/16、1/8和1/4设置Cd2+、Hg2+单独染毒时的浓度梯度分别为0.63、1.26、2.52、5.04、10.07 mg/L和0.06、0.11、0.23、0.46、0.91 mg/L, 同时设对照组。实验时随机选取活动正常、反应灵敏、大小相似的个体500多只。每组浓度设3个平行样, 每个平行样中放30只中华绒螯蟹, 饲养在130 cm×50 cm×60 cm的养殖箱中, 水温为(22±1)℃, pH为7.8。每隔24h更换相应浓度的染毒液, 清除代谢废物。根据实验期间蟹的活性及急性染毒的效果, 实验选取染毒时间为6d,期间不喂食。
1.3 重金属含量测定
取染毒6d后的各浓度组和对照组中华绒螯蟹各5只作为1组, 共3组。用去离子水冲洗干净后, 活体解剖取出卵巢组织, 分别称重后放入烘箱烘干至恒重, 称其干重。准确称取研磨成粉末状的卵巢组织0.5 g于微波消解罐中, 各加5 mL浓硝酸和2 mL的高氯酸混合均匀、消解, 然后在电热板上于140—160℃(Cd)或80℃(Hg)赶酸至0.5—1.0 mL。冷却后将消化液转移至50 mL容量瓶中, 用少量硝酸溶液(1%)洗涤消解罐2—3次, 合并洗涤液, 用硝酸溶液(1%)定容至刻度, 混匀。用0.22 μm滤膜过滤, 作为待测溶液。其中Hg的含量采用原子荧光光谱仪(AFS-930北京吉天仪器有限公司)测定, Cd含量使用原子吸收光谱仪测定(AA240Fs, 美国瓦里安有限公司)。
1.4 MT mRNA表达量的测定
根据UNIQ-10柱式Tizol总RNA抽试剂盒(上海生工)说明提取对照组及各染毒组中华绒螯蟹的卵巢总RNA。RNA的完整性和浓度分别通过1%琼脂糖凝胶电泳和A260/A280值来检测。以中华绒螯蟹卵巢总RNA为模板, 使用Reverse Transcription System反转录试剂盒制得cDNA样品。根据NCBI数据库已公布的中华绒螯蟹金属硫蛋白MT-1基因序列(GenBank: GU479377), 中华绒螯蟹MT特异性引物设计参照Ren等[30], 确定荧光定量目的基因引物为MT-F 5′-GTCATCACAGCAGCCAGC-3′, MT-R 5′-GCATCTCCTTCCCAACG-3′, 内参基因引物为β-actin-F 5′-TGCCAGGGTACATTGTGGTA-3′, βactin-R 5′-TGCGTGACATCAAGGAGAAG-3′。使用Roche LC480荧光定量PCR仪(瑞士)和AGoTaq®qPCR Master Mix试剂盒对卵巢组织中MTmRNA的表达进行相对定量分析。扩增程序为: 预变性94℃ 5min; 94℃变性30s, 60℃退火15s, 72℃延伸30s, 42个循环; 采用2-ΔΔCt法计算出各测试样本MTmRNA的相对表达量: ΔCt=CtMT-Ctβ-actin, ΔΔCt=ΔCt实验组- ΔCt对照组。
1.5 氧化应激生化指标测定
待测液的制备取染毒6d后的中华绒螯蟹活体, 将其置冰盘内解剖, 取出各浓度组的卵巢,5只蟹一组作为酶液制备的材料。取不同浓度组的卵巢湿重约1 g, 加入9倍(w/v)预冷的生理盐水, 在冰浴中充分研磨匀浆, 所得匀浆液再置于冷冻离心机(转速3000 r/min, 温度0℃)中离心15min, 最后取上清液测定SOD、CAT、GPx和NOS活性或H2O2、MDA和NO的含量, 酶液保存在-60℃冰箱中, 24h内完成测定。
氧化应激相关指标的测定参考相关的试剂盒说明书(南京建成)对H2O2、MDA、NO含量及SOD、CAT、GPx、NOS活性进行检测, 每个指标用同一浓度3个平行组中的蟹各测一次, 得3组数据。
蛋白质含量的测定总蛋白测定用的试剂盒为南京建成生物研究所生产, 用考马斯亮蓝法(Bradford法)的测定方法和酶活力单位定义均参见说明书。
1.6 数据分析
实验所得的数据均用SPSS 19.0软件进行分析,用单因子方差分析(one-way ANOVA,F)和LSD检验差异显著性, 使用OriginPro 8.0对所得数据进行相关图形绘制。数据均以平均值±标准误表示,P<0.05即为差异显著。
2 结果
2.1 镉、汞在中华绒螯蟹卵巢中的富集量
由表1可知, 在实验设置的浓度和染毒时间内,随着Cd2+和Hg2+染毒浓度的上升, Cd和Hg在中华绒螯蟹卵巢组织中的积累量呈上升趋势, 具明显的浓度-效应关系。对照组除与0.63 mg/L Cd2+以及0.06 mg/L Hg2+浓度组无显著差异外(P>0.05), 与其他浓度组均有显著差异(P<0.05)。
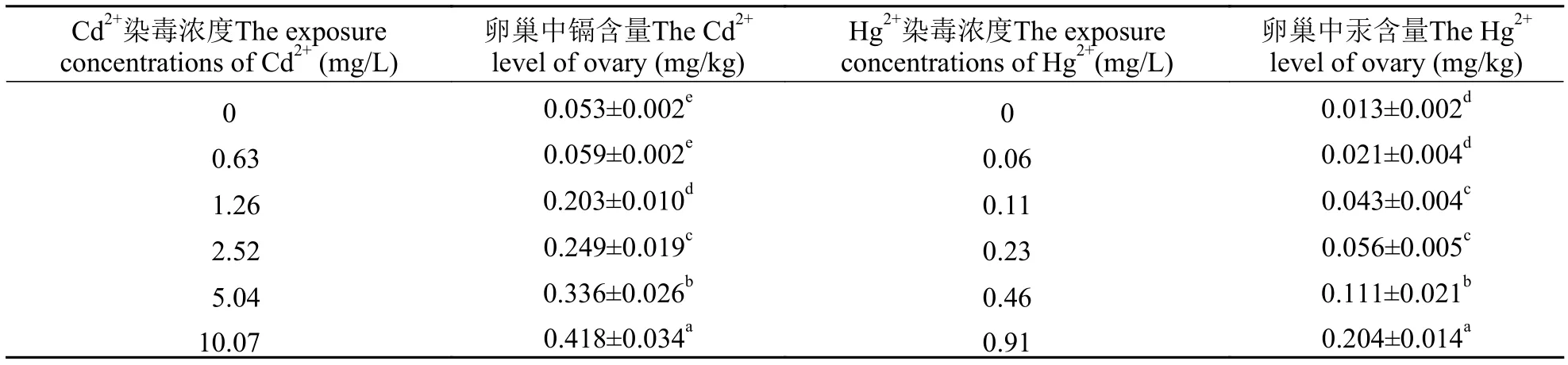
表1 中华绒螯蟹卵巢中镉、汞富集量Tab. 1 Accumulation of Cd2+ and Hg2+ in the ovary of E. sinensis
2.2 Cd2+和Hg2+对中华绒螯蟹卵巢抗氧化酶活性的影响
图1显示, 随着Cd2+染毒浓度的上升中华绒螯蟹卵巢中的抗氧化酶活性总体呈先升后降的趋势,但3种酶活性达到最大值的浓度不一。SOD活性在5.04 mg/L Cd2+浓度组达到最大值, 且与对照组及其他浓度组均有显著差异(P<0.05), 对照组与各浓度组也均有显著差异(P<0.05)。CAT酶活性在2.52 mg/L浓度组达到最大值, 除0.63与1.26 mg/L浓度组无显著差异外(P>0.05), 其他各组均有显著差异(P<0.05)。GPx活性在1.26浓度组活性最大, 除0.63浓度组与10.07浓度组无显著差异外(P>0.05), 其他各组均有显著差异(P<0.05)。
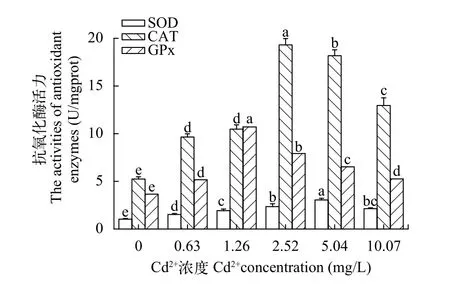
图1 镉对中华绒螯蟹卵巢抗氧化酶活性的影响Fig. 1 The effect of Cd2+ on antioxidant enzyme activities of E.sinensis ovary
随着Hg2+染毒浓度的升高, 中华绒螯蟹卵巢中抗氧化酶活性总体也呈先升后降的趋势, 除0与0.46 mg/L Hg2+浓度组的GPx活性无显著差异外(P>0.05), 3种抗氧化酶的其他各浓度组间均有显著差异(P<0.05)(图2), 但这3种酶活性达到最大值的浓度不同。SOD在0.46 mg/L浓度组达到最大,CAT活性在0.23 mg/L浓度组达到最大, 而GPx活性在0.11 mg/L浓度组达最大值。
2.3 Cd2+和Hg2+对中华绒螯蟹卵巢MT mRNA表达量的影响
从图3和图4可知, 随着Cd2+及Hg2+染毒浓度的升高,MTmRNA表达量均呈上升趋势。Cd2+染毒组中对照组除与0.63 mg/L浓度组无显著差异外(P>0.05), 其他各组均有显著差异(P<0.05)。Hg2+染毒组中对照组与各浓度组均有显著差异(P<0.05)。
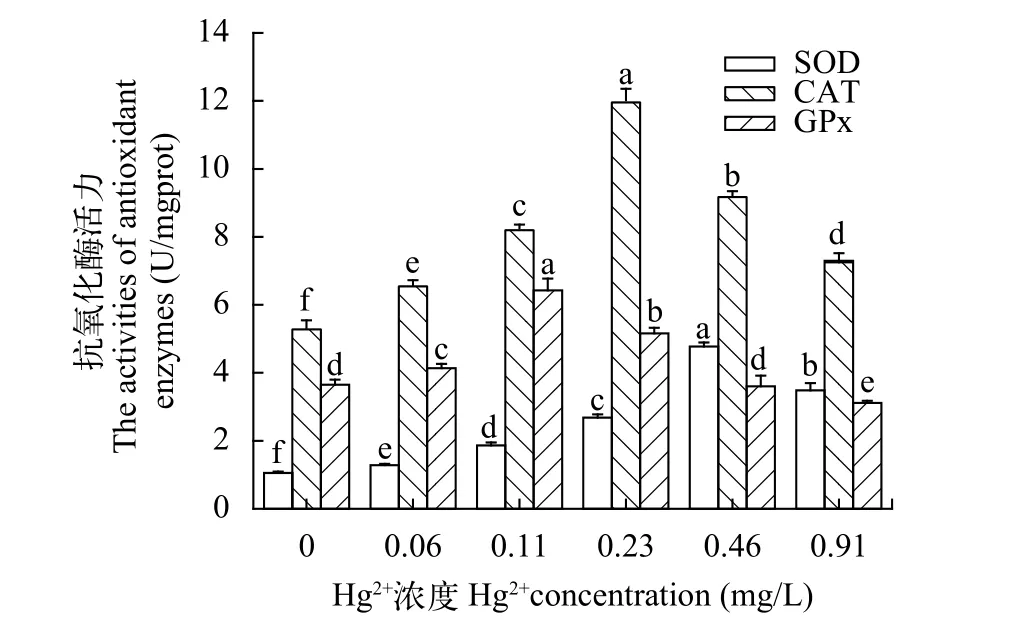
图2 汞对中华绒螯蟹卵巢抗氧化酶活性的影响Fig. 2 The effect of Hg2+ on antioxidant enzyme activities of E.sinensis ovary

图3 镉对中华绒螯蟹卵巢MT mRNA表达量的影响Fig. 3 The effect of Cd2+ on MT mRNA of E. sinensis ovary
2.4 Cd2+和Hg2+对中华绒螯蟹卵巢MDA和H2O2含量的影响
由图5和图6可知, MDA和H2O2的含量均与Cd2+和Hg2+染毒浓度呈正相关, 对照组与各浓度组均有显著差异(P<0.05)。

图4 汞对中华绒螯蟹MT mRNA表达量的影响Fig. 4 The effect of Hg2+ on MT mRNA of E. sinensis ovary
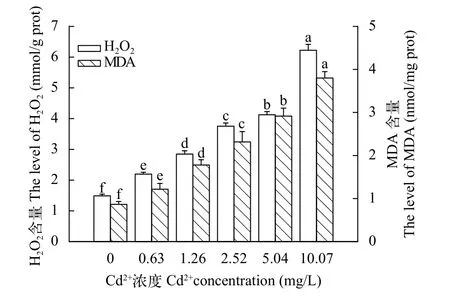
图5 镉对中华绒螯蟹卵巢MDA和H2O2含量的影响Fig. 5 The effects of Cd2+ on MDA and H2O2 level of E. sinensis ovary
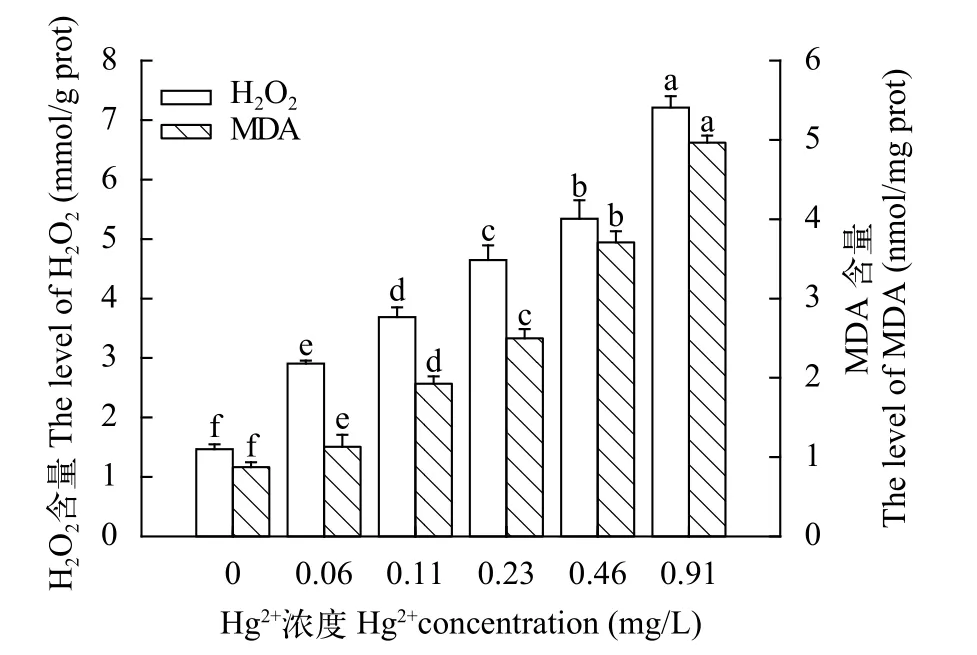
图6 汞对中华绒鳌蟹卵巢MDA和H2O2含量的影响Fig. 6 The effects of Hg2+ on MDA and H2O2 level of E. sinensis ovary
2.5 Cd2+和Hg2+对中华绒螯蟹卵巢NO含量和NOS活性的影响
Cd2+和Hg2+对中华绒螯蟹卵巢中NO含量的影响由图7可见, 随着Cd2+染毒浓度的增加, 中华绒螯蟹各处理组卵巢中的NO含量呈现上升的趋势。对照组与0.63及1.26 mg/L浓度组无显著差异,5.04和10.07 mg/L浓度组间无显著差异(P>0.05),2.52 mg/L与所有组间均有显著差异(P<0.05)。
随着Hg2+染毒浓度的增加, 中华绒螯蟹各处理组卵巢中的NO含量呈上升的趋势(图8)。对照组除与0.06 mg/L浓度组无显著差异外(P>0.05), 其他各组均有显著差异(P<0.05)。

图7 镉对中华绒螯蟹卵巢NO含量的影响Fig. 7 The effect of Cd2+ on NO content of E. sinensis ovary
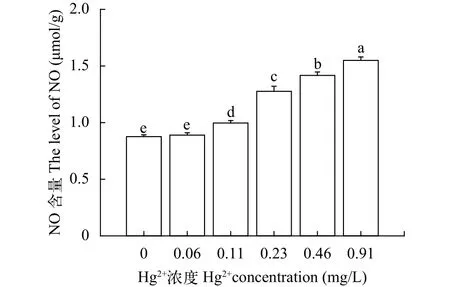
图8 汞对中华绒螯蟹卵巢NO含量的影响Fig. 8 The effect of Hg2+ on NO content of E. sinensis ovary
Cd2+和Hg2+对中华绒螯蟹卵巢NOS活性的影响由图9可见, 随着Cd2+浓度的增加, 中华绒螯蟹各处理组卵巢NOS活力总体呈上升趋势。TNOS酶活在对照组与0.63 mg/L浓度组无显著差异、1.26与2.52 mg/L浓度组也无显著差异(P>0.05);5.04及10.07 mg/L浓度组与其他各组均有显著差异(P<0.05)。对照组中华绒螯蟹卵巢的iNOS活性与0.63 mg/L浓度组无显著差异; 1.26和2.52 mg/L浓度组无显著差异; 5.04和10.07 mg/L浓度组也无显著差异(P>0.05)。
随着Hg2+浓度的增加, 中华绒螯蟹各处理组的卵巢NOS活力呈上升的趋势(图10)。对照组的TNOS酶活除与0.06 mg/L浓度组无显著差异(P>0.05)外, 与其他各组均有显著差异(P<0.05)。0.06 mg/L浓度组的中华绒螯蟹卵巢iNOS活性与对照组及0.11 mg/L浓度组无显著差异; 0.23和0.46 mg/L浓度组的iNOS活性也无显著差异(P>0.05); 0.91 mg/L Hg2+浓度组的iNOS活性达到最大值, 并与对照组及其他浓度组均有显著差异(P<0.05)。
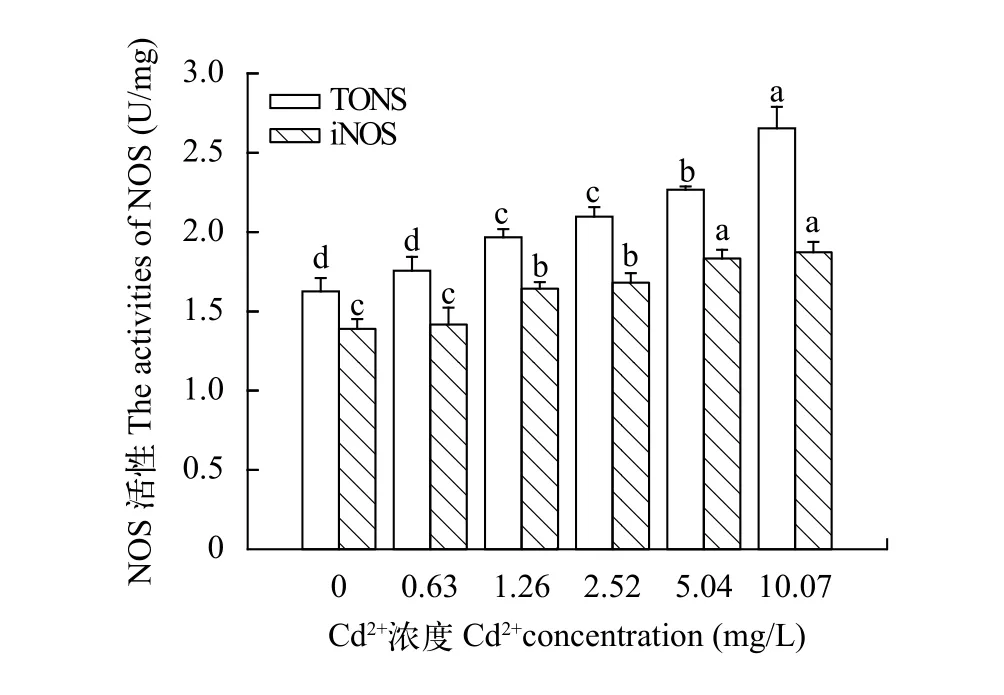
图9 镉对中华绒螯蟹卵巢NOS活性的影响Fig. 9 The effect of Cd2+ on NOS activity of E. sinensis ovary

图10 汞对中华绒螯蟹卵巢NOS活性的影响Fig. 10 The Effect of Hg2+ on NOS activity of E. sinensis ovary
3 讨论
3.1 重金属对水生动物组织的氧化损伤效应
镉、汞等重金属是一类典型的环境污染物, 极易在水生动物体内富集, 从生物大分子(如DNA,RNA, 各种酶)开始对生物体产生影响, 然后逐步在细胞、器官、个体、种群和生态系统各个水平上反映出来[5,11,12]。中华绒螯蟹经Cd2+或Hg2+染毒6d后, 在卵巢中Cd和Hg的富集量急剧上升, 最高浓度Cd2+(10.07 mg/L)和Hg2+(0.91 mg/L)组的Cd和Hg富集量分别为对照组的9.07倍和15.69倍(表1),具有明显的浓度-效应关系。有研究表明, Cd2+进入蟹的主要方式可能为自由扩散作用或者借助钙离子通道[31]; 而蟹对Hg2+的吸收主要是通过鳃直接摄取或通过食物链间接获取[32]。本研究发现Hg在中华绒螯蟹卵巢中的富集能力比Cd强, 这可能是急性染毒后中华绒螯蟹鳃直接摄取Hg的能力远比Cd的自由扩散能力强。随着Cd和Hg在中华绒螯蟹卵巢中积累量的不断增加, 在卵巢中NO、MDA和H2O2的含量也呈逐渐上升(图5—8), 说明细胞的氧化损伤程度不断提高, 这主要因为重金属在卵巢中的积累诱导其产生大量的活性氧自由基(ROS), 引发机体脂质过氧化作用, 使MDA在机体内的含量不断增加[6]。而H2O2和NO都是由活性氧前体O-2衍生而来, 其中H2O2是氧的二电子还原产物, NO是氧的三电子还原产物[10,11], 故卵巢中H2O2和NO的含量也不断增加。类似的研究在双壳类[5,6,8,12,33,34]、甲壳类[11,20,35,36]和鱼类[3,25,37]中均有发现。Lin等[11]研究发现, 随着Cd2+染毒浓度的上升, 中华绒螯蟹肝胰腺中的MDA和H2O2含量均呈上升的趋势。金芬芬等[38]研究发现, 随着Cd2+染毒浓度的增加或染毒时间的延长, 河南华溪蟹(Sinopotamon henanense)肝胰腺线粒体中的H2O2含量较对照组明显增高。Company等[5]报道了贻贝(Mytilus edulis)暴露在0.9 μmol/L的Cd2+溶液里24h后, 其鳃中MDA含量显著升高, 具一定的剂量-效应关系。马京津等[39]认为重金属诱发的MDA可以影响河南华溪蟹(S.henanense)生殖细胞的发生和发育, 进而导致生殖细胞质量下降, 最终影响溪蟹子代的生长发育。李静等[40]发现, 随着Cd2+浓度的上升长江华溪蟹(S.yangtsekiense)肝胰腺中NO含量和NOS活性均呈上升的趋势。从图5和图6也可以看出, 在Cd2+或Hg2+LC50的1/64、1/32、1/16、1/8或1/4的相对应条件下, Hg2+染毒组的MDA和H2O2含量比Cd2+染毒组高, 说明Hg2+对中华绒螯蟹的毒性要比Cd2+强, 这与中华绒螯蟹对Hg的富集能力比Cd强(表2)一致。
3.2 重金属胁迫下金属硫蛋白(MT)和抗氧化酶的作用分析
MT是一种低分子量、富含半胱氨酸的金属结合蛋白, 被认为是体内对羟基自由基最强的清除剂,具有对重金属的解毒和对微量元素代谢的调节作用[16,41]。有研究显示, 重金属暴露会诱导水生动物机体内MTmRNA的表达[17—19,42,43]。本研究发现,随着中华绒螯蟹卵巢对Cd或Hg富集量的增加, 与对照组相比MTmRNA的表达量呈明显上升的趋势(表1、图3、图4), 说明MT对Cd和Hg等非必需金属有一定的解毒作用, 也说明在本实验染毒范围内中华绒螯蟹卵巢中的Cd和Hg累积量还没有达到MT解毒的阈值。Pan等[17]发现, 在0.025和0.05 mg/L Cd2+暴露3d后, 日本蟳(Charybdis japonica)鳃和肝胰腺中MT均显著升高, 与暴露时间和浓度呈正相关。Gao等[44]的研究也发现, 随着Cd2+暴露浓度的升高和染毒时间的增长, 长江华溪蟹(S. yangtsekiense)肝胰腺MTmRNA的表达水平均呈上升的趋势。这可能因为在镉、汞等重金属进入中华绒螯蟹后结合到位于金属硫蛋白上游序列的金属效应元件中, 从而对MTmRNA在转录水平的表达产生诱导作用。
MTmRNA的水平与组织中重金属积累水平有关, 如果组织中的重金属积累了超过了可承受的范围,MTmRNA的表达水平就会受到抑制[17—19]; 多余的重金属会与一系列含有巯基、氨基、羧基、磷酰基等活性基团的抗氧化酶结合, 改变其构象和活性甚至变性[6,12]。内源性抗氧化剂SOD、CAT和GPx是机体抗氧化防御系统的重要组成部分[13,14,17,36]。SOD能清除超氧阴离子自由基, 将其歧化为氧气和过氧化氢, 被称为生物体抗氧化系统的第一道防线[15];作为抵御氧化损伤的第二道防线的CAT和GPx能进一步将过氧化氢转化成水和氧气, 保护细胞膜的结构及功能不受过氧化物的干扰及损害[18,45—46]。本实验结果显示, 随着Cd2+或Hg2+染毒浓度的增加,SOD、CAT和GPx活性均呈现出“低浓度激活高浓度抑制”的效应(图1、图2), 说明低浓度的Hg2+(≤0.46)和Cd2+(≤5.04)导致中华绒螯蟹体内活性氧大量产生, 机体为减轻活性氧的氧化损伤而诱导抗氧化酶活性上升, 产生“毒物兴奋效应”。这在其他水生动物如双壳类软体动物[8,12,19,42]、甲壳类动物[11,20,46,47]、鱼类[3,7,37]中也均有类似的报道。但随着Cd2+或Hg2+染毒浓度的升高, 中华绒螯蟹体内大量增加的活性氧自由基超过了生物体的清除能力, 致使组织受到了活性氧的攻击而产生损伤, 从而使抗氧化酶的活性下降。此外, 过多的Cd2+或Hg2+可能与SOD活性中心的Cu2+/Zn2+发生竞争[14,33,46]或与GPx活性中心的半胱氨酸残基结合[5,13,15]影响抗氧化酶的空间结构而使酶活性降低。
本研究发现, 在Cd2+或Hg2+LC50的1/64、1/32、1/16、1/8或1/4的相对应条件下, Cd2+组的CAT和GPx酶活性要比Hg2+组的强(图1、图2), 同时MTmRNA的表达量也是Cd2+组高于Hg2+组(图3、图4)。有研究认为, Cd2+与MT的络合是应对镉氧化应激最有效的保护措施, 也被认为是一种高效的解毒系统, 少量Cd2+进入机体后, 诱导MT的合成而转化为无毒物质[48,49]。Hg2+对含巯基的分子, 如GSH、MT和半胱氨酸具有很高的亲和力, 但Hg2+与MT的亲和力低于Cd2+与MT的亲和力[50], 故Hg2+组的MTmRNA的表达量较Cd2+组低(图3、图4), 这也是Hg2+染毒组MDA及H2O2的含量比Cd2+染毒组高(图5、图6)的原因之一。据报道, 一些金属, 如镉、铅和汞, 由于它们具有电子共享亲和性, 可以与抗氧化系统的酶形成共价连接, 使其失活[51]。Cd2+诱导ROS生成的间接机制是Cd2+在多种细胞质和膜蛋白中取代铁和铜从而刺激Fenton反应[49]。而汞的毒性作用比较复杂, 如对特定的酶抑制作用, 金属离子平衡受损, 或硫醇和硒代谢物的消耗等[52]。汞引起氧化应激的确切机制尚不清楚, 但汞中毒鱼体内H2O2含量的增加表明过氧化物酶的抑制作用; 也有可能是汞抑制谷胱甘肽过氧化物酶去除H2O2的能力[3]。这与本实验中发现的Hg2+组的CAT和GPx酶活性均较Cd2+组低相一致。
结合H2O2和MDA含量及SOD、CAT和GPx活性的变化进行分析, 在重金属诱导下SOD先被激活后, 其反应产物H2O2含量开始增加, 刺激CAT和GPx活性增强以清除H2O2, 但是其清除速度未能赶得上H2O2的产生速度, H2O2开始出现积累。但随着Cd2+或Hg2+染毒浓度或卵巢中Cd和Hg积累量的增加, 抗氧化酶活力出现不同程度的下降趋势, 机体清除H2O2的能力降低, 累积更多的H2O2, 而累积的H2O2将会进一步抑制SOD、GPx和CAT的活力。此外, 卵巢中MDA的含量在Cd2+或Hg2+的刺激下较对照组显著增加(P<0.05), 反映了高浓度Cd2+对中华绒螯蟹卵巢的损伤, 体内自由基未被及时清除, 致使机体内脂质被ROS攻击产生大量的MDA并累积。MDA的累积变化趋势与H2O2含量的变化保持一致, 呈现出增长的趋势。有关河南华溪蟹(S. henanense)[45,47]、长江华溪蟹(S. yangtsekiense)[36]、中华绒螯蟹(E. sinensis)[11,53]、锯缘青蟹(S. serrata)[17]、阿根廷小长臂虾(Palaemonetes argentinus)[35]的研究中也均发现, 随着重金属浓度的增加或是暴露时间的延长, 机体内H2O2和MDA的累积也会逐渐增加, SOD、CAT和GPx活力出现先上升后下降的趋势, 说明重金属对甲壳动物造成了氧化损伤, 其程度与重金属浓度和暴露时间呈正相关性。
