Bradford定量法在蛋白质组学中应用的优化研究
2019-05-28崔为同薛华儒成洪达张海滨王清路
崔为同, 薛华儒, 成洪达, 张海滨, 王清路
齐鲁医药学院, 山东省生物医学工程技术重点实验室, 山东 淄博 255300
随着分子生物学的快速发展,蛋白质组学已成为生物学和生物医学研究的热点[1,2]。双向电泳(2-DE)技术可根据蛋白质的等电点和分子量同时分离多达几千种蛋白质,因此被广泛应用于比较蛋白质组学研究[3]。为保证分析的公正和可靠性,等电聚焦电泳时配对分析的两组蛋白质样品的加样量应严格一致。这就要求在电泳之前需要对不同样品进行准确定量。定量准确性不但影响后续蛋白质图谱分析,而且关系到实验结果的重现性[4~6]。
为使蛋白质变性并提高蛋白质的溶解度,溶解蛋白质样品的裂解液(lysis)中含有高浓度的变性剂、表面活性剂、还原剂和两性电解质等成分,这些成分对常用蛋白质定量方法都存在干扰[7]。已有研究者关注lysis干扰蛋白质定量的问题,但尚未发现完全兼容lysis的定量方法[7~9]。Lysis干扰导致蛋白质定量不准确可能是现有文献中使用相同实验材料和同规格胶条,但加样量存在较大差异的主要原因[10,11]。已有研究分析了Bradford法[12]、二喹啉甲酸(BCA)法[13]和Folin-酚(Lowry)法[14]等三种常用定量方法对2-DE样品的适用性,发现lysis组分对三种方法都有干扰,但Bradford法对lysis的兼容性最好[7,9]。
Bradford法具有成本低、灵敏度高和测定快速简便的特点,是目前应用最广泛的蛋白质定量方法之一[15,16]。虽然该法在测定2-DE样品时较其他定量方法有一定优势[7],但仍存在lysis会产生背景干扰的问题[17],而且lysis可能会影响蛋白质-染料复合物的稳定性,但目前尚无相关报道。另外,Bradford在首次报道该方法时没有明确阐述该法的线性范围[12],现有文献资料中对Bradford法线性范围的描述也不一致[18,19]。
为使Bradford法更适合在蛋白质组学研究中应用,本研究针对目前应用该法定量2-DE样品时存在的问题,对该法的线性范围、lysis组分、测定时间、显色液中磷酸含量、标准曲线的制作以及加样体积等进行了优化。这些优化可使Bradford法更适合定量蛋白质组学样品,从而获得更准确的定量结果。同时可规范定量操作,尽量减小不同实验者之间定量数据的差异性,使定量数据有较高的参考价值。
1 材料与方法
1.1 材料
1.1.1药品和试剂 牛血清白蛋白(BSA)(购自Roche公司)、尿素和硫脲(购自Sigma公司)、两性电解质Pharmalyte (pH 3~10)(购自GE Healthcare公司)、考马斯亮蓝G-250(购自Amresco公司)、二硫苏糖醇(DTT)(购自Merck公司)、3-[3-(胆酰胺丙基)二甲氨基]丙磺酸内盐(CHAPS)(购自Promega公司)、乙基苯基聚乙二醇(NP-40)(购自Fluka公司)和聚乙二醇单辛基苯基醚(Triton X-100)(购自Amresco公司),所用药品均为分析纯。试剂配制用水均为蒸馏水。
以BSA为标准蛋白质配制标准蛋白溶液。标准蛋白溶液浓度用比色法校正,即用紫外分光光度计和1 cm光径的石英比色杯测定1 mg/mL BSA溶液时,在280nm处的吸光度应为0.66[20]。该标准液分装后保存于-20℃的冰箱中。
显色液参考Bradford法[12],略作改动。具体为称取100 mg Coomassie Brilliant Blue G-250,加入50 mL 95%乙醇中。CBB-G250充分溶解后,再向其中加入120 mL 85%(w/V)的磷酸[21],混匀后用蒸馏水定容至1 L并过滤。滤液用棕色瓶室温保存。
本研究采用常规的尿素/硫脲裂解液[22],含7 mol/L尿素、2 mol/L硫脲、4%(w/V)CHAPS、2% (V/V) Pharmalyte (pH 3~10)、1% (w/V) DTT(现用现加)。配制完成后分装到Eppendorf管中,-20℃冰箱保存。
1.1.2仪器 双光束紫外可见分光光度计UV-1800(日本岛津)。
1.2 方法
1.2.1Bradford法线性范围的确定 用BSA标准液分别配制含0~1 000 μg和0~200 μg标准蛋白质的样品, 0~1 000 μg范围内各样品浓度依次为0.5 mg/mL、1.0 mg/mL、1.5 mg/mL、2.0 mg/mL、3.0 mg/mL、4.0 mg/mL、5.0 mg/mL、6.0 mg/mL、7.0 mg/mL、8.0 mg/mL、9.0 mg/mL和10.0 mg/mL;0~200 μg范围内各样品浓度依次为0.2 mg/mL、0.4 mg/mL、0.6 mg/mL、0.8 mg/mL、1.0 mg/mL、1.5 mg/mL 和2.0 mg/mL。测定吸光度时以上各样品均取100 μL,对照样品均为100 μL水(以对照样品和5 mL显色液的混合液进行仪器调零,下同)。按Bradford法[12]测量各样品在595 nm处对应的吸光度值(A595)。测定时与样品反应的显色液体积均为5 mL,不同浓度样品均设3个重复。
1.2.2不同体积lysis和不同lysis组分干扰程度的测定 首先,分别配制含10 μL、40 μL、70 μL、100 μL lysis的水溶液,各样品体积均为100 μL,以100 μL水为对照样品,测定A595,并计算相当于标准蛋白BSA的值(μg)。其次,分别用水配制7 mol/L 尿素、2 mol/L 硫脲、4%(w/V) CHAPS、2% (V/V) Pharmalyte (pH 3~10)、1% (w/V) DTT等含lysis单一成分的溶液,各取100 μL加入含5 mL显色液的试管中,摇匀并反应5 min后测定A595,对照样品为100 μL水。再次,分别配制4%的CHAPS、NP-40和Triton X-100溶液。测定100 μL上述溶液与5 mL显色液反应后的A595,对照样品为100 μL水。
1.2.3Lysis对蛋白质-染料复合物稳定性的影响
Bradford最初报道该方法时,测定了0~70 min内蛋白质-染料反应液吸光度的变化,并说明显色反应在2 min时基本完成,A595在1 h内变化不会超过±4%[12],即变化幅度在8%左右。Kruger[20]在介绍Bradford法时也建议在混匀后2~60 min内测定A595。目前尚无其他文献报道Bradford法的稳定性,也没有lysis对蛋白质-染料复合物稳定性影响的报道。为研究lysis对蛋白质-染料复合物稳定性的影响,本研究分别测定了有无lysis条件下1 h内反应液A595的变化。
配制0.5 mg/mL的BSA标准液。测定无lysis条件下蛋白质-染料复合物的形成速率及稳定性时,取100 μL该标准液和100 μL水加入含有5 mL显色液的试管中,摇匀后立即放入分光光度计中连续测定1 h内A595的变化,仪器每2 s自动记录吸光度值,对照样品为200 μL水。测定存在lysis条件下蛋白质-染料复合物的形成速率及稳定性时,取100 μL该标准液和100 μL lysis加入含有5 mL显色液的试管中,摇匀后立即测定1 h内A595的变化,对照样品为100 μL水和100 μL lysis的混合液。
1.2.4有无lysis两种条件下0~50 μg内标准曲线的制作 蛋白质定量标准曲线的确定要考虑加样体积和测定样品中蛋白质的浓度范围。经典Bradford方法[12]和实验指导教材中[18]介绍的加样体积均为100 μL。但2-DE样品体积越大,由lysis造成的背景干扰越严重,因此可通过减少加样体积来降低样品中lysis的干扰,但加样体积过小又会导致测量误差的增加。
根据蛋白质干粉样品在lysis中的溶解比例,2-DE样品中蛋白质浓度一般在2~5 μg/μL之间[3,23]。若定量时加样体积为100 μL,则样品中蛋白质含量为200~500 μg。为避免定量时超出线性范围,在测定时需要对样品进行一系列的稀释,操作较繁琐,也浪费样品。综合考虑lysis干扰程度、测量误差和操作便利性,将测定lysis溶解的蛋白质样品的加样体积优化调整为10 μL。加样体积调整后,则10 μL样品中约含有20~50 μg蛋白质,恰好在Bradford法的线性范围内,无需稀释,可直接测定。
分别用水配制含10 μg、20 μg、30 μg、40 μg、50 μg BSA的10 μL和100 μL标准蛋白样品体系。测定10 μL lysis对标准曲线的影响时,向10 μL标准样品体系中和对照样品(10 μL水)各加入10 μL lysis;将各样品加入5 mL显色液中,反应完全后测定A595。测定100 μL lysis对标准曲线的影响时,向100 μL标准蛋白样品体系和对照样品(100 μL水)中各加入100 μL lysis,其他操作同上。
2 结果与分析
2.1 Bradford法的线性范围
线性范围是制作标准曲线的依据。现有文献中报道的Bradford法的线性范围是2~50 μg[19]或10~200 μg[18],差异较大,因此需要加以明确。如图1A所示,在0~1 000 μg范围内,A595随着样品中蛋白质含量的增加而增加,但当蛋白质含量超过900 μg后A595趋于平稳,说明Bradford法最大检测量为1 mg左右,线性关系较好的区段在0~200 μg以内。通过在0~200 μg范围内增加数据点,并进行0~100 μg、0~150 μg、0~200 μg范围内数据的线性拟合,获得各范围内数据的线性相关系数R2分别为0.9991、0.9767、0.9567,表明Bradford法的线性范围是0~100 μg,超过100 μg后线性关系逐渐变差。根据线性范围内蛋白质含量与对应吸光度之间的关系,计算得出Bradford法的检测限约为11 μg/mL。
2.2 Lysis及其成分对Bradford法的干扰
为探究lysis的背景干扰效应,对10~100 μL范围内不同体积lysis与显色液反应的A595进行了测定。如表1所示,lysis的干扰程度与其体积呈正相关(R2为0.986 2)。100 μL lysis与显色液反应产生的背景相当于16.94 μg标准蛋白BSA与显色液反应产生的吸光度。10 μL lysis造成的背景干扰仅为100 μL lysis的1/3。
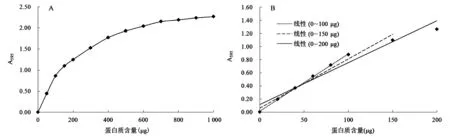
图1 0~1 000 μg(A)及0~200 μg(B)范围内蛋白质含量与A595的关系Fig.1 The relationship between protein content from 0 to 1 000 μg(A)and from 0 to 200 μg(B)and absorbance at 595 nm.
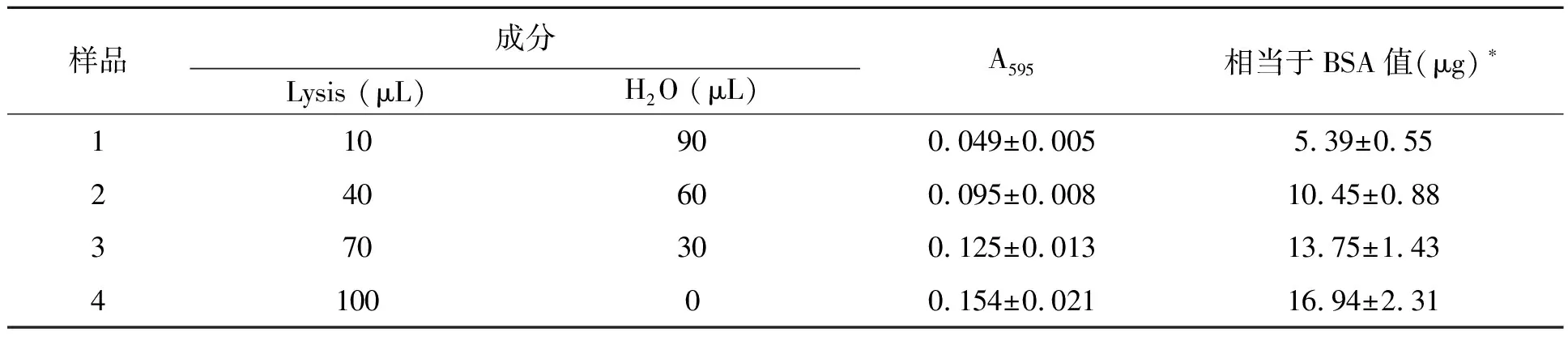
样品成分Lysis (μL)H2O (μL)A595相当于BSA值(μg)∗110900.049±0.0055.39±0.55240600.095±0.00810.45±0.88370300.125±0.01313.75±1.43410000.154±0.02116.94±2.31
*各样品均与5 mL显色液反应并测定595 nm处吸光度;根据0~100 μg范围内标准曲线计算各吸光度对应的BSA值。
干扰Bradford法测定的化合物众多,普遍认为表面活性剂是造成干扰的主要因素[12,24,25]。表面活性剂的作用是在不破坏蛋白质结构、保持生物活性的情况下改善蛋白质的溶解度。Lysis中的高浓度变性剂、表面活性剂、还原剂和两性电解质等都可与显色液发生反应,导致背景干扰(图2)。结果显示,两性电解质Pharmalyte (pH 3~10)产生的背景干扰最大,其他组分产生的干扰较微弱,表明并不是所有表面活性剂都会严重干扰Bradford法。
Lysis中常用的表面活性剂有两性离子型的CHAPS,以及非离子型的NP-40和Triton X-100等。图3显示不同表面活性剂之间差异极显著。Triton X-100和NP-40引起的背景色极高,而CHAPS造成的背景干扰较小。100 μL 4% (w/V) Triton X-100和NP-40的A595(2.47)已经超出1 mg蛋白质的A595(Bradford法的最大检测量,图1),导致无法测出准确的蛋白质浓度。
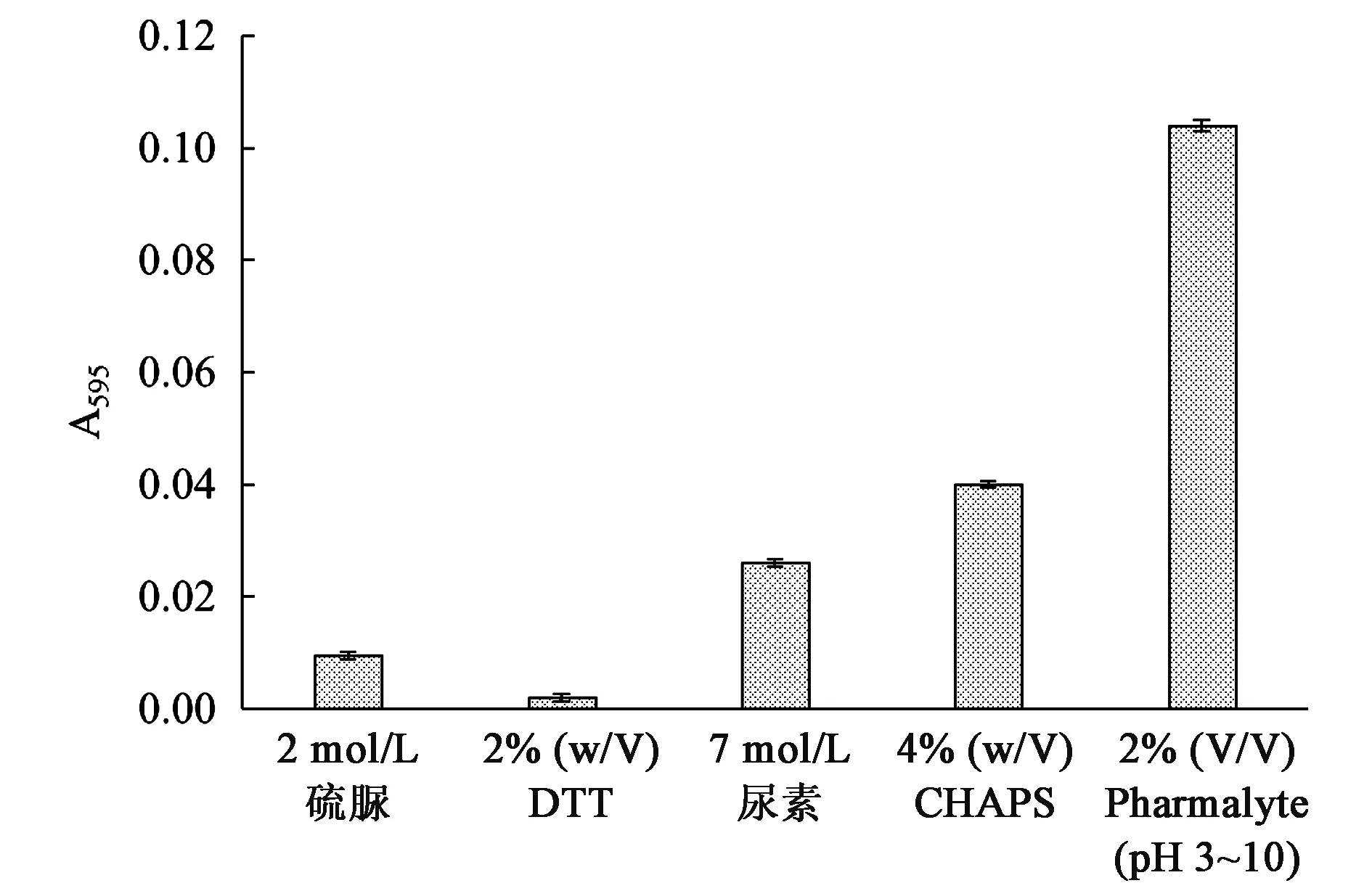
图2 Lysis不同组分对Bradford法的干扰程度Fig.2 The interfering effect of different components of lysis on the Bradford assay.注:加样体积均为100 μL。
2.3 Lysis对蛋白质-染料复合物稳定性的影响
为研究lysis对蛋白质-染料复合物稳定性的影响,本研究分别测定了有无lysis条件下1 h内反应液A595的变化。如图4和表2所示,反应体系中无lysis时,A595从混匀后3 min开始基本趋于稳定,3~60 min内变化幅度为+2.82%到-0.54%(以180 s时A595为基准)。本研究采用的显色液组分与经典Bradford法稍有不同,即磷酸含量从8.5%(w/V)提高到10.2%(w/V)。对比Bradford[12]的研究中0~70 min内蛋白质-染料稳定性图谱可以发现,磷酸比例的增加极大提高了蛋白质-染料复合物的稳定性。
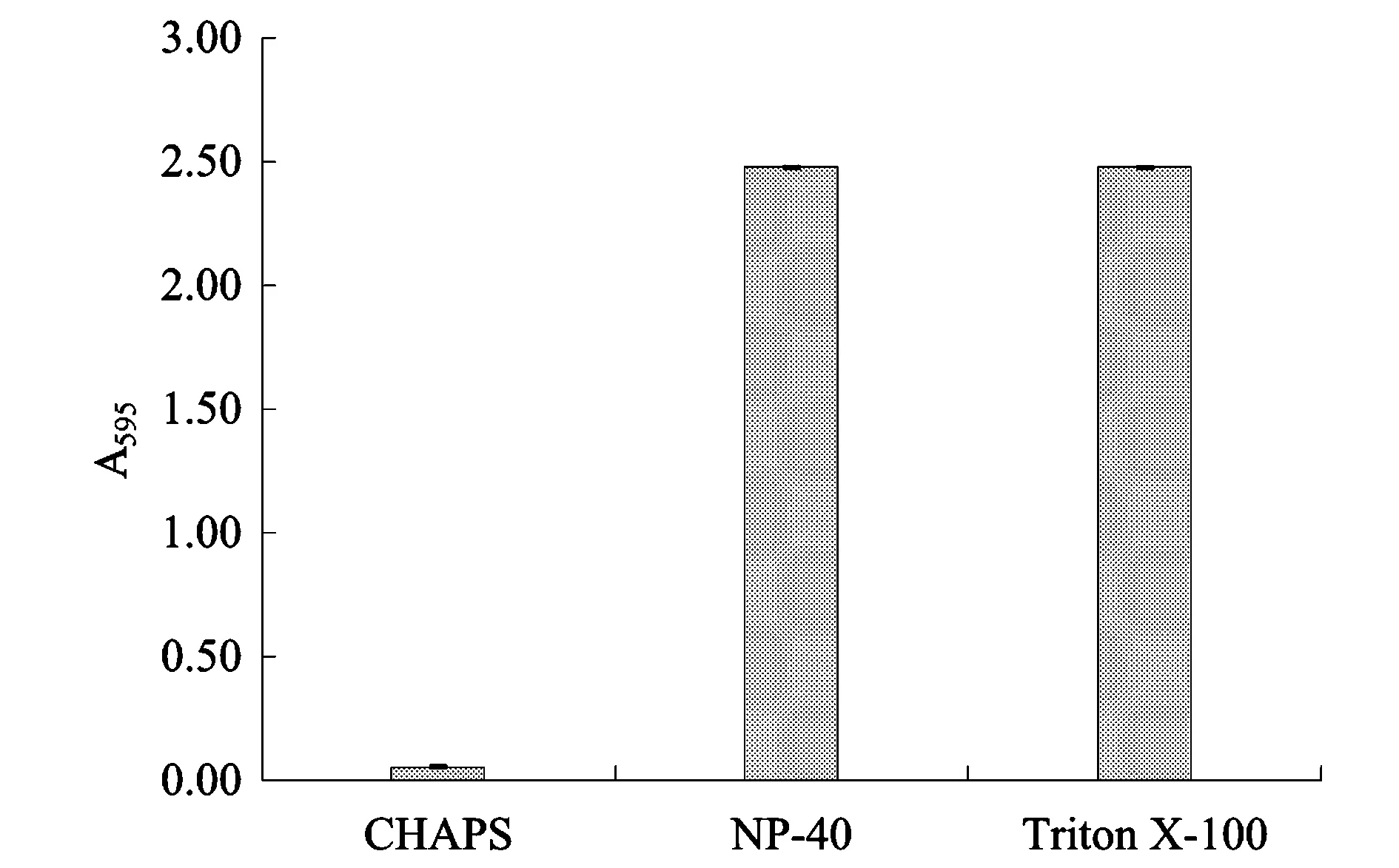
图3 三种表面活性剂对Bradford法的干扰程度Fig.3 The interfering effect of three kinds of detergents on the Bradford assay.注:加样体积均为100 μL,各表面活性剂浓度均为4%(w/V)。
若反应体系中存在lysis,则A595从混匀后2 min开始基本趋于稳定,之后缓慢上升至12 min左右,然后一直呈下降趋势,2~60 min内变化幅度为+2.07%~-8.43%(以120 s时A595为基准),约是无lysis时变化幅度的3倍,从50 min开始A595出现剧烈波动。两种条件下吸光度的变化表明lysis对蛋白质-染料复合物的稳定性有显著影响。另外,比较图4中两条曲线可发现,对于相同蛋白质含量样品,当反应液中存在lysis时测得的吸光度值显著高于无lysis时,说明lysis会影响蛋白质和染料之间的显色反应。
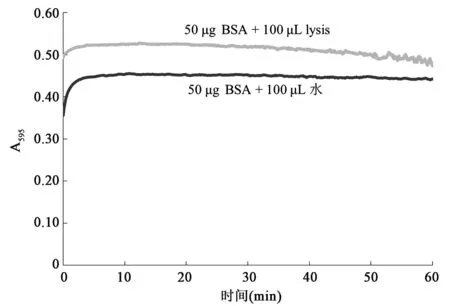
图4 Lysis对蛋白质-染料复合物形成及稳定性的影响Fig.4 The effect of lysis on the formation and stability of protein-dye complex.
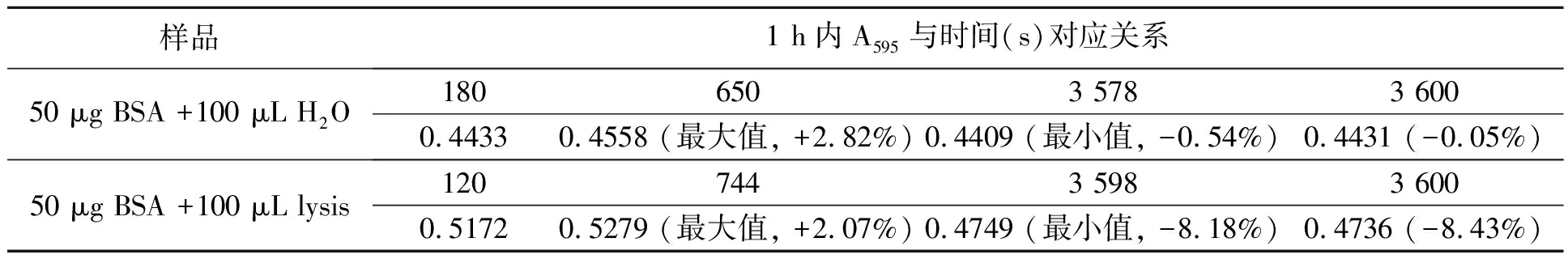
表2 有无lysis两种条件下BSA与显色液反应1 h内A595的变化Table2 Absorbance change at 595 nm of the mixture made by BSA and dye reagent,with or without lysis buffer in 1 h.
2.4 加样体积调整及其对标准曲线的影响
图5显示了加样体积调整对0~50 μg范围内标准曲线的影响。当加样体积为100 μL时,测量数据波动性较大,而且标准曲线的线性关系不佳(R2=0.996 8),可能与lysis的背景干扰较大有关。当加样体积减少为10 μL时,测得数据稳定性更好,线性关系也有明显改善(R2=0.999 1)。
3 讨论
本研究通过分析蛋白质含量与吸光度的线性关系,确定Bradford法的线性范围是0~100 μg,因此何忠效等[18]报道的线性范围过大,而Okutucu[19]给出的线性范围又偏小。当加样体积为100 μL时,与线性范围对应的浓度范围是0~1 μg/μL;当加样体积为10 μL时,对应的浓度范围是0~10 μg/μL。在制作标准曲线时,应保证检测范围在线性范围内。另外,由于标准蛋白质的纯度不同,称量和配制过程也会有误差,为使不同研究人员的定量数据具有可比性,应对1 mg/mL的标准蛋白溶液进行校准。
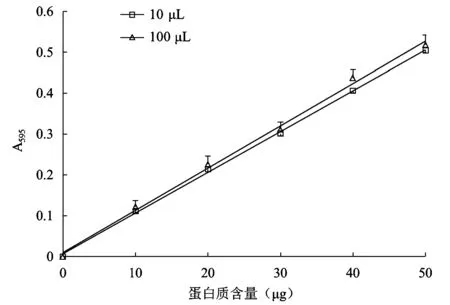
图5 不同加样体积所得0~50 μg蛋白质范围内标准曲线Fig.5 Construction of the standard curve in the range of 0~50 μg(BSA)with different sample volume.
Bradford通过分析常用试剂对定量的影响,发现Bradford法对大多数常用化学物质的兼容性较好,但高浓度的表面活性剂(1%的Triton X-100和SDS)会严重干扰测定[12]。本研究发现并非所有表面活性剂都会产生严重干扰,CHAPS产生的背景要远小于Triton X-100和NP-40。Lysis中表面活性剂的浓度高达4%(w/V),若应用Bradford法进行定量,在配制lysis时应避免使用Triton X-100和NP-40等,而选择CHAPS或其他背景干扰较小的表面活性剂。
通过有无lysis条件下对蛋白质-染料复合物稳定性的分析可知,lysis会影响蛋白质-染料复合物的稳定性。对于溶解在水中的蛋白质,蛋白质-染料复合物在1 h内有很好的稳定性,但对于溶解在lysis中的蛋白质,蛋白质-染料复合物稳定性降低,在反应50 min以后尤其明显。Bradford建议常规样品在反应后2~60 min内测定吸光度[12];但定量含lysis的2-DE样品时,适宜的测定时间为反应开始后3~30 min,该时间段内A595的变化幅度约为1%,对测量值的影响较小。由于提高显色液中磷酸含量可显著改善蛋白质-染料复合物的稳定性,因此定量2-DE样品时可将磷酸含量从8.5%(w/V)提高至10.2%(w/V)。
由于lysis会影响蛋白质与染料的显色反应,导致相同含量蛋白质在有无lysis条件下吸光度有较大差异,因此在测定2-DE样品时不但要以相应体积lysis做对照来消除lysis的背景干扰,还要在制作标准曲线时考虑到lysis的影响,在标准蛋白样品和对照中都加入相应体积的lysis,否则会使测定结果出现较大偏差。至于lysis影响蛋白质和染料相互作用的机制还需进一步研究。
经典Bradford法加样体积为100 μL[12]。为使该法更适合定量2-DE样品,将加样体积调整为10 μL。减少加样体积不但可以减少lysis导致的背景干扰,提高定量结果的准确性,还可以省去样品稀释步骤,简化操作。对于难提取的膜蛋白和其他特殊蛋白样品,也可节省样品。
综上所述,本研究通过分析Bradford法的线性范围、测定lysis及其组分的干扰效应、分析lysis对蛋白质-染料复合物稳定性的影响和调整加样体积,针对定量蛋白质组学2-DE样品存在的主要问题对Bradford法进行了优化,可为蛋白质组学相关领域的研究人员快速掌握和应用该法提供参考。
