潜流带生物地球化学特征研究进展
2019-05-23苏小四师亚坤董维红杨国强
苏小四,师亚坤,董维红*,杨国强,王 璜
(1.吉林大学 水资源与环境研究所,吉林 长春 130021; 2.吉林大学 建设工程学院,吉林 长春 130021;3.吉林大学 新能源与环境学院,吉林 长春 130021; 4.中国地质调查局南京地质调查中心,江苏 南京 210016; 5.中国地质调查局,北京 100037)
0 引 言
潜流带(Hyporheic Zone),亦称地表水-地下水交互作用带,是研究地表水与地下水相互作用的重要桥梁和纽带。受自然和人工开采的共同影响,地表水和地下水之间往往发生着频繁且强烈的交互作用,不断进行着水分、物质和能量的交换。地表水和地下水之间的这种交互作用对于维持当地水质和生态安全具有十分重要的作用[1]。同时,由于地表水和地下水在物理、化学、生物等特征上存在明显差异,二者交互作用过程中产生了明显的物理梯度、化学梯度和生物梯度,所以潜流带内发生着强烈且复杂的物理、化学和生物过程,其物理、化学和生物渗滤作用使得潜流带成为一个“天然过滤器”,可固定和降解流经潜流带水体中的病毒微生物、有机物、重金属等物质,净化地表和地下水体[2-4]。作为生物地球化学活动强烈的地表水与地下水的混合区域,潜流带一直倍受关注,成为众多国际科学研究计划的重要主题。联合国教科文组织(UNESCO)第六阶段国际水文计划(IHP)(2002~2007年)将地下水与地表水的相互作用列为其重要的研究对象和目标之一[5];2008年4月在维也纳举行的欧洲地质科学联合会议(EGU)特别专设了“河岸区水文生态学——潜流带对地表水-地下水交互作用的控制”专题,并且《Hydrological Processes》在2009年第23期出版了该领域研究状况的专辑[6]。由此可见,地表水-地下水交互作用研究正成为目前地下水科学、水文科学、生态学等多学科领域的研究热点。
潜流带在全球水循环和物质循环过程中发挥着重要的作用。潜流带是三相空间(固相、液相、生物相)并存的地表水与地下水的混合带[7]。由于地表水与地下水之间存在温度(T)、溶解氧(DO)、氧化-还原电位(Eh)、酸碱度(pH)、有机质、微生物、水化学组分等的差异,导致潜流带形成了物理、化学、生物梯度[8]。潜流带是一个热缓冲带,可以减缓水体的温度变化[9];潜流带可以控制地表水与地下水之间的水交换通量[10];潜流带沉积物为底栖生物、间隙生物和微生物提供了栖息地[11-12],潜流带温度、含氧量、有机质的梯度变化为不同类型的微生物提供了生存环境;潜流带中发生着复杂的生物地球化学反应,可以有效吸附、降解污染物,净化水体[13]。基于此,本文梳理并总结了潜流带中生物地球化学过程及其影响因素和研究方法,以期为推进潜流带生物地球化学研究提供参考。
1 潜流带定义
1959年,Orghidan根据希腊文hypo和rheic创造了Hyporheic(潜流)这一术语,并将其描述为包含具有鉴别性特征生物的地下水新生境[14]。不同学者根据其研究的问题从不同角度描述潜流带(图1)[15]:Triska等从水文学角度将潜流带视为地表水体积占10%~98%的饱和含水区域[16];White将潜流带视为位于河床及河漫滩以下含有一部分地表水或其水质受地表水入渗而改变的水分饱和区域[17];Valett等将潜流带视为位于河道以下地表水和地下水发生交换的区域[18];Boulton等从水文地球化学角度将潜流带视为位于地表水与地下水之间发生水分、养分和有机物质交换作用的区域[19];Boulton等将潜流带视为氧化-还原变化强烈的区域[20];Larned等从生态学角度将潜流带视为地表水与地下水之间的生态交错带,并根据生物含量将其分为浅层潜流带和深层潜流带[7]。综上所述,潜流带是位于地表水和地下水之间发生物质和能量交换的,具有物理、化学和生物梯度的饱和含水带。
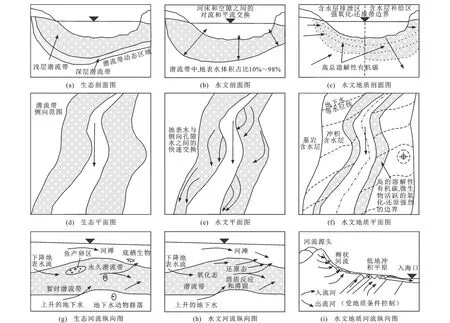
图件引自文献[15]图1 潜流带概念模型Fig.1 Conceptual Models of Hyporheic Zone
2 潜流带生物地球化学过程影响因素
潜流带独特的地形地貌、沉积物岩性、渗透性等结构特征决定了其特有的水动力交换模式和生物地球化学特征,导致潜流带具有独特的生物群落格局和物质输入模式。
2.1 河床沉积物结构特征
河床沉积物结构特征主要包括地貌形态、地形起伏、物质组成、厚度及不同岩性层的叠置关系等。这些特征决定了潜流带水力交换过程、能量传递过程和物质传输与转化过程,进而影响和改变着潜流带的物理化学环境。
各种不同尺度的地貌单元及其内部的水文地质参数(主要是渗透系数)空间变异通过引起河流-沉积物或河流-含水层之间的压力或水头梯度来驱动潜流。在河段尺度上,河床结构影响下降流和上升流的速率和周期,河水动力学过程驱动和影响着水流方向和速度,对沉积物运移连续性和河床沉积物再分配至关重要[21]。河床起伏使河流-沉积物界面发生水力梯度空间变异而产生潜流交换流[21]。自然河床地形(特别是河道坡度)控制了河道中的水头与相邻地下水之间的关系,从而控制了潜流交换量[22]。河道中的沙丘、波纹河床和复式河床等形状变化可以形成形状阻力,产生涡流,导致地表水与地下水之间发生潜流交换,并且潜流交换量还会随着河流流速增加而增加[23-25]。河流曲率和宽度影响潜流带范围和水流滞留时间[26],河岸线曲率越大,潜流交换量越大[27]。河流在城市地区被渠化或拉直[28],可能会导致自然发生的潜流交换量减少[29]。在单个河湖(河滩)尺度上,沉积物特征(如河床物质架构、颗粒尺寸和形状分布、孔隙几何学特征和连接性、粗糙度等)影响潜流带内水流和物质交换[26];河床沉积物渗透系数控制着潜流交换量的大小和潜流带中溶质的滞留时间。河床沉积物渗透系数的增加造成潜流交换量增加[22]和溶质反应通量增加,但溶质滞留时间减短,潜流带的生物地球化学反应取决于这两种效应的相对大小[30]。高渗透系数沉积物(例如砾石)表现出高传质速率但阻滞能力低;相反,低渗透系数沉积物(例如淤泥和黏土)由于存在巨大的比表面积,表现出物质传递缓慢且扩散受限[31]。上述驱动和影响机制本质上并不相互独立,何种机制占主导地位取决于特定河流-沉积物系统的地形地貌和水文地质条件[32]。
沉积物放淤过程(即细颗粒沉积物运移到砾石河床)也会对潜流交换流和生态产生影响。这种放淤过程主要有两种:一种是受到重力和水动力扰动作用而由河水沉积到沉积物上表面的空隙中;其次是在高速流动水流扰动下沉积物原有的细颗粒重新分布并进入表面的空隙空间[33]。在许多河流中,细颗粒沉积物也与生命物质有关,许多河床的部分细颗粒沉积物是由生命物质组成的[34]。放淤过程不仅减少潜流带物质输入,还延长水流平均滞留时间及相应的化学反应时间。这些对于潜流带生物地球化学循环效率和生境条件有重要的影响[34]。细颗粒沉降在河床上,河床渗透系数减小,潜流带水流速度减小,溶解氧减少,生物新陈代谢产物堆积,进而影响生物生存[35]。
2.2 水文特征
描述河床和近河床饱和区域的地表水和地下水混合水流的潜流交换量对研究潜流带生物地球化学和生态水文过程是至关重要的,它控制着不同区域化学物质(如河床溶解氧、养分和污染质)的滞留时间、混合运移和时空分布模式、氧化-还原条件和物理化学生境特征(如水温)[8],而控制潜流交换量的因素随着尺度而变化。在河段尺度上,潜流交换量取决于河床压力变化[36]、沉积物渗透性和粒径[37],放淤过程影响潜流带沉积物渗透性,进而控制潜流交换量以及其中的生物地球化学循环[38]。在更大尺度上,潜流交换量受河水流速、河谷宽度、基岩深度和含水层特征等因素的影响[37]。Rahimi等发现地下水水位的变化会影响地表水-地下水交互作用的方向和大小[39]。Ward等发现河流附近的地下水水流路径不随流量变化而变化,而主要是由河床形态所控制的水力梯度决定的[40]。Trauth等发现在河流流量增加时,潜流交换量、溶质运输和微生物活动均增加[41]。
2.3 环境特征
潜流带内与生物地球化学相关的环境因素主要涉及酸碱度、氧化-还原电位、溶解氧、温度等。酸碱度影响物质的化学形态和价态(如Fe3+在pH值高时易发生聚沉,而在pH值低的还原环境下,高价金属容易被还原),影响物质的存在状态(沉淀与溶解、吸附与解吸),从而影响着物质的迁移转化能力,还影响潜流带内生物酶的活性[13]。氧化-还原电位是驱动潜流带生物地球化学作用的最重要因素,几乎所有的生物地球化学过程都发生在一定的氧化-还原电位梯度下,而且氧化-还原电位还控制着沉积物对污染物的去除能力[13,42]。溶解氧几乎参与潜流带所有物质的循环过程[10,13,42-43],并控制着环境的氧化-还原电位变化[10]。温度是驱动潜流带生物地球化学和生态水文过程的重要因素之一[44],潜流带独特的温度环境能够为特定的物种提供栖息地和避难所[11],河流水体与河床及河漫滩之间的热交换(即潜流带热量交换)能调节河流和地下水温度[26,32],促进整个河流生态系统的稳定。在物质的迁移转化过程中,氧化-还原电位和酸碱度往往是共同作用的[13]。
在不同空间尺度下,潜流带呈现不同的物理化学条件。在河段尺度上,水流路径直接控制着化学性质不同的地下水和地表水的来源、混合比例、运移和分布[13,42-45];滞留时间控制着水流与沉积物接触时间及相应的物理化学和生物化学反应时间[46];生物化学反应改变环境的物质成分,从而影响着物理化学条件。上述机制使得潜流带水流路径上呈现出氧化-还原电位、酸碱度、水化学等梯度(图2),如沿着下降流,溶解氧浓度降低,环境氧化-还原电位和pH值逐渐降低[13],夏季温度逐渐降低,冬季温度逐渐升高[47]。在微观尺度上(沉积物颗粒尺度),由于介质的非均质性和一些反应微型囊体的存在,环境特征呈现高度的非均质性,如在某些充氧区域,由于存在着某些有机物囊体而形成了小型厌氧区域[48]。
2.4 生物群落格局
潜流带生物群落格局及其生态功能强烈地受到潜流带所经历的物理化学条件影响。与河水等地表水体相比,潜流带拥有更缓慢的水流速度、更小幅度的温度变化周期、强烈的物理化学梯度和更好的基底稳定性[47]。而与地下水相比,潜流带拥有更快的水流速度、更大幅度的温度变化周期[48]和更强烈的物理化学梯度[49]。这些物理化学条件在很小的时空尺度下变化极大,因此,对潜流带生物群落格局影响巨大,形成了潜流带独特的生物交错带和生态功能[50]。

图件为河段尺度;图件引自文献[55]图2 潜流带水化学和动物群落分布的简化示意图Fig.2 Simplified Schematic View of Hydrochemistry and Fauna Distribution with Depth in Hyporheic Zone
潜流带生物群落格局由微生物生物膜(存在于外细胞基质中的细菌和真菌)[51]、原生生物(主要是纤毛虫、鞭毛虫和变形虫)和无脊椎动物组成[52]。潜流带中的生物群落可按对环境的亲和性和适应性划分为3种类型:其一是不亲和地下水生境的生物(Stygoxenes),但是这些生物偶尔会由于入渗而进入地下水;其二是较亲和潜流带环境并能积极利用潜流带资源和生境环境(如为避开不良的环境或逃避食肉动物而进入潜流带)的生物(Stygophiles);其三是表现出适应生活在地下的生物,而且地下水生境(包括潜流带、含水层和洞穴)是它们必不可少的栖息地[53-54]。潜流带生物群落在生态系统工程(生物群落共同作用改变其周围环境)、有机物转化过程及营养的级联效应、潜流带和地表沉积物之间的有机物质和养分的转化过程中起着重要的作用[10]。河床沉积物的级配、孔隙度、有机物含量以及间隙水性质等特性对底栖动物的扰动程度及组成有着很大的影响[56]。而生物扰动作用又反作用于沉积物,可以改变沉积物物理、化学、生物性质,影响沉积物的结构、孔隙度、有机质含量、渗透性等特性[56]。潜流带生物活动会对河流、海洋中原生沉积物的结构产生非常明显的扰动效果,使得沉积物中物质的循环、迁移速率发生改变[56]。潜流带中的大型无脊椎动物、小型动物和原生生物(例如纤毛虫和鞭毛虫)的生命活动(钻行、捕食、筑巢、排泄和躲避危险)导致优先流路径,增加生物膜表面和细菌密度[57],增强沉积物渗透性、沉积物的呼吸和细菌活动[58]。底栖生物扰动会提高颗粒物在主要氧化-还原带之间的传输,使得沉积物中氧化-还原作用加强,再矿化作用提高[56]。沉积物空隙间的生物膜积聚会降低沉积物的渗透系数和有效孔隙度,从而导致潜流交换量减少[59]。微生物促进各种反应,如有机碳的氧化或营养物的矿化导致在具有广泛低流量的溪流中溶质化学的局部变化[60]。
2.5 物质输入
物质输入是潜流带发生各种过程的必要条件。有机物质的输入为潜流带生物地球化学过程提供能量和各种元素[10]。氧气的输入为潜流带好氧生物地球化学过程提供电子受体[10];细颗粒沉积物的输入影响潜流带沉积物的物理化学条件和水动力条件,并反过来影响物质的输入[34];地表水体的输入与混合能够维持潜流带特定的物理化学条件的动态平衡;而金属和有毒物质的输入则破坏潜流带生境环境[13]。
潜流交换量决定着潜流带物质输入量和类型[49]。沉积物结构特征通过影响潜流交换量的强度和路径来影响潜流带的物质输入(如细颗粒沉积物减小潜流交换量强度,进而减小溶解氧的输入)[34]。
3 潜流带内生物地球化学特征
近年来,对潜流带生物地球化学行为研究最多的元素是C、N和P,这3种元素是生态系统中生物生长不可或缺的生命元素,也是工业、农业生产活动进入河流生态系统进而污染水生环境最常见的元素。对潜流带研究也主要集中于这3种元素及其有机、无机化合物在潜流交换过程中的来源、富集、分布、形态、价态、衰减等生物地球化学行为;此外,潜流带中Fe、Mn、As、Hg等其他有毒污染物的生物地球化学行为也逐渐被重视。
3.1 C元素
潜流带中C元素的存在形态主要有无机碳及有机碳。有机碳主要包括颗粒状有机碳(Particulate Organic Carbon,POC)、溶解性有机碳(Dissolved Organic Carbon,DOC) 、甲烷(CH4)等形态。颗粒状有机碳主要悬浮在水中、填充在沉积物空隙中或附着在介质表面,是水生生态系统中一些大型生物和微生物的直接养分和能量来源。颗粒状有机碳可直接水解为溶解性有机碳,在甲烷细菌作用下转化为甲烷,或被生物代谢为溶解性有机碳和无机碳。在绝大多数河流中,溶解性有机碳构成最大的有机碳源,并可作为异养微生物的能量来源[61-62],影响养分的可利用性[63]、污染物的运移和衰减[64]、金属元素的形态转化和迁移及河流的酸碱度等[65]。
陆源有机碳、滨岸带生物群落和湿地水生植物是潜流带有机碳最主要来源,并远远超过河流浮游藻类所提供的量[66-68]。陆源有机碳主要通过地下水、土壤水、滨岸带和坡面漫流进入河流及潜流带。湿地有机碳主要通过淋滤作用进入河流和潜流带[69]。进入潜流带的有机碳中,溶解性有机碳占绝大部分,而新形成的、不稳定的溶解性有机碳往往占总溶解性有机碳的50%以上,这部分溶解性有机碳来自浅层水流对土壤层和湿地的淋滤,较稳定的溶解性有机碳往往来自地下水径流补给。各种来源和形态的有机碳可能具有其独特的化学性质,这些化学性质影响其微生物的可利用性。
在潜流带沉积物中,C元素主要发生着有机碳好氧分解和厌氧发酵过程。在潜流带充氧环境下,Craft等利用原位培养仓研究了有机碳在异养微生物生物膜作用下发生需氧分解过程,氧气作为电子受体,有机碳作为生物膜的能量来源和碳源,并被分解为无机碳[70]。而在潜流带厌氧和兼性厌氧环境下,Hlaváová等利用沉积物实验室异位培养技术,并结合野外调查和采样分析,研究了有机碳厌氧发酵过程,发现在缺氧条件下潜流带有机碳的发酵是在微生物催化作用下,以高价氧、硝酸盐及硫酸盐为电子受体而进行的,沿着水流路径依次发生氧还原,硝酸盐反硝化作用,硫酸盐脱硫酸作用;还发现在生物膜作用下,环境氧气足够低时,溶解性有机碳在产甲烷细菌催化作用下发生产甲烷过程[71]。
3.2 N元素

在河流源头,落叶层和相邻的森林地面生物残骸产生的颗粒状氮是N元素的主要输入源;大气平衡、溶解性有机氮和溶解性无机氮输入较少;含氮量低的地下水也可输入少量N元素[72]。然而在农业区,合成化肥的使用增加了地下水中的溶解性无机氮,污水管道溢出等点源污染能极大地增加河流和地下水中N元素浓度[72]。
潜流带中N元素主要发生反硝化作用、硝化作用、有机氮矿化和无机氮生物同化过程、吸附过程(图3)。氮循环过程受一系列物理化学条件的控制。

图件引自文献[73]图3 潜流带氮循环转化示意图Fig.3 Schematic View of Nitrogen Cycle Conversion in Hyporheic Zone
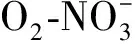
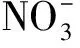
3.3 P元素
在水环境中,P元素有许多存在形式,通常分为溶解态磷和颗粒状磷。溶解态磷又分为可被生物利用的溶解性无机磷(Dissolved Inorganic Phosphorus,DIP)或包含胶质的溶解性有机磷(Dissolved Organic Phosphorus,DOP)(转化为溶解性无机磷之后方可被生物利用);颗粒状磷能以颗粒状无机磷形式存在于无机化合物的复合物中(如黏土矿物、Fe的氢氧化物、碳酸盐),或以颗粒状有机磷的形式存在于有机复合物或蜂窝状复合物中(包括核酸、磷蛋白质、维生素和脂类)。
在未被扰动的水生态环境中,P元素含量很低。富磷水环境(如发生富营养化的水体)中的P元素主要来自陆源(Terrestrial)。其来源主要包括:无机含磷矿物的风化产生可溶性或更易迁移的磷酸盐;生活或工业垃圾渗滤出以溶解性有机磷为主要形式的磷化物;生活或工业废水所含的P元素随着工业粉尘进入大气的磷化物;森林生态系统中植物残体盖层腐蚀及渗滤的以无机磷酸盐为主的磷化物以及农业、农药、化肥等其他非点源污染源产生的P。这些磷化合物通过一系列途径进入水环境,进而加入潜流带循环。排污口及农业排水系统可将P元素直接排放到地表水;污染渗坑、垃圾堆渗滤及森林腐殖层渗滤、农业灌溉回归水等可将P元素带入土壤或地下水,并可通过地下水位抬升、壤中流、地下径流及潜流交换作用进入河流水环境;P元素还可经坡面漫流、风、降水等方式进入地表水体。
在潜流带中,吸附和解吸、生物作用、生成难溶化合物等过程控制P元素的形态转化、运移和固定过程。
P元素的吸附和解吸过程主要受到氧化-还原性和酸碱度的控制。潜流带存在着强烈且明显变化的氧化-还原梯度,这些氧化-还原梯度控制着某些金属元素的价态和存在形态,从而影响着其对P元素的吸附性。Butturini等研究发现,在与河流交换之后,氧化态的潜流带沉积物能极大地阻滞P元素的运移[82]。在充氧和高度氧化环境下,P元素通过配位效应和静电力极易吸附在Fe(Ⅲ)的氢氧化物、Al的氢氧化物、方解石和黏土等矿物表面[83]。Butturini等研究还发现,地表水将氧气带入使得P元素的吸附主要发生在潜流带下降流区域,并且集中在水流进入沉积物最初的数厘米范围内[82]。相比之下,在缺氧的还原环境下,Fe(Ⅲ)的氢氧化物-磷复合物分解并释放溶解态磷[83-84]。在某些缺氧和富营养的潜流带环境(如污染的运河)中,P元素可能与Fe(Ⅱ)化合生成难溶的蓝铁矿(Fe3(PO4)2·8H2O),并发生沉淀而被固定[85]。pH值也影响着矿物对P元素的吸附。当pH值减小时,表面电位改变使得矿物对P元素的吸附能力增强[83]。河床岩性和水动力条件控制着潜流带氧化-还原梯度,因而控制着潜流带对P元素的吸附性,如位于高流速的氧化水流层以下的砂质和砾质河床能增大对P元素的吸附量,而渗透性低且富含有机物的沉积物则具有厌氧环境,能减小对P元素的吸附量[83]。
对生物过程来说,在沉积物中,受生物膜结构和生命过程的控制,潜流带沉积物中的生物膜生产可导致氧化-还原能力具有高度非均质性。潜流带充氧区的生命过程对于有机磷化合物矿化为溶解态生物可利用形式(如磷酸根)、生物合成无机磷、P元素被生命物质吸收和活细胞磷循环的过程非常重要。有关研究在潜流带环境中还识别出一系列与P元素的迁移转化有关的外酶,这说明微生物对P元素的需求主要集中在生物膜群体中[83]。
3.4 有毒污染物
潜流带中常见的有毒污染物有Fe3+、Fe2+、Mn4+、Mn2+、Zn2+、Al3+、Hg2+等金属离子及其化合物,还有As及其化合物等物质。Fe2+和Mn2+常以溶解态存在于较还原、酸性环境中;Fe3+和Mn4+通常以沉淀或者悬浮的络合物等被固定的形式存在于较氧化、pH值较高的环境中;Zn、Al、As等元素则通常溶于水中,并伴随着Fe、Mn等形态变化而被固定或释放;Hg主要以游离态汞Hg2+和甲基汞形式存在,甲基汞有剧毒。
富含污染物的水流流经潜流带时,受酸碱度、氧化-还原条件的影响,污染物主要发生氧化-还原、吸附与解吸、沉淀与溶解、生物催化等生物地球化学过程。
Harvey等通过野外示踪实验、室内吸附实验和数值模拟研究发现,当水流由地表水体流入潜流带时,pH值增大,溶解氧浓度升高,微生物含量增加,潜流带Fe、Mn被氧化进而沉淀[4]。Wielinga等研究发现,上升的还原性地下水与氧化性地表水混合时,还原性Fe、Mn也将发生氧化并沉淀[86-87]。Madigan等研究发现,潜流带Fe、Mn的氧化过程受微生物催化作用控制[88]。
沉淀的铁、锰氧化物可作为一种吸附剂吸附流经的Fe、Mn、Zn、As等溶解态有毒物质并使之被固定[89]。Harvey等利用不同时期的监测数据计算锰氧化物对金属离子的吸附率,发现吸附率随着pH值的增加而增大[4,89]。在潜流带的还原区,铁、锰氧化物还原并溶解,释放出低价离子溶于水[83]。Wielinga等通过原位示踪实验发现,还原和溶解过程是在生物催化作用下进行的,生物呼吸作用消耗有机物和氧气,产生一个还原环境,进而还原铁、锰氧化物[86]。
Nagorski等在研究Fe、As元素在潜流带中的迁移转化时发现,随着pH值和氧化-还原电位升高,铁、锰氧化物对离子吸附能力增强,潜流带去除有毒污染物能力增强[90]。Sengupta等研究了河床沉积物中Fe、Mn、As元素的衰减差异,发现高砷地下水排泄到河流过程中潜流带沉积物和孔隙水中的As与FeOOH结合发生衰减,Mn形成氧化物沉淀[91]。Harvey等发现地下水开采可促进有机碳或其降解产物进入地下水使As元素含量增加[92]。Zhang等对内蒙古河套盆地地下水开采As的迁移影响进行研究,发现湖水引入的可生物降解有机碳促进了Fe(Ⅲ)的羟基氧化物的还原,导致地下水As元素含量呈上升趋势[93]。
Hg元素可以通过挥发、吸附到沉积物和被生物吸收,从水体中除去。潜流带中Hg元素交换过程可以降低或增加Hg元素含量,微生物作用可以促进Hg元素发生甲基化作用[94]。Hinkle等研究了潜流带总汞和甲基汞的地球化学反应,发现总汞、甲基汞与溶解性有机碳含量成正相关关系[95],其原因是溶解性有机碳与Hg元素形成强络合物[96]。
4 潜流带生物地球化学过程模拟
在潜流带中,受多种地形、水文、物理化学条件的控制,潜流带发生着多组分复杂的生物地球化学过程,而现有的研究只是停留在物质的分布、形态、动态变化描述,而很少涉及或只是定性研究这些过程的机理。在研究过程中,由于原位监测和实验室物理模拟费时费力,数值模拟技术作为一种定量化且经济的方法被广泛用于潜流带生物地球化学过程研究。
对潜流带生物地球化学过程的数值模拟是从20世纪80年代初开始的,学者们提出了许多针对潜流带的数学模型:20世纪80年代初,由Bencala提出的瞬时存储溶质运移(One-dimensional Transport with Inflow and Storage,OTIS)模型,被认为是一个“死区模型”(Dead Zone Model)[97];Gooseff等提出的RTD(Residence Time Distribution)模型[98];Salehin等提出的ASP(Advective Storage Path)和TSM(Transient Storage Model)模型[99]。Hoagland等利用OTIS模型模拟了Garner Run河地表水与地下水的相互作用,结果显示Garner Run河具有活跃的水量交换[100]。
关于溶质组分(或污染质)在潜流带的生物地球化学过程的模型则是在20世纪90年代之后才渐渐被提出。Ren等提出了一个概念模型来预测胶体物质在河流和地下水之间的对流交换过程,这个概念模型不仅包括物理运移模拟,还包括诸如河床渗流过程中导致的吸附与解吸等过程模拟[101]。其后,Ren等将这个模型用于解释室内实验过程中所观测到的河水-地下水交换过程[102]。
与此同时,越来越多传统的地表水、地下水数值模型也用于潜流带研究,如美国地质勘探局(USGS)开发的地下水流模型MODFLOW、Charlton等开发的PHAST模型、丹麦水力研究所(DHI)开发的MIKE SHE模型、英国纽卡斯尔大学开发的SHE TRAN模型等。Hester等利用MIKE SHE模型模拟地下水和地表水相互作用以及潜流带对硝酸盐的去除能力,发现环境特征对地表水-地下水交互和反硝化作用影响最大,包括河床水力传导率、河流地形和坡度以及地下水位[22]。Azizian等利用生物地球化学模型模拟在各种环境流条件下的硝酸盐衰减速度[103]。
潜流带生物地球化学模型建立在地下水流数值模型的基础之上。模型的建立首先需要确定模拟区、边界条件、源汇项、反应物初始条件,然后确定模拟区渗透系数(K)、给水度(u)、介质孔隙度(L)、输弥散系数(D)和各目标物的反应动力学速率(k)等参数,利用已有数据对模型进行识别和验证。
尽管越来越多的模型被用于潜流带生物地球化学过程研究,但由于建立潜流带数值模型自身的技术问题(如尺度转化、离散化、模型的建立、水流和生物地球化学过程耦合等问题)尚未解决,监测和数据获取技术还不成熟(难以获取实时数据或原位数据、数据精度不足、监测费财费力等),模拟区实际生物地球化学反应过程的复杂性,渗透系数的不均匀性,造成至今还没有一个水流模型可以完整地刻画潜流带水流过程,也没有一个水流-生物地球化学的耦合模型可以更好地描述潜流带中生物地球化学过程。由此可见,潜流带生物地球化学过程模拟将始终是一个值得深入研究的重要方向。
5 潜流带生物地球化学监测
潜流带作为地表水-地下水交互作用的重要界面,在极小的空间尺度下存在着强烈的水化学和环境指标梯度,水流和水化学是高度动态的。因此,在进行潜流带原位监测时需捕捉这个时空尺度下发生的生物地球化学过程,具体体现在:测定局部尺度上高分辨率(通常小于0.1 m)的水流和水化学梯度、氧化-还原电位、酸碱度等环境条件和孔隙度、渗透系数等物理结构;测定毫米级及更小尺度下的沉积物孔隙结构、孔隙水流路径、生物膜结构和表面化学特征;在短时间内(几分钟或几秒)进行重复测量,以捕捉水流模式和化学梯度随时间的动态变化;进行数周或数月的连续监测以捕捉生物地球化学的季节变化[104]。目前用于潜流带研究最主要的监测技术是原位培养技术、探测和取样技术。
5.1 原位培养技术
为了使研究过程尽量在自然状态下进行,引入了各种原位培养室。这些培养室(Experimental Chambers或Colonization Chambers)是将河流的小部分区域圈闭起来,填充原位未被扰动的沉积物,并在其中加入微型生态系统(Microcosms)以用于生物地球化学测试[102,105]。
原位培养室被广泛应用于河床潜流带代谢过程研究[106]。这些培养室可取样用于异位测试,也可原位测定溶解氧、酸碱度、H2S、水流和溶质滞留时间等,生物的好氧与厌氧代谢率及其代谢产物,物质的转化速率、硝化与反硝化速率和其他代谢参数[107-108]。原位培养室通常与其他原位探针联合使用。
潜流带生物地球化学研究最常见的原位培养室是低速渗流柱,它被用于刻画原位生物地球化学过程和确定微生物活性、潜流带沉积物物理化学环境。Mermillod-Blondin等使用低速渗流柱来量化局域尺度下(厘米级)潜流带生物地球化学过程及相应的微生物活动[109]。渗流柱原位安置于潜流带,并且能准确地再现潜流带氧化-还原梯度、高度非均质性,沉积物厌氧区发生的反硝化过程和发酵过程[109]。
然而,原位培养室的应用还存在许多不足[110]:被培养室圈闭的河床(或者潜流带沉积物)存在着许多不确定因素,这部分沉积物不能体现更大或更小尺度下河床的非均质性;原位培养室的应用改变了水流区域,改变了光线与河床的接触,改变了温度条件并使代谢产物变得过饱和[66,110]。这些因素都有可能导致自养作用被高估而潜流带呼吸量被低估[67]。Uzarski等提出了一个试图克服上述不确定性因素的装置,并将其用于溶解氧的原位测试,这个培养室考虑了潜流带代谢并强调了溶解氧对准确估计河流初级生产力和群落呼吸作用的重要性[68]。
5.2 探测和取样技术
进行潜流带研究一方面可利用各种探测技术和地球物理探测技术原位直接获取各种参数和数据,另一方面可基于各种物理取样技术采集样品,以供异位测试获取各种参数。
原位测试主要借助各种探测器或各种地球物理探测技术。常用的探测器有各种离子选择电极和硅胶微型电极、各种活性表面探针(扩散梯度薄膜探针、扩散平衡薄膜探针和半透膜探针),它们可用于原位测定潜流带温度、酸碱度、氧化-还原电位、电导率和各种化学物质(如重金属微量物质、氯有机化合物、一系列离子、硫化物及其相关化合物等)的浓度[111-112]。近年来,各种生物传感器(Biosensor)也被引入潜流带研究,可用于测定生物可利用性化学物质浓度、生化需氧量(Biochemical Oxygen Demand,BOD)、温度等[113]。用于潜流带研究的地球物理探测技术有γ射线和电导率测井、断层摄影术和电成像技术、声音成像技术和穿地雷达技术等,可为高精度生物地球化学研究非侵入、实时获取重要的潜流带数据[114]。
针对不同空间尺度,潜流带研究可采取不同的取样技术。在沉积物尺度上,可进行原状取芯(如冰冻取芯技术),所取岩芯可供室内分析获取不同深度的参数,但这种取芯技术水平分辨率低[115]。在沉积物尺度上研究河湖-河滩上升流和下降流时,可在上升流和下降流区分别埋藏原位沉积物样品和各种探针,原位测定一些参数的垂向分布,或分别取芯异位分析[116-117]。在河段尺度上,可设置若干条河流断面分别密集取芯并用探管原位检测,以获取潜流带空间离散参数[118]。
6 结 语
(1)虽然许多传统的监测和采样技术被用于潜流带研究,并引入了许多新技术,但现有的监测和采样技术仍然难以满足研究需求,如在水位较深和水流速度较快的河流中原位采集潜流带介质样品和指定深度的孔隙水样品等还很困难。正如Benner等指出的一样,一旦潜流带介质样品离开原位,其物理化学条件将会发生变化[119]。未来需要研究新的采样、运输和保存技术以确保样品在测试时可以保证其原始状态。
(2)河流和湖泊沉积物水文地质参数控制着地表水-地下水相互作用过程,受沉积环境影响,这些参数存在极大的空间异质性,而用现有的技术方法难以测定,在研究中也往往被忽略,如河水沉积物的渗透系数随着深度、离主河道距离而发生变化。因此,还需要一套更好的精细描述水文地质参数空间变异性的方法。
(3)潜流带是一个强烈的动态环境,不仅表现在水文和物理化学特征上,还表现在其微生物生态和功能上。虽然对整个潜流带环境的有机碳总矿化率或总呼吸率研究较多,但针对某种特定微生物的动态研究则非常少,因为将特定微生物代谢结果从原位环境的代谢结果中区分出来的实验设计还存在困难;其次,现有的微生物取样方法和检测技术还存在局限性。此外,由于潜流带中一些对氧化-还原条件极为敏感的元素(如C、N、S等)同位素往往会产生明显的动力学分馏,所以同位素技术与微生物实验相结合将成为研究潜流带生物地球化学行为的重要手段。
(4)需要一个三维的水流模型来更好地模拟和分析潜流带水流问题的本质,生物地球化学过程是受水流过程控制的,同时也需要一个水流-生物地球化学耦合模型来描述潜流带中生物地球化学过程。
(5)绝大多数潜流带的研究只限于河流,而对于湖泊中的潜流带研究很少。由于湖泊沉积物-水界面物质生物地球化学研究多是基于湖泊沉积的静水条件,与河水-地下水交互作用带中相对强烈和频繁变化的水动力条件具有明显差异,未来需加强对湖泊潜流带的研究。
(6)微生物的广泛参与是生物地球化学行为的重要特点,但目前对于地下水、土壤中生物地球化学作用主体的微生物多开展了数量评价方面的研究,而对于潜流带中参与生物地球化学活动的微生物生态系统结构和功能研究目前还处于起步阶段。
(7)目前潜流带重金属污染的研究主要集中在Fe、Mn、As、Hg等元素,而潜流带中Zn、Al、Cu、Cd、Pb等有毒有害金属污染研究较少,将来应加强这方面的研究。
