基于CuFe2O4载氧体的羊肠煤化学链气化特性
2019-05-21马晶晶胡修德郭庆杰
安 梅, 马晶晶, 吴 唯, 任 天, 胡修德, 郭庆杰
(宁夏大学 省部共建煤炭高效利用与绿色化工国家重点实验室, 宁夏 银川 750021)
煤炭是中国目前乃至今后相当长一段时期内的主要能量资源[1]。随着一带一路和西部大开发进程的加速,宁东基地作为西部煤炭开发重心[2],其地位日益受到重视。然而,在资源日益短缺和环境日益恶化的双重压力下,宁东基地的煤炭转化利用需要开发节能、环保、高效的煤炭转化新技术。煤化学链气化技术被认为是一种应用前景广阔的煤转化利用新技术[3-5]。因此,针对宁东基地煤炭的化学链气化研究,对宁东煤炭资源开发利用具有重要的理论和现实意义。
煤化学链气化技术的原理与化学链燃烧相似[6]。载氧体是煤化学链气化的关键[7]。在煤化学链气化反应体系中,除了要求载氧体循环稳定性好、价格低廉、来源广泛和环境友好外,还需载氧体具有一定的催化功能[8]和适中的氧化能力[9],可以将煤气化中间产物的碳氢元素尽可能地转化为CO和H2,减少CO2和H2O的生成。目前已开发的载氧体有铜基[10]、铁基[11-12]和钙基[13]等,但铜基载氧体容易烧结、铁基载氧体反应性能较低,钙基(CaSO4)载氧体释放有害含硫气体。为了克服上述单一金属载氧体的不足,双活性组分载氧体被大量开发和测试[14-15],如具有尖晶石结构的CuFe2O4载氧体。Niu等[16-18]考察了CuFe2O4载氧体与不同燃料的化学链燃烧反应性能,发现CuFe2O4载氧体在反应过程中既能抑制Cu的烧结,又能增强Fe的还原能力,提高循环稳定性和反应活性。目前,Wang等[19]探究了过氧系数和反应温度对化学链燃烧过程中CuFe2O4载氧体氧传递以及其对煤结构演变的影响。但CuFe2O4载氧体在化学链气化和化学链燃烧过程中所处环境不同,氧传递机理和反应性能也存在差异。对煤化学链气化过程中CuFe2O4载氧体的反应性和氧传递机理尚不清楚。因此,探究化学链气化过程中CuFe2O4载氧体的反应性和氧传递机理非常必要。
基于此,笔者选择宁东基地典型矿区羊肠煤为燃料,以CuFe2O4为载氧体,在TG-MS上以模拟煤气作为燃料探索CuFe2O4载氧体还原过程的氧传递机理。在此基础上,研究羊肠煤与CuFe2O4载氧体反应性能和循环稳定性。旨在为宁东煤炭资源化学链气化新技术的开发利用提供理论基础。
1 实验部分
1.1 原料及试剂
三水合硝酸铜(Cu(NO3)2·3H2O)、九水合硝酸铁(Fe(NO3)3·9H2O)和硼氢化钠(NaBH4)均为分析纯,国药集团化学试剂有限公司产品。煤粉为次烟煤,产自宁夏宁东基地,粒径为75~150 μm,使用前于105 ℃干燥12 h,记为YC,其工业分析及元素分析见表1,煤中主要金属氧化物质量分数见表2。

表1 羊肠煤(YC)工业分析及元素分析结果Table 1 Proximate and ultimate analysis of YC
1) Proximate analysis; 2) Ultimate analysis
Md—Moisture; Ad—Ash; Vd—Volatile; FCd—Fixed carbon; C—Carbon element; H—Hydrogen element; N—Nitrogen element; St—Total sulfur element; O — Oxygen element; LHV — Lower heating value
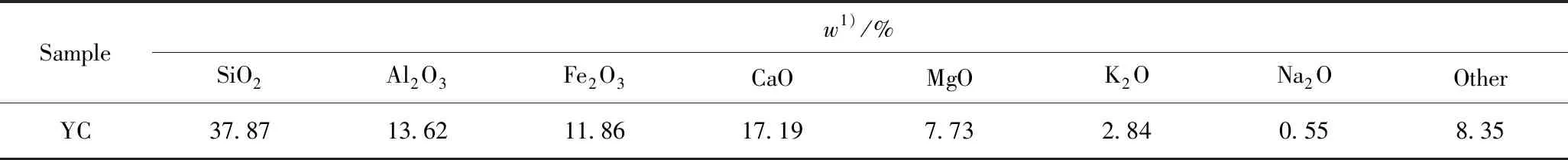
表2 羊肠煤(YC)中金属氧化物的质量分数Table 2 Inorganic constituents mass fraction in YC
1) Ash composition
1.2 CuFe2O4载氧体的制备
采用氧化还原法[20]一步制备CuFe2O4载氧体。按照n(Cu2+)/n(Fe3+)=0.5,n(NaBH4)/n(Cu2++Fe3+)=2,将9.37 g三水合硝酸铜(Cu(NO3)2·3H2O)和32.32 g九水合硝酸铁(Fe(NO3)3·9H2O)溶于200 mL 去离子水中,将9.12 g硼氢化钠(NaBH4)溶解于280 mL去离子水中,然后将上述2种溶液缓慢均匀地加入胶体磨中,以2000 r/min的速率搅拌3 min,得到混合溶液。将上述混合溶液转移至1000 mL聚四氟乙烯内胆的高压反应釜中,于150 ℃ 水热晶化12 h,然后自然冷却至30 ℃,将得到的黑色沉淀离心分离,用蒸馏水反复洗涤以除去黑色沉淀中可能残存的杂质离子,最后将黑色沉淀在110 ℃干燥24 h。将干燥后的黑色沉淀再置于950 ℃的马福炉中恒温煅烧6 h,破碎,用标准筛筛分得到粒径为75~150 μm的CuFe2O4载氧体。
1.3 实验仪器
实验采用德国耐驰公司的STA449F3热重-质谱联用仪。结合脉冲热分析法,定量检测煤化学链气化产物,其原理是通过定量环每次向热重分析仪中打入500 μL的标准气,通过比较标准气体峰面积和反应过程中气体峰面积,实现对反应过程逸出气体定量。其中,标准气体是采用称量法按照n(CO2)∶n(CO)∶n(CH4)∶n(H2)=1∶1∶1∶1配制。
XRD测定采用德国布鲁克D8型X射线粉末衍射仪。比表面积(BET) 测定采用美国Quantachrome公司生产的NOVA1000e 型物理吸附仪。SEM-EDS表征采用日本日立公司生产的Hitachi S4800型冷场发射扫描电镜显微镜。
1.4 实验流程
1.4.1 CuFe2O4载氧体的氧传递
称取300 mg(±0.2 mg) CuFe2O4载氧体,以n(CO2)∶n(CO)∶n(CH4)∶n(H2)=1∶1∶1∶1的混合气体为还原气体,在还原气氛下以10 ℃/min 的升温速率升至950 ℃,采用质谱分析仪对气体进行检测。
1.4.2 YC/CuFe2O4和YC/Al2O3的还原反应性能
由表1中YC的工业分析和元素分析数据,计算YC的化学计量系数为C48H26N0.76S0.13O1.3。按照CuFe2O4与YC载氧体的质量比为10,将CuFe2O4载氧体和YC物理混合,并将混合后的YC/CuFe2O4样品在水蒸气气氛中以10 ℃/min升温速率从150 ℃加热至950 ℃,并恒温20 min。采用质谱分析仪对气体进行检测。另外以Al2O3代替CuFe2O4,YC/Al2O3作为对比样,实验条件与YC/CuFe2O4的相同。
1.4.3 CuFe2O4载氧体化学链气化循环实验
YC/CuFe2O4还原反应结束,继续在950 ℃下切换至空气气氛,保持30 min,保证CuFe2O4载氧体完全被氧化。按照上述步骤重复10次。
1.5 数据处理
1.5.1 失氧数(δ)
δ为某温度段CuFe2O4载氧体在还原气氛中失去氧原子的个数,也就是失氧数,由式(1)计算:
(1)
式中,Δw为某温度段CuFe2O4载氧体的质量损失量;M为CuFe2O4载氧体的相对分子质量。
1.5.2 气体的摩尔累积量
由式(2)计算气体的摩尔累积量ni:
(2)
式中,ni为气体i(i为CO2、CO、H2和CH4)的摩尔累积量,mol;Ii为样品逸出气体i的离子流强度;Ii0为校正气体i的离子流强度;ni0为校正气体i的摩尔累积量,mol。
1.5.3 合成气的摩尔分数(ηsyn)
合成气的摩尔分数(ηsyn)为一定时间内煤气化生成的有效气(CO、H2和CH4)摩尔累积量与气体总摩尔累积量的比值,由式(3)计算:
(3)
2 结果与讨论
2.1 CuFe2O4载氧体的氧传递机理
利用TG-MS探究CuFe2O4载氧体的氧传递机理。图1为CuFe2O4载氧体在模拟煤气气氛下的TG、DTG和MS曲线。根据图1(a)中CuFe2O4载氧体的质量损失率将整个反应过程分为a、b、c、d共4段:4个阶段的质量损失率分别为5.66、0.6、6.34和5.16百分点,对应的失氧数δ为0.85、0.09、0.95和0.77。由图1(a)中TG的a阶段(300~500 ℃)表明CuFe2O4载氧体具有较好的低温反应活性。这个阶段CuFe2O4载氧体中Cu2+周围的O2-容易从晶格中逸出,Cu2+被还原为Cu单质,同时Cu2+的还原加快了Fe3+与Fe2+之间的转化,形成尖晶石结构Fe3+Fe2+[Fe3+O4][21]。释氧过程为:3CuFe2O4→3Cu+2Fe3O4+4[O],也就是说CuFe2O4载氧体还原为Cu和Fe3O4。b阶段(500~600 ℃)CuFe2O4载氧体的质量损失率稳定,表明Fe3O4是相对稳定的。c和d阶段(600~1000 ℃)CuFe2O4载氧体随着温度的升高,Fe3O4继续被还原。当温度升至1000 ℃时,曲线的质量损失率趋于平稳,表明还原结束。此时,CuFe2O4载氧体的失氧数约为2.66,其释氧过程为:CuFe2O4→Cu+2Fe+4[O],CuFe2O4载氧体被还原为金属Cu和金属Fe。
由图1(b)可知,在a阶段,H2和CO的相对强度呈现负值,CO2和H2O的相对强度呈现正值,表明H2和CO与CuFe2O4载氧体发生反应,生成CO2和H2O。这与图1(a)中的TG曲线相一致。在b阶段,H2和CO与CuFe2O4载氧体继续反应,H2O的相对强度保持增加的趋势。但此时CO2相对强度却呈现降低趋势。分析造成这一现象的原因是CuFe2O4载氧体在反应过程中形成了氧缺位CuFe2O4-δ,而这种材料可以催化分解CO2,生成CO,所以CO2相对强度呈现降低趋势。d阶段气体释放曲线变化较明显,CH4和CO2相对强度呈现先下降后上升的趋势,CO和H2的相对强度呈现先上升后下降的趋势。这主要是由于CuFe2O4载氧体还原程度加剧,生成类似于FeO的低价态氧化物。FeO具有较强的催化CH4和CO2重整的功能[22]。
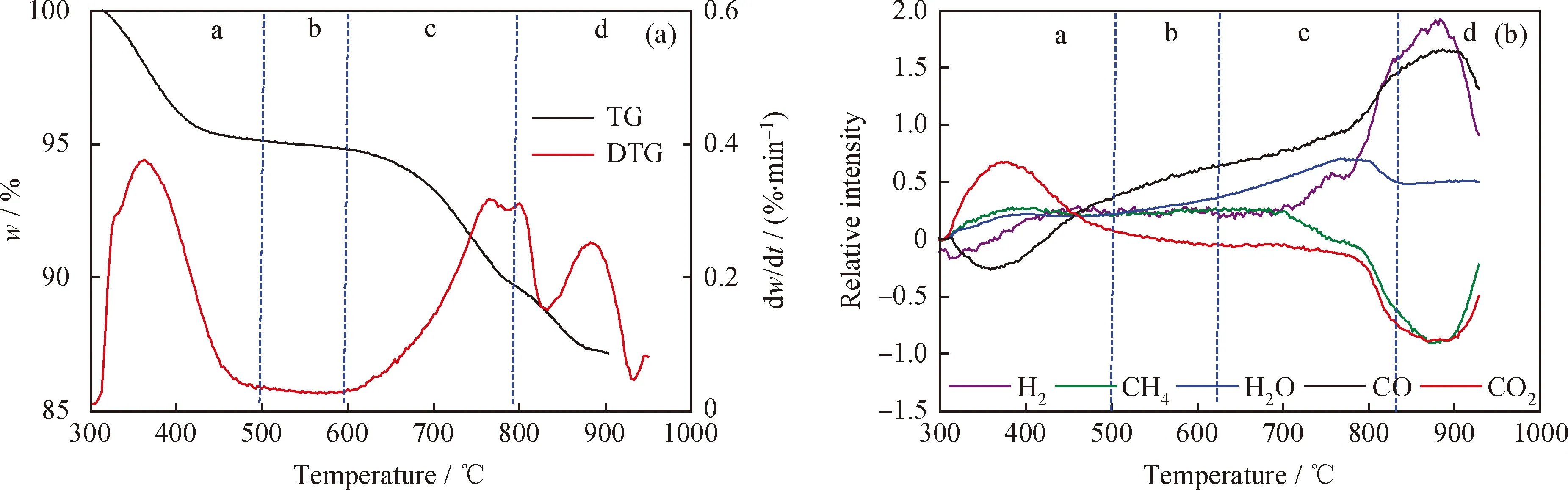
图1 CuFe2O4载氧体在模拟煤气气氛下TG、DTG和MS曲线Fig.1 TG, DTG and MS curves of CuFe2O4 in the syngas atmosphere(a) TG and DTG; (b) MS
综上所述,CuFe2O4载氧体的氧传递过程可以分为以下几个步骤:首先CuFe2O4载氧体被还原为Cu单质和Fe3O4;然后Fe3O4再继续还原,生成类似于FeO的低价态氧化物,随着反应温度的升高,最终转化为Fe单质。在这个过程中形成的氧缺位CuFe2O4-δ具有催化分解CO2的作用,尤其是生成类似于FeO的低价态氧化物对CH4和CO2重整作用非常显著。
2.2 YC和CuFe2O4载氧体的TG特性
图2为YC/CuFe2O4和YC/Al2O3的质量损失和质量损失率曲线。由图2(a)可知,CuFe2O4载氧体几乎没有质量损失,表明水蒸气气氛下CuFe2O4载氧体性能较为稳定。YC/CuFe2O4和YC/Al2O3样品有明显的质量损失,而且YC/CuFe2O4比 YC/Al2O3的质量损失更明显。这一现象的出现主要有以下几方面原因:1)CuFe2O4载氧体充当了催化剂,在YC热解过程中促进了YC的热解,增加了失重率;2)YC热解产物中的CO、CH4和H2等物质与CuFe2O4载氧体发生还原氧化反应,CuFe2O4氧载体因晶格氧的失去而降低了质量。由图2(b)可知,YC/Al2O3在826 ℃左右有1个明显的质量损失峰,这个质量损失峰是由于YC发生了气化反应所致。YC/CuFe2O4在786 ℃有1个明显的质量损失峰,比YC/Al2O3的最大质量损失率的温度提前了50 ℃,表明CuFe2O4载氧体的加入提高了YC气化的速率。
2.3 YC和CuFe2O4载氧体反应过程的气体释放特性
图3为YC/CuFe2O4和YC/Al2O3气化过程释放的H2、CO2、CO和CH4的MS曲线。在热解阶段,YC/Al2O3随着温度的升高YC中的脂肪键、部分芳香弱键以及含氧羧基官能团断裂,释放小分子化合物H2、CO、CO2和CH4等[23]。与YC/Al2O3相比,YC/CuFe2O4中由于CuFe2O4载氧体和YC热解释放的挥发分发生反应,所以CO2在400 ℃左右出现了1个峰。这个现象与图2(a)
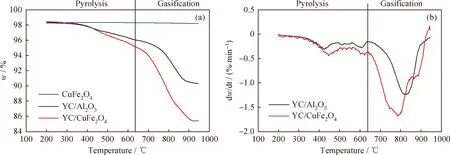
图2 YC/CuFe2O4和YC/Al2O3的气化过程中质量损失和质量损失率Fig.2 Comparison of mass loss and mass loss yield for YC coal with CuFe2O4 and YC coal with Al2O3 during the gasification(a) TG; (b) DTG
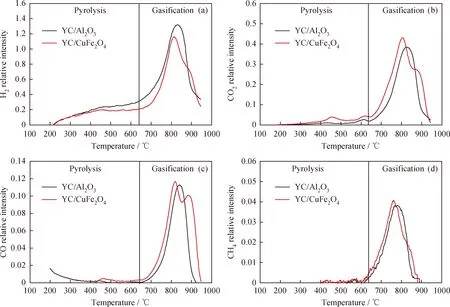
图3 YC/CuFe2O4和YC/Al2O3气化过程释放H2、CO2、CO和CH4的MS曲线Fig.3 Comparison of MS profiles for H2, CO2, CO and CH4 of YC coal with CuFe2O4 and YC coal with Al2O3(a) H2; (b) CO2; (c) CO; (d) CH4
TG曲线相一致。在气化阶段,YC/CuFe2O4中H2的开始释放时间迟于YC/Al2O3,这主要是由于YC气化释放的H2与CuFe2O4载氧体反应。与H2相比,YC/CuFe2O4和YC/Al2O3中CO的开始释放时间间隔较小,主要是因为H2与CuFe2O4载氧体反应的速率比CO快。
表3为YC/CuFe2O4和YC/Al2O3气化过程释放的CO2、CO、H2和CH4的摩尔累积量、合成气的摩尔分数。与YC/Al2O3气化相比,YC/CuFe2O4化学链气化过程中H2的摩尔累积量降低,而CO2、CO和CH4的摩尔累积量增加。H2摩尔累积量降低的原因是H2和CuFe2O4载氧体发生了反应。CO2摩尔累积量增加的原因主要有两个:一是YC的惰质组分含有较多稳定的含氧官能团,在600 ℃之后会释放含氧气体CO2[24];二是CO和CH4与CuFe2O4载氧体反应生成的CO2。从还原性气体与CuFe2O4载氧体发生化学反应的角度出发,CO和CH4摩尔累积量应该呈现降低的趋势,但由表3可知,CO和CH4的摩尔累积量增加,原因是在CuFe2O4载氧体的还原过程中,形成了具有催化分解CO2功能的氧缺位材料CuFe2O4-δ。并且CuFe2O4载氧体催化分解CO2的速率大于其与CO、CH4发生还原反应的速率。
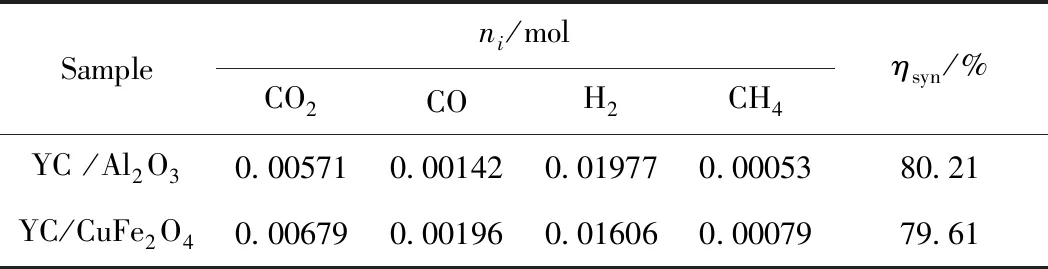
表3 YC/CuFe2O4和YC/Al2O3气化过程释放CO2、CO、H2和CH4的摩尔累积量(ni)和合成气的摩尔分数(ηsyn)Table 3 YC coal with CuFe2O4 and YC coal with Al2O3molar amount of gaseous (ni) and themole fraction of syngas (ηsyn)
2.4 YC和CuFe2O4载氧体的循环实验
图4为CO、CO2、CH4和H2气体摩尔累积量随循环次数的变化。由图4可知,6次循环后H2和CO2的摩尔累积量略有升高,CO的摩尔累积量稍有降低,可能是因为CuFe2O4载氧体在循环反应过程中反应活性和催化分解CO2活性略有下降。但从整体分析可知,在10次YC和CuFe2O4载氧体循环过程中,气体产物各组分的摩尔累积量基本保持稳定,表明10次循环过程CuFe2O4载氧体整体反应性能稳定。

图4 CO、CO2、CH4和H2气体摩尔累积量随循环次数的变化Fig.4 Effect of redox cycles on CO, CO2, CH4 andH2 molar amount of gaseous
2.5 CuFe2O4载氧体反应前后形态结构的分析
图5为新鲜、还原、1次循环再生和10次循环再生CuFe2O4载氧体的XRD谱。由图5可知,新鲜CuFe2O4载氧体在30.2°、35.6°、57.0°等处出现CuFe2O4载氧体的特征衍射峰,表明还原氧化法制备的CuFe2O4载氧体具有很好的晶相结构。从还原后的CuFe2O4载氧体的XRD谱可知,Cu2+以Cu单质形式析出,Fe3+以反尖晶石结构Fe3O4存在,而这种结构的载氧体表面具有丰富的氧缺位[25],具有催化分解CO2的作用。1次循环再生的CuFe2O4载氧体的XRD谱上Cu单质衍射峰消失了,说明Cu又重新进入尖晶石结构中恢复了CuFe2O4载氧体晶体结构。10次循环再生CuFe2O4载氧体的XRD谱与新鲜CuFe2O4载氧体相同,其晶体结构依然具有尖晶石结构,说明CuFe2O4载氧体具有良好的循环稳定性。
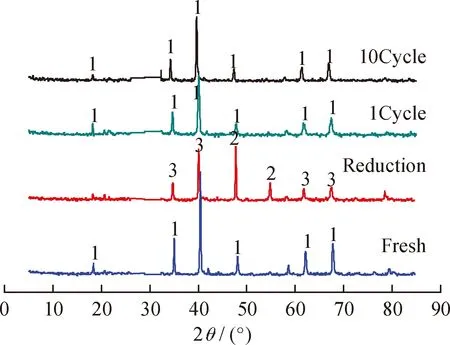
图5 新鲜-还原-1次循环和10次循环CuFe2O4载氧体的XRD谱Fig.5 XRD profiles of fresh, reduced, 1 cycle and10 cycle CuFe2O4 oxygen carrier1—CuFe2O4; 2—Cu; 3—Fe2O3
图6为新鲜的CuFe2O4载氧体和10次循环再生的CuFe2O4载氧体的SEM和EDS,表4为新鲜CuFe2O4载氧体和10次循环再生CuFe2O4载氧体的比表面积。由图6可知,新鲜的CuFe2O4载氧体具有均一的形貌,表面光滑,10次循环后的CuFe2O4载氧体表面变得疏松多孔。这是因为CuFe2O4载氧体在反复的还原和氧化过程中发生了气-固反应,导致CuFe2O4载氧体孔道受气体反应物及产物冲击而变得疏松多孔。由表4还可知,10次循环后CuFe2O4载氧体的比表面积比新鲜CuFe2O4载氧体的比表面积增加了13 m2/g。这与文献报道的结果一致[26-27]。另外,EDS检测到10次循环的CuFe2O4载氧体表面含有来自煤灰的元素Si和Al,说明煤灰在CuFe2O4载氧体的表面沉积。结合图4可知,载氧体表面煤灰的沉积使其反应活性和催化分解CO2活性略微低于新鲜载氧体的,但在10次循环过程中气体产物各组分的摩尔累积量基本保持稳定。因此,在10次循环再生实验过程中CuFe2O4载氧体虽然表面沉积了煤灰,但仍呈现良好的循环反应特性。

表4 新鲜CuFe2O4载氧体和10次循环后CuFe2O4载氧体的比表面积Table 4 BET of fresh and 10 cycle CuFe2O4 oxygen carrier

图6 新鲜的CuFe2O4载氧体和10次循环的CuFe2O4载氧体的SEM照片和EDSFig.6 SEM and EDS of fresh and10 cycle CuFe2O4 oxygen carrier(a),(c) SEM; (b),(d) EDS(a),(b) Fresh CuFe2O4; (c),(d) 10 Cycle CuFe2O4
3 结 论
利用TG-MS研究了CuFe2O4载氧体的氧传递机理以及YC和CuFe2O4的化学链气化特性。得出以下几点结论:
(1)CuFe2O4载氧体具有提供晶格氧和催化分解CO2的双功能。CuFe2O4载氧体在还原反应过程中形成的氧缺位材料CuFe2O4-δ具有催化分解CO2的功能。
(2)与YC/Al2O3相比,YC/CuFe2O4的化学链气化过程中H2的摩尔累积量含量降低,而CO2、CO和CH4的摩尔累积量增加。
(3)10次循环实验中,气体产物各组分的摩尔累积量保持稳定,CuFe2O4载氧体表现良好的反应性能和催化性能。
