长链非编码RNA Hotair通过调控巨噬细胞表型转换促进胃癌细胞增殖与侵袭
2019-05-18李燕周雄坤刘静苟亚军
李燕 周雄坤 刘静 苟亚军
胃癌作为全球第二大恶性肿瘤,每年有超过100万的新发病例[1]。由于饮食习惯的问题,中国是胃癌的高发国家,2017年有近70万新发病例,且大部分患者诊断时已为进展期胃癌,易侵袭转移,死亡率较高[2]。胃癌早期症状不明显,因此寻找胃癌的特异性诊断标志物并探究其机制对于胃癌的治疗、诊断具有重要意义。
越来越多的研究表明,lncRNA在癌症的发生发展过程中起到了重要作用,其能够调节细胞功能[3]。已经有文献表明,一系列lncRNA能够调节癌症相关通路,甚至可以作为预后评价标志物或者治疗靶点[4]。巨噬细胞是许多肿瘤的重要细胞成分,一般将这种巨噬细胞命名为肿瘤相关性巨噬细胞或癌支持巨噬细胞,有研究表明其对于肿瘤的发展有促进作用[5-7]。有研究表明,lncRNA Hotair在胰腺癌中表现出促癌性质,与预后较差相关[8]。本研究,发现胃腺癌细胞能够通过lncRNA Hotair将肿瘤中的巨噬细胞转变为癌支持巨噬细胞,并且局促进癌细胞的增殖与侵袭,从而促进胃癌的发展,有可能为胃腺癌的早期诊断与治疗提供新的靶点。
材料与方法
一、实验材料
1.组织样本:从陆军军医大学第一附属医院2015至2017年住院的胃腺癌患者中随机选出30 例纳为本次研究对象。排除标准:(1)严重心脏、肝脏、肾脏、肺功能不全;(2)合并感染、肿瘤、免疫性疾病;(3)合并血液系统疾病。该研究通过了西南医院伦理委员会的批准(伦理号:20151024),所有患者都签署了知情同意书。所有组织在切除后立即冰冻并保存于-80℃,以备进一步实验。
2.细胞系:AGS人胃腺癌细胞(北京北纳生物公司)。
3.实验试剂:DMEM/F12培养基(美国Sigma公司),胎牛血清(美国Gibco公司),Lipofectamine 2000(美 国 Invitrogen 公 司),IL-1β、IL-6、IL-4、TNF-α、TGF-β 与 IL-10 ELISA 试剂盒,Hotair质粒与siRNA(中国吉玛基因公司)。
4.实验动物:3月龄SD大鼠来自陆军军医大学第一附属医院实验动物中心。
二、实验方法
(一)胃癌细胞系培养与转染
AGS人胃腺癌细胞购自北京北纳生物公司。细胞培养于含10%胎牛血清与1%青霉素-链霉素的DMEM/F12培养基中,培养环境37℃,含5% CO2。使用Lipofectamine 2000作为转染试剂,lncRNAHotair或干扰RNA以50 nmol/L的浓度加入每孔细胞。Hotair特异性引物为:上游:5'-CATG GATCCACATTCTGCCCTGATTTCCGGAACC-3';下 游:5'-ACTCTCGAGCCACCACACACACACAA CCTACAC-3'。HotairsiRNA序列为:5'-GCGCCUUCC UUAUAAGUAUTT-3'。Hotair质粒与 siRNA都由吉玛基因合成。细胞分为空白对照组、Hotair过表达组与RNA干扰组。
(二)巨噬细胞分离与培养
巨噬细胞从大鼠腹腔中提取。首先将含有青霉素和链霉素的PBS溶液注射入SD大鼠腹腔并揉搓腹部,2 min后从腹部抽取出液体并以300×g转速离心5 min。随后细胞重悬于红细胞裂解液中2 min。再次离心后将巨噬细胞培养于含10%FBS的RPMI1640培养基中,3 h后去除没有贴壁的细胞,更换新的培养基。培养基每2天更换1次。
(三)共培养实验
巨噬细胞与AGS人胃腺癌细胞的共培养实验使用Transwell小室完成。对照组为:巨噬细胞以1×105个/孔的密度加入 24 孔 Transwell板上室(孔径0.4 μm),AGS细胞组在对照组基础上,AGS细胞以同样密度加入下室,共培养3 d,进行后续检测。
(四)指标检测
1.细胞侵袭实验:使用Matrigel基质胶包被的Transwell小室测定AGS细胞的侵袭迁移能力。加100 μl无血清培养基AGS细胞悬液至Transwell上室,600 μl培养基(10%血清)加入下室。24 h后取出小室,PBS溶液洗涤后甲醇固定30 min,0.1%结晶紫染色20 min,镜下观察。
2.细胞增殖检测:使用CCK-8试剂盒检测细胞增殖。各组的AGS细胞贴壁于96孔板并培养48 h后,每孔加入10 μl CCK-8试剂,继续培养2 h,使用酶标仪测定459 nm处吸光度。
3.细胞免疫荧光染色:各组巨噬细胞种植于细胞爬片,使用4 %多聚甲醛固定后,CD86一抗4 ℃孵育过夜。随后使用Alexa Fluor 568标记的二抗室温染色1 h。使用同样的方法标记细胞表面CD206。最后使用蔡司荧光显微镜观察拍照。
4.胃癌组织原位杂交实验:对于石蜡包埋的胃癌组织切片,首先使用10 mmol/L的柠檬酸溶液煮沸10 min修复抗原,使用Triton X-100透膜。使用浓度为2 ng/μl荧光标记的HotaircDNA探针溶液孵育24 h。随后使用CD206抗体对巨噬细胞进行免疫荧光染色,以进行巨噬细胞与lncRNA Hotair的共定位。
5.酶联免疫吸附测定:在96孔板细胞生长至数量为5×105个之后,使用ELISA实验检测各项炎症相关因子的水平。首先使用标准品绘制各个因子的标准曲线。各组细胞培养24 h后取上清液,按照双抗夹心法实验步骤进行IL-1β、IL-6、IL-4、TNF-α、TGF-β 与 IL-10 浓度检测。
6.流式细胞术:使用流式细胞术检测巨噬细胞的表型转化。各组细胞使用APC标记的CD86抗体与FITC标记的CD206抗体进行染色。染色完成后每组取约1×105个细胞重悬于100 μl流式缓冲液中,使用Accuri C6流式细胞仪进行检测,实验结果使用FlowJo软件进行分析。
7. RNA提取与定量RT-PCR:使用TRIzol提取细胞中的RNA。使用cDNA合成试剂盒合成cDNA第一链。随后使用SYBR Green I染料在CFX Connect荧光定量PCR检测系统中进行RT-PCR,以GAPDH做归一化处理。引物序列如下:GAPDH上游引物:5'-CTCAGTTGCTGAGGAGTCCC-3',下游:5'-ATTCGGAGAAGGGAGGGCT-3';PICSAR:上 游:5'-TGCCTGGACTTTCAAGAGGTAA-3',下游:5'-GCTCTCAGTCAGCAGACACTT-3'。
8.细胞增殖检测:使用CCK-8试剂盒检测细胞增殖。Transwell上室AGS细胞贴壁于培养48 h后,每孔加入30 μl CCK-8试剂,继续培养2 h,使用酶标仪测定450 nm处吸光度。
三、统计学分析方法
采用SPSS 19.0软件进行数据统计分析,细胞数量、吸光度值、RNA含量等指标以x± s表示,两组间均数比较采用t检验,多组均数间比较采用单因素方差分析,组间多重比较采用SNK-q检验,以P< 0.05为差异有统计学意义。
结 果
一、胃腺癌细胞将巨噬细胞转化为抗炎型癌支持细胞
为了确定胃腺癌细胞对邻近巨噬细胞的影响,本研究进行了共培养实验,AGS胃腺癌细胞与巨噬细胞共培养于Transwell板中。3 d后使用免疫荧光染色检测CD206与CD86阳性细胞数量。结果表明,AGS细胞组中,CD206阳性巨噬细胞数量(32.51±5.44)个多于对照组(5.63±1.97)个,而CD86阳性细胞数量降低,表明实验组中更多的巨噬细胞转变为癌支持细胞(图1、表1)。
表1 两组巨噬细胞不同表型数量(个,± s)
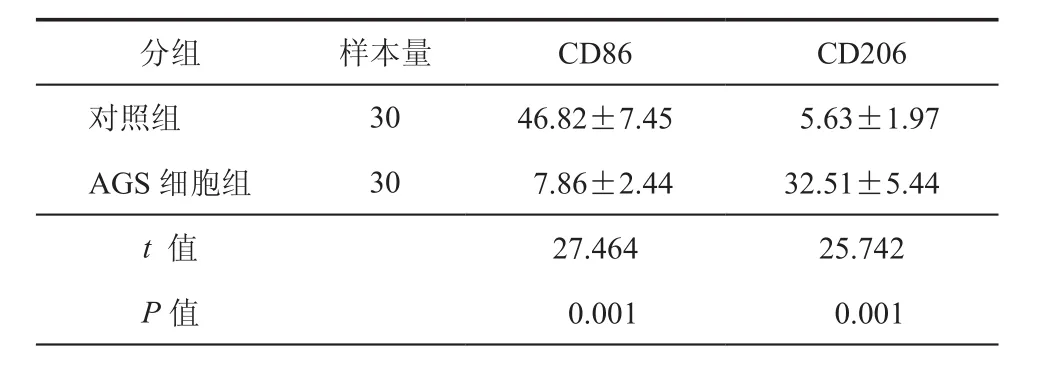
表1 两组巨噬细胞不同表型数量(个,± s)
分组 样本量 CD86 CD206对照组 3046.82±7.455.63±1.97 AGS 细胞组 307.86±2.4432.51±5.44 t 值 27.46425.742 P值 0.0010.001
随后的ELISA实验也印证了这一结论,AGS细胞组巨噬细胞分泌的TNF-α、IL-1β和IL-6三种炎性因子水平降低,而TGF-β、IL-4和IL-10三种抗炎因子水平升高(表2)。
二、胃腺癌细胞通过长链非编码RNA Hotair作用于巨噬细胞

图1 倒置荧光显微镜观察两组胃腺癌细胞对邻近巨噬细胞的影响(免疫荧光染色,×400)
表2 两组炎症相关因子水平检测(pg/ml,± s)

表2 两组炎症相关因子水平检测(pg/ml,± s)
分组 样本量 IL-6 TNF-α IL-1β TGF-β IL-4 IL-10对照组 30986.51±239.132986.43±731.21567.92±143.4787.32±19.2449.94±17.5698.82±46.26 AGS 细胞组 30321.63± 96.32998.34±314.73212.41±101.24163.45±54.91156.83±69.25385.65±24.75 t 值 14.13613.68011.0947.1678.20329.991 P值 0.0010.0010.0010.0010.0010.001
本研究首先从GEO数据库中筛选出胃癌组织与邻近正常组织表达差异最大的两种lncRNA:lncRNA Hotair与lncRNA PICSAR。AGS细胞组采用巨噬细胞与AGS细胞共培养于Transwell小室的方案,对照组去除下室的AGS细胞,采用相同的培养基。随后进行RT-PCR实验检测共培养体系中巨噬细胞内两种lncRNA的表达水平。结果表明,共培养的巨噬细胞内lncRNA Hotair水平高于对照组,而lncRNA PICSAR与对照组之间差异无统计学意义(表3)。随后的原位杂交实验结果表明,胃癌组织中的CD206阳性巨噬细胞与Hotair有较强相关性,其中红色为CD206,绿色为Hotair定位,两者能够共定位(图2)。
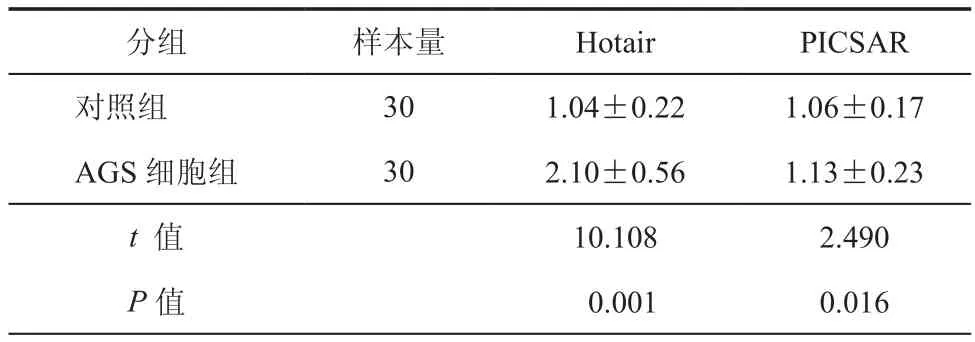
表3 巨噬细胞两种lncRNA相对水平检测
三、长链非编码RNA Hotair将巨噬细胞转变为癌支持细胞
首先检测了转染Hotair质粒的Hotair过表达组或转染Hotair siRNA的RNA干扰组中AGS细胞Hotair相对含量,Hotair过表达组的Hotair相对含量为0.78±0.12,高于对照组的0.39±0.06(P< 0.05),而 RNA 干 扰 组 的 Hotair含 量 降 低(0.14±0.02,P< 0.01),表明转染成功。随后使用流式细胞仪对各组AGS细胞共培养体系中的巨噬细胞表型进行检测,结果表明,相对于对照组,Hotair过表达组中含有更多的CD206阳性细胞,而RNA干扰组CD86阳性细胞更多(图3,表4)。
随后,巨噬细胞分别转染Hotair质粒或Hotair siRNA后与AGS细胞共培养,Transwell上室包被了Matrigel,以验证AGS细胞的侵袭能力和增殖能力。实验结果表明,Hotair过表达组视野内侵袭到下室的细胞数量为(326.90±34.62)个,高于对照组(174.81±24.24)个,(P< 0.01),而 RNA 干扰组细胞侵袭数量为(126.78±21.85)个,相比对照组差异具有统计学意义(P< 0.01,表4)。转染了Hotair质粒的细胞增殖能力显著高于未转染的对照组;相反,转染siRNA之后细胞增殖能力则显著降低(P<0.01,表4)。
讨 论
中国是胃癌的高发国家,且大部分患者诊断时已为进展期胃癌,死亡率较高。胃癌早期症状不明显,因此寻找胃癌的特异性诊断标志物并探究其机制对于胃癌的治疗、诊断具有重要意义[9]。

图3 Hotair将巨噬细胞转变为癌支持细胞

表4 各组流式细胞各表型细胞比例、450 nm吸光度与侵袭细胞数量
局部微环境对于肿瘤的发展与转移有重要作用,肿瘤细胞通过多种方式改变周围环境从而有利于自身发展[10]。肿瘤相关巨噬细胞近些年受到关注,巨噬细胞原本为促炎M1表型,但肿瘤中的巨噬细胞在肿瘤细胞作用下转变为抗炎M2表型的癌支持细胞,从而有利于肿瘤的增殖[11]。长链非编码RNA是肿瘤细胞影响周围环境的重要方式之一,本研究假设胃癌细胞可能通过lncRNA作用于巨噬细胞从而改变其表型。
首先,本研究通过共培养实验,验证了巨噬细胞会在AGS细胞作用下,由CD86促炎型细胞转变为CD206抗炎细胞,ELISA实验也表明,与共培养AGS细胞共培养组的巨噬细胞分泌更少的促炎因子,更多的抗炎因子,进一步证明巨噬细胞的表型转换。为了选出起到这一作用的关键lncRNA,首先从GEO数据库筛选出胃癌细胞与周围正常组织表达差异最大的两种lncRNA:Hotair与PICSAR。本研究测定共培养体系中巨噬细胞内两种lncRNA的含量,结果表明实验组中Hotair水平与对照组有显著差别,而PICSAR无显著差别,表明Hotair可能是起到这一关键作用的lncRNA。于是本研究对AGS进行Hotair转染与RNA干扰实验,证明了敲低Hotair水平会抑制巨噬细胞的表型转换,Hotair转染则相反。对临床样本进行的共定位实验也表明,Hotair与CD206阳性细胞密切相关。为了验证表型转换之后的巨噬细胞对AGS细胞功能的影响,在巨噬细胞被转染Hotair或HotairsiRNA后与AGS细胞进行共培养,结果表明Hotair组的AGS细胞增殖与侵袭能力显著增强,HotairssiRNA组则正好相反。
总而言之,本研究证明了胃癌细胞通过lncRNAHotair促进肿瘤微环境中的炎性巨噬细胞转变为抗炎癌支持细胞,从而促进胃癌的增殖与转移,为胃癌治疗提供了可能的新靶点。
