芍药苷对人上皮性卵巢癌HO8910细胞增殖、凋亡及迁移的影响及其机制研究
2019-05-15高天勤李欣董圣军程春雷史荣军贾龙王健刘宝辉
高天勤,李欣,董圣军,程春雷,史荣军,贾龙,王健,刘宝辉
(1.滨州医学院附属医院,山东 滨州 256603;2.滨州市人民医院,山东 滨州 255610;3.山东省食品药品检验研究院,山东 济南 250101;4.阳信县人民医院,山东 阳信 251800)
卵巢癌是女性生殖系统常见的恶性肿瘤之一,病死率高居妇科恶性肿瘤的首位[1]。卵巢癌对化疗药物的耐药及癌细胞自身较强的迁徙能力是导致化疗失败的主要原因,迄今为止,尚无理想的药物应用于临床克服肿瘤耐药性。近年来,传统中药因来源广泛、副作用少、病人安全应用历史长及缺乏耐药性等优点越来越受到关注。其中大量研究发现,芍药苷(paeoniflorin,PF)对多种肿瘤细胞存在抑制作用[2-3],但PF对卵巢癌细胞的影响却鲜有报道。为了观察PF是否具有抗卵巢癌的作用,本实验组通过观察PF对人上皮性卵巢癌HO8910增殖、凋亡及迁移能力的作用,并对可能的作用机制进行初步探讨。
1 材料与方法
1.1 实验材料及仪器 人上皮性卵巢癌HO8910细胞由滨州医学院中心实验室提供。芍药苷购于中国食品药品检定研究院;4′,6-二脒基-2-苯基吲哚(DAPI)、噻唑蓝(MTT)购于美国Sigma-Aldrich公司;鼠源抗人凋亡蛋白caspase-3、β-actin、B 淋巴细胞/白血病-2(Bcl-2)抗体及核因子-κB(NF-κB) p56抗体均购自美国Cell Signaling公司;原位末端转移酶标记(TUNEL)检测试剂盒购买于美国Santa Cruz公司;辣根过氧化物酶标记羊抗鼠IgG 购买于中杉金桥生物技术有限公司;二喹啉甲酸 (BCA)×100蛋白质定量测定试剂盒、组织裂解蛋白提取液、蛋白酶抑制剂均购买于上海碧云天生物技术公司;酶标仪为美国Biotech公司产品;CO2细胞培养箱为美国Thermo公司产品;荧光显微镜是日本Olympus公司产品;电泳、湿转移槽及Western blot发光照相系统为自美国Rio-Red公司产品。
1.2 细胞培养及分组 人上皮性卵巢癌HO8910细胞用10%胎牛血清的DMEM细胞培养液于37 ℃,5%CO2的细胞培养箱内常规培养,每 1~2 d更换培养液 1 次。根据预实验及参考文献设置低、中、高PF剂量组与对照组。其中,二甲基亚砜(DMSO,0.01%)作用于对照组。PF低、中、高剂量组分别在加入0.5、1与2 mg·mL-1PF的DMEM培养液中培养48 h,PF用DMSO预溶,并用DMEM培养液稀释至相应浓度。
1.3 MTT 法测细胞增殖率 将HO8910细胞接种于96孔板,待细胞贴壁后实验组加入含终浓度分别为0.5、1与2 mg·mL-1PF的DMEM培养液。每组设6个复孔,在37 ℃,5%CO2的细胞培养箱内常规培养48 h后,弃细胞培养液,冲洗后加入MTT的培养液(10 μL),4 h后弃上清溶液并加入DMSO。震荡10 min后用酶标仪于490 nm波长处测定吸光度(A)值,并重复上述实验3次。
增殖抑制率=(对照组OD值-各组实验组OD值/对照组OD值-空白组OD值)×100%。
1.4 TUNEL法检测细胞的凋亡率 将上述对照组及各芍药苷剂量组干预后的细胞用4%的多聚甲醛固定1 h后,根据该实验试剂盒所述的双重染色法,TUNEL检测液可将凋亡细胞的细胞核染呈绿色。DAPI可将所有细胞的细胞核染成蓝色。每组细胞随即在荧光显微镜下选择6个视野并观察计数。计算HO8910细胞凋亡率。
1.5 细胞划痕实验细胞迁移率 用细胞划痕实验检测HO8910细胞迁移:实验步骤依据参考文献[4]。将混匀的血管内皮细胞以5×105均匀种于6孔板内,并铺满整个孔板。各组给予上述相应处理后,以P200移液器枪头垂至于6孔板划出3条平行的“损伤”。用PBS洗细胞3次,去处划下的细胞,加入5%胎牛血清培养基后,放入37 ℃,5% CO2培养箱培养8 h。运用倒置相差显微镜(Olympus BX61)对迁移的各组细胞进行拍照,并计算出划痕上下界限之间距离的平均值。将对照组的设定为100%。
1.6 Western blot法检测 细胞内caspase-3、Bcl-2、NF-κB p56蛋白表达水平HO8910细胞的前期培养与干预方案同上。各组细胞处理48 h后通过裂解提取蛋白,并根据BCA蛋白定量方法所得结果加入各组蛋白样品。依次通过电泳、转膜、封闭,然后分别滴加抗NF-κB p56、 Bcl-2、caspase-3和β-actin抗体(1∶1 000稀释),4 ℃过夜,清膜、孵育对应二抗后,再次洗膜后用配置新鲜发光液进行曝光显影,Bio-Rad照相系统进行照相并用其附带的软件分析蛋白的相对表达量。

2 结果
2.1 各组细胞增殖抑制率、凋亡率及迁移率比较各组细胞处理之后,MTT法测定各组细胞增殖率;TUNEL染色法测定各组细胞的凋亡率;细胞划痕法测定各组细胞迁移率。其数据统计如表1所示,与对照组相比,PF中剂量组、PF中剂量组细胞增殖率、迁移率明显降低,而凋亡率明显升高(P<0.05,P<0.01),并且随PF浓度的增加而效果明显。

表1 各组细胞增殖率、凋亡率及迁移率比较
注:与对照组比较,*P<0.05,**P<0.01;与PF中剂量组比较,#P<0.05
2.2 各组细胞内caspase-3、Bcl-2、NF-κB p56蛋白表达比较PF中剂量组、PF中剂量组细胞内caspase-3表达水平较对照组明显升高(P<0.05),Bcl-2、NF-κB p56表达水平较对照组明显降低(P<0.05),且呈现剂量依赖性(P<0.05,P<0.01),并且随PF浓度的增加而效果明显,结果见表2。
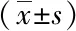
表2 各组细胞caspase-3、Bcl-2、NF-κB p56表达比较
注:与对照组比较,*P<0.05,**P<0.01;与PF中剂量组比较,#P<0.05
3 讨论
卵巢癌恶性程度高,侵袭转移能力强,早期临床症状隐匿不易诊断,治疗效果及预后较差[1,5]。虽然目前对卵巢癌的诊疗取得了一定的进展,但患者的5年死亡率仍维持在25%~30%左右[6]。目前临床上用于治疗卵巢癌的药物不良反应大,且易产生耐药性[7]。因此,新药的研发对改善卵巢癌的治疗形成尤为重要。
芍药苷是白芍的主要有效成分,它具有抗炎、免疫调节、保肝、调节免疫等多方面功效[8-9]。但近几年研究显示,芍药苷还对部分肿瘤有抑制作用,如胰腺癌、胃癌、黑色素瘤等[2-3,10]。它可以抑制这些肿瘤细胞的增殖并诱导其死亡。但芍药苷在卵巢癌的增殖、迁移情况的作用确未有报道。本实验中,通过细胞增殖实验主要证实芍药苷对人上皮性卵巢癌HO8910细胞的增殖、迁移能力的抑制作用。实验中应用不同浓度的(0.5、1与2 mg·mL-1)芍药苷处理后发现,芍药苷可剂量依赖的抑制HO8910细胞增殖、迁移,促进HO8910细胞的凋亡。
绝大多数化疗药物杀伤肿瘤细胞是通过诱导细胞凋亡来实现的,但化疗药物诱导凋亡的同时也会诱导相应肿瘤细胞产生耐药性,这是肿瘤化疗失败的主要原因之一。其中被化疗药物所激活的NF-κB是肿瘤细胞获得耐药的重要机制之一[11]。研究发现NF-κB一旦激活后即从细胞质内转入胞核中调控抗凋亡因子Bcl-2家族、MDR等蛋白的表达[12],抑制caspase凋亡家族的表达[13],参与肿瘤细胞的增值与迁移。本实验中再次验证了芍药苷可使NF-κB蛋白表达水平明显降低。本实验亦发现芍药苷可明显抑制抗凋亡蛋白Bcl-2表达,上调凋亡蛋白caspase-3的表达。结合 MTT及凋亡检测结果,可见伴随着对 NF-κB活性的抑制增强,卵巢癌HO8910细胞增殖抑制率及凋亡率也随之增加,迁移率明显降低。
综上,芍药苷具有抑制人上皮性卵巢HO8910细胞增殖、迁移,并促进其凋亡的作用。其作用机制可能通过NF-κB信号通路以上调凋亡蛋白caspase-3,下调抗凋亡蛋白Bcl-2进而诱导HO8910细胞凋亡,但具体的作用机制需要进一步证实。
