TiN涂覆的 Ti-6Al-4V注入Cu2+ 后的抑菌性与细胞相容性研究
2019-05-14褚珊珊万荣欣吕晓飞顾汉卿
褚珊珊 万荣欣 吕晓飞 顾汉卿* 彭 诚
1(天津医科大学第二医院,天津 300211)2(天津医科大学天津市泌尿外科研究所,天津 300211)
引言
钛及钛合金因具有良好的生物相容性、优越的综合力学性能、耐腐蚀性能、机械加工性能,是当今主要的口腔和骨科植入材料[1-2]。钛及钛合金具有良好的生物相容性,但不具有抑菌性[2]。虽然正规植入操作在无菌条件下进行,但仍出现大量因植体周围细菌黏附,使周围组织感染而导致植入失败的情况。因此,赋予植体材料一定的抑菌性已经成为临床亟待解决的科学问题。
钛合金本身耐磨性较差,在人体内如果长期磨损,会产生大量金属粒子,使身体现出不良反应[3]。而TiN涂层具有优良的耐摩擦性能、韧性以及高硬度等特点[4],可弥补钛合金的不足。
近年来,常用的表面定植抑菌剂的方法有:MEVVA离子注入、溶胶-凝胶法、物理气相沉积、电镀/化学镀等[5]。本研究在TiN修饰的钛合金表面再注入Cu,以期提高钛合金耐磨性、韧性、硬度,防止V离子过量释放导致的不良反应,同时使其具有一定的抑菌性。离子注入是风险控制最好的一种的方法,在真空中、低温下把注入离子加速,离子获得很大动能后即可直接进入材料表面中。当然,这也会在材料表面产生一些晶格缺陷,因此在离子注入后需用低温退火或激光退火来消除这些缺陷。注入的离子浓度分布一般呈现为高斯分布,并且浓度最大处不是在表面,而是在表面以内的一定深度处;优点是能精确控制杂质的总剂量、深度分布和面均匀性,而且是低温工艺(可防止原来杂质的再扩散等),同时可实现自对准技术(以减小电容效应)。其中,MEVVA离子是通过金属蒸汽真空弧离子源进行注入。采用这种方法,使注入粒子与基底结合紧密,注入物不易脱落[6];使离子释放缓慢而持久,赋予了材料长久而稳定的抑菌性能。
Ag+具有良好抑菌性[7]与生物相容性[8],因此被广泛应用于医疗材料领域。本课题组之前的研究表明:在TiN涂覆的Ti-6Al-4V表面离子注入Ag+后,可赋予其良好的机械性能、细胞黏附力与抑菌性能。但Ag+并非人体必需元素,且其生物安全性越来越受到人们关注,因此需要探索其他的具有良好细胞相容性及抑菌性的元素,比如Cu。研究表明,Cu2+符合上述要求[9-11],是一种较好的可用于提高材料表面抑菌性能的表面改性材料。基于上述考虑,在TiN涂覆的Ti-6Al-4V表面上注入一定量的铜,与银相比较,考察Cu2+注入表面的初步细胞相容性和抗菌性。
1 方法
1.1 实验材料
Ti-6Al-4V片,直径10 mm,厚度2 mm。
试剂和仪器: HyClone 1640培养基、胎牛血清(BI,以色列),青链霉素混合液、LB细菌培养基(天津索罗门生物科技有限公司),0.25%胰蛋白酶、曲拉通X-100、40 g/L多聚甲醛(Sigma,美国),罗丹明-罗丹明-鬼笔环肽(上海翊圣生物科技有限公司),Heochest33342染色液(碧云天),抗荧光衰减封固剂(博士德生物工程有限公司),Live-or-DieTM Viability Cytotoxicity Kit for Bacteria Cells(Gene Copoeia,美国),CCK-8试剂盒(日本,同仁),无水乙醇,PBS(BI,以色列),国产MEVVA-360型离子注入机,激光共聚焦显微镜(Olympus F10-SHAUIX,日本)、SUPRA 55VP扫描电镜(ZEISS,德国),ZXJP-A1150 CO2细胞培养箱(上海智城分析仪器制造有限公司),X射线电子能谱分析仪-725(瓦里安,美国),SCIENTZ-10 N冻干机(宁波新芝生物科技股份有限公司),-80℃冰箱(Thermo,美国),低速台式离心机(湘仪 L-530),多功能酶标仪(天津志卓生物科技有限公司)。
细胞与细菌:L929细胞系(中国科学院细胞库,上海),金黄色葡萄球菌(天津师范大学生命科学学院中心实验室)。
1.2 实验过程
1.2.1样本的制备
制备TiN涂覆的Ti-6Al-4V表面注Cu样品和TiN涂覆的Ti-6Al-4V表面注Ag样品。伴随着离子的沉积,各部分参数设置如下:工作气压0.5~0.8 Pa,固定直流偏压为50 V,脉冲偏压为-150 V,占空比为30%,其中Ar2与N2的气压分压比为1∶5,沉积时间为35 min。
首先将光滑的Ti-6Al-4V基底材料分别浸泡在乙醇和丙酮溶液中交替清洗,每种溶液15 min,吹风机吹干后置于空旷处,放入镀膜机的腔室内,其靶基距约为30 cm。处于工作状态后,当真空室的本底真空度达到5×10-3Pa时,通入氩气至5 Pa,调节直流偏压为200 V,脉冲偏压为-600 V,占空比为60%,对样品进行辉光清洗15 min。之后调节气压至0.5 Pa,镀TiN时,通入氩气与氮气的体积比为1∶5,根据设置的偏压进行镀膜。然后,采用MEVVA金属蒸气真空弧离子源注入机进行离子注入,注入剂量为5.0×1017ions/cm2的离子,注入加速电压为40 kV,束流密度为2 μA/cm。
1.2.2样本的影响
1)L929细胞的培养。将L929细胞培养于HyClone 1640培养基中(含1%抗生素、体积分数10%的灭活胎牛血清),放置于37℃、体积分数5% CO2饱和湿度的恒温培养基中,两天后进行1次换液,当细胞达到90%以上时融合后进行传代。
2)细胞接种。取钛合金组、TiN组、注Ag组、注Cu组各4片,分装在24孔板中。L929细胞培养3代后,当细胞生长到对数期时进行细胞计数,以每孔2×104/well接种到各组片上,置于37℃、体积分数5%的CO2饱和湿度培养箱中孵育24 h。
3)罗丹明-鬼笔环肽染色。细胞接种24 h后,彻底吸掉培养基,用37℃预热的1×PBS(pH值7.4)清洗3次,每次5 min。40 g/L多聚甲醛溶液固定细胞15 min,用PBS清洗细胞3次,每次10 min。用0.5%的TritonX-100溶液通透化处理5 min。取配置好的罗丹明-鬼笔环肽工作液,用移液枪滴加到各组钛合金组片上表面,每孔200 μL,然后每孔滴加800 μL BSA封闭液进行封闭,室温避光孵育30 min。PBS清洗3次,每次5 min。室温下用配置好的Heochest33342细胞核染色,每孔加入500 μL,室温下避光孵育30 min,PBS浸洗5 min。用抗荧光衰减封固剂进行封固,在激光共聚焦显微镜下观察各组片表面细胞的骨架及黏附铺展状态[11]。
4)注Cu组、注Ag组对L929细胞生长形态的影响。细胞接种、固定、脱水、冻干:取钛合金组、TiN组、注Ag组、注Cu组各4片,分装在24孔板中。细胞培养,接种如上。PBS浸洗3次,每次10 min。将PBS清洗后的样品转移至新的24孔板中。在4℃用2.5%戊二醛浸泡各组片4 h,PBS清洗3次,每次10 min。用梯度酒精(30,50,70,80,90,100V/V%)脱水,每种浓度脱水10 min,最后再用100%的乙醇脱水两遍;在-80℃条件下冷冻3 h,然后放入冷冻干燥机(SCIENTZ-10 N)抽真空20 h[12]。样品表面喷金,扫描电镜通过观察伪足伸展,判断样品表面细胞的铺展状况。
5)注Cu组、注Ag组对L929细胞增殖影响。细胞接种:将处于对数生长期的L929细胞用0.25%胰蛋白酶消化下来,用HyClone1640培养基(含体积分数10%血清,1%双抗)配置成细胞悬液,以每孔5×103/well分别接种到钛合金组、TiN组、注银组、注铜组的样片表面,每组设置4个平行样,然后将培养板放到孵育箱中孵育。
细胞增殖检测:1、3、5 d后,吸除液体。每孔内滴加500 μL含有10%CCK-8的配置好的工作液,置于细胞培养箱内培养2 h。每孔用移液枪抽取100 μL加入96孔板中,用多功能酶标仪在450 nm波长下检测OD值[13]。记录各孔的吸光度值,计算后画制细胞增殖状况图。
1.2.3抑菌性检测
1)实验菌株的培养。将冷冻复苏的金黄色葡萄菌株接种于LB琼脂板上,在37℃需氧状态下培养24 h,涂片染色,形态学观察为纯培养物后,若无其他杂质则作为备用。
2)菌液和LB琼脂板的准备。用接种环将培养平皿上的金葡菌转移到10 mL的LB液体培养基中,用加样枪充分吹打混匀后,取2 mL细菌悬液进行比浊,根据结果将剩余金黄色葡菌浓度调整至3×107CFU/mL。液体LB培养基加入适量琼脂,放入灭菌蒸锅中灭菌,待冷却到65℃左右时倒入平皿中,封口备用。
3)细菌接种。取钛合金组、TiN组、注Ag组、注Cu组片各4片,置于24孔板中。每片样品表面用移液枪滴加100 μL配置好浓度菌液,在24孔板孔周围间隙滴入PBS,封口膜封口后置于细菌培养箱中培养24 h。
4)活菌铺板计数检测。用PBS清洗样品片3次,每次10 min。将样品转移至15 mL的无菌离心管中,每个离心管中装入10 mL的PBS。放在SB25-12DT超声波清洗机中震荡15 min,再每管吸取100 μL液体滴于LB琼脂培养板上,用一次性涂布棒涂布均匀后置于细菌培养箱中,培养24 h后观察计数,并根据公式计算相对抑菌率,有
相对抑菌率(Ra)=

5)激光共聚焦检测抑菌性。用PBS清洗样品片3次,每次10 min。每孔中加入500 μL配置好的细菌活死染液,室温避光孵育15 min。每片样品上滴加20 μL抗荧光衰减封片剂,用原型盖玻片盖在样品片上。在激光共聚焦显微镜下,观察细菌活死状态[13]。
6)扫描电镜检测抑菌性。用PBS清洗样品片3次,每次10 min。4%的多聚甲醛固定15 min后,再酒精梯度脱水;在-80℃条件下冷冻3 h,然后放入冷冻干燥机(SCIENTZ-10 N)抽真空20 h。样品表面喷金,SEM观察样品表面细菌形态及生长黏附。
陈主任不慌不忙地从烟盒里抽出一支烟,再慢条斯理地点上。打火机窜出的火苗在他讳莫如深的镜片里绽放出两个小小的亮点。
1.3 观察指标
1)接种24 h后,4组片表面L929细胞的形态,以及黏附铺展和生长情况;
2)接种1、3、5 d后,4组片表面L929细胞的增殖情况;
3)抑菌实验中,与细菌接触24 h后,4组片表面的细菌形态,以及生长和黏附情况。
1.4 统计学分析
所有数据均以平均值±标准差来表示,采用Graphpad Prism 7软件处理,多组间比较采用单因素方差分析,P<0.05为差异有显著性意义。
2 结果
2.1 XPS图谱
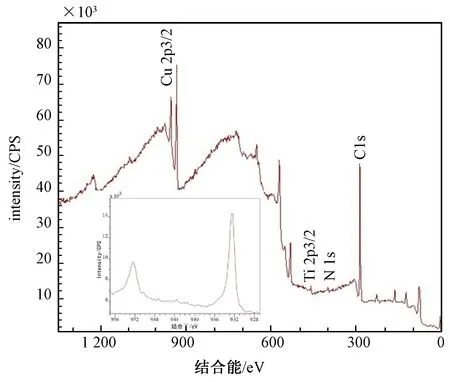
图1 注Cu组的XPS图谱Fig.1 XPS wide spectra of the surface of the Cu group

图2 注Ag组的XPS图谱Fig.2 XPS wide spectra of the surface of the Ag group
根据XPS图谱,可以分析材料的成分结构、分布等。如图1、2所示,材料经过TiN磁控溅射改性后表面观测的峰位,主要有 N1s、Ti2p3/2。N1s的峰位在399.60 eV,表明改性层中形成了TiN硬质相。由图1可见,材料在TiN涂层基础上经过Cu2+注入改性后,表面观测峰位有Cu2p3/2。由图2可见,材料在TiN涂层基础上经过Ag+注入改性后,表面观测峰位有Ag3d5/2。这些峰位的出现,表明在钛合金表面的TiN表面成功地注入了Cu和Ag,且注入效果较好。Cu2p3/2的相对原子比是7.35%,Ag3d5/2的相对原子比是7.6%。
2.2 离子析出浓度
将各组样品浸入PBS中,分别在7、14、21和28 d时,通过ICP-MS技术,分别检测注Cu组和注Ag组的Cu2+和Ag+释放的浓度。由表1可见,Cu第28d的离子析出浓度是(0.014±0.000 5) mg/L,析出浓度低。
2.3 接触角比较
由图3可见,钛合金组的接触角是89.74°±0.03°,TiN组的接触角是87.24°±0.03°,注Cu组的接触角是75.54°±0.02°,注Ag组的接触角是86.01°±0.02°。可见,注Cu组和注Ag组相对于对照组的接触角减小,亲水性增加。这说明,注Cu和注Ag后,材料表面的亲水性增大,利于材料表面的细胞黏附。

表1 注Cu组和注Ag组的离子析出浓度Tab.1 The concentration of ion released from the Cu group and the Ag group mg/L

图3 接触角。(a)注Cu;(b)注Ag组;(c)TiN组;(d)钛合金组Fig.3 The contact angle.(a)the Cu group;(b)the Ag group;(c)the TiN group;(d)the titanium alloy group
2.4 显微镜观察
由图4可见:钛合金组、TiN组细胞分布均匀而密集,细胞呈多角形,可观察到大量丝状伪足,相互交织,呈网状,细胞核形态正常,核染均匀;注Cu组和注Ag组细胞相对前两组的数量稍有下降,绝大部分细胞铺展充分,只有极少数细胞呈梭形,说明Cu2+和Ag+的注入未对TiN涂覆的钛合金表面的细胞相容性产生明显的影响。
2.5 扫描电镜观察
如图5所示,罗丹明-鬼笔环肽染色后L929细胞黏附铺展:钛合金组、TiN组细胞铺展充分,与材料表面黏附紧密,可见大量板状伪足与丝状伪足,使细胞间相互交织,F-肌动蛋白大量表达;注Ag组和注Cu组除极个别细胞呈梭形外,其他细胞均呈现多角型,丝状伪足相互交织,黏附铺展得较为充分均匀。这与激光共聚焦显微镜下观察到的结果一致。
2.6 细胞增殖检测
从图6可以看出,4组材料在同一时间点的细胞活力,除了TiN组的略高外,其余各组材料表面的L929细胞生长活力按照如下趋势排列:TiN组>钛合金组>注Cu组>注Ag组,P>0.05,无统计学差异。研究表明,钛合金组、TiN组的材料均不具有细胞毒性,所以注Cu组和注Ag组也无明显的细胞毒性。

图4 激光扫描共聚焦显微镜观察各组样品表面的L929细胞骨架(罗丹明-罗丹明-鬼笔环肽染色)。(a)钛合金组;(b)TiN组;(c)注Cu组;(d)注Ag组Fig.4 Confocal laser scanning microscope images of L929 cytoskeleton on different sample surfaces (rhodamine-phalloidine staining).(a)the titanium alloy;(b)the TiN group;(c)the Cu group;(d)the Ag group

图5 扫描电镜观察各组钛片表面MC3T3-E1细胞形态。(a)注Cu组;(b)注Ag组;(c)TiN组;(d)钛合金组Fig.5 Scanning electron microscope images of cellular morphology of L929 cells on different sample surfaces.(a)the Cu group;(b)the Ag group(c)the TiN group;(d)the titanium alloy group

图6 L929细胞增殖情况Fig.6 The proliferation of L929 cells
2.7 活菌铺板计数
根据活菌铺板观察结果(见图7)以及据此做出的抑菌率柱状图(见图8)可看到,注Cu组和注Ag组活菌菌落少而分散,TiN组和钛合金组活菌菌落数较为密集,可知注Cu组和注Ag组具有较强抑菌性。注Cu组抑菌率是91%±2%,注Ag组抑菌率是87%±2%,P=0.006 9<0.05, 无统计学差异。
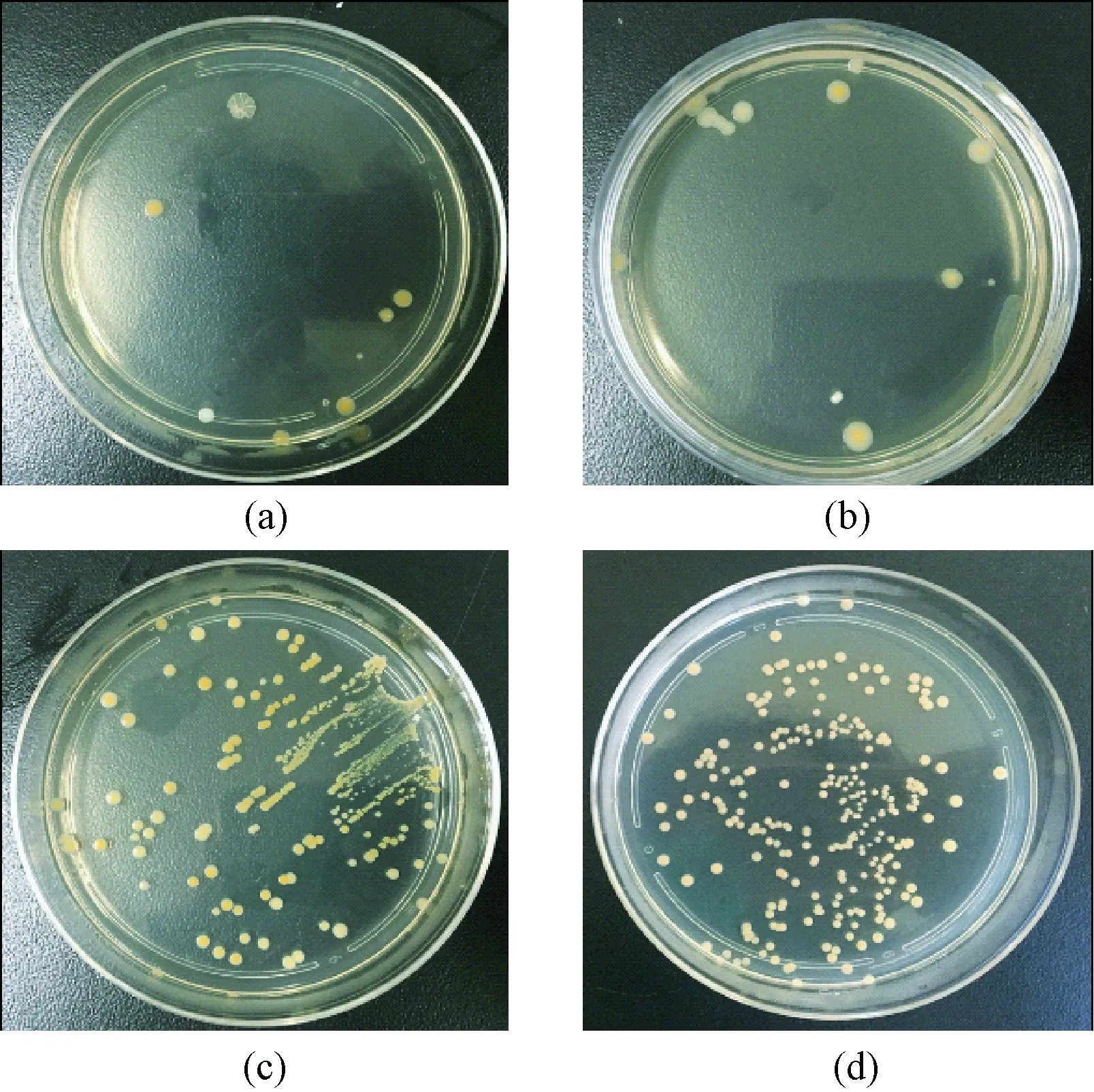
图7 金黄色葡萄球菌铺板结果。(a)注Cu组;(b)注Ag组;(c)TiN组;(d)钛合金组Fig.7 Staphylococus aureus colonies.(a)the Cu group;(b)the Ag group;(c)the TiN group;(d)the titanium alloy group

图8 抑菌率Fig.8 The antibacterial rates

图9 活死染色观察金黄色葡萄球菌在各组样品表面的状态。(a)注Cu;(b)注Ag组;(c)TiN组;(d)钛合金组Fig.9 Live/dead staining of Staphylococus aureus on different sample surfaces.(a)the Cu group;(b)the Ag group;(c)the TiN group;(d)the titanium alloy group
2.8 表面活菌情况
由图9可以看出:钛合金组和TiN组几乎全部被活菌覆盖,说明细菌生长活力好;注Ag组和注Cu组绿染部分少,证明细菌大量死亡,说明这两组具有良好的抑菌性。
2.9 葡萄球菌形态
由图10可见:钛合金组和TiN组金黄色葡萄球菌形态饱满,和正常情况下细菌形态一致,分布均匀,其中钛合金组密集层叠,TiN组细菌稍少;注Ag组和注Cu组细菌在材料表面大面积死亡,黏附少,细菌壁完整性被破坏,内容物流出,外形皱缩,说明这两组对其表面的金黄色葡萄球菌具有较为显著的破坏和抑制生长作用。

图10 扫描电镜观察各组样品表面金黄色葡萄球菌形态。(a)钛合金组;(b)TiN组;(c)注Cu组;(d)注Ag组Fig.10 Scanning electron microscope images of cellular morphology of Staphylococus aureus cells on different sample surfaces.(a)the titanium alloy;(b)the TiN group;(c)the Cu group;(d)the Ag group
3 讨论
医用钛合金具有优越的生物相容性,因其与骨相近的弹性模量以及较强的耐腐蚀性能,成为近年来被广泛使用的口腔与骨科植入物的材料。但是,植入物与人体接触后,其表面因为不具有一定的抑菌性,容易黏附细菌进而形成生物膜,一旦形成则抗生素等治疗手段不易穿透,无法有效杀灭细菌,从而导致种植体周围炎症的发生[14]。植入物感染会导致植入失败,严重的会导致全身感染甚至危及生命,局部感染需要彻底处理感染后再重新植入。
口腔与骨科的植入在严格的无菌环境下操作,但依然无法避免细菌定植与感染发生,因此只能通过植入物表面改性赋予其抑菌性能。研究表明,Ag+是一种广谱有效的抑菌物,但其生物安全性近来受到一些质疑,Cu能否因其良好的抑菌性与细胞相容性逐渐取代Ag,仍需进一步研究。同时,Cu是人体必需的微量元素,参与细胞代谢和催化作用等生理功能。WHO建议,成人每日Cu的上限摄入量为2~3 mg[15],生活用水标准中Cu的上限为1 mg/L,远大于Ag的0.05 mg/L。
文献[16]和本实验接触角的检测结果表明,与对照组相比,注Ag组和注Cu组小,亲水性好,早期促进细胞黏附。结合细胞增殖和毒性实验可得出结论:实验组Cu2+析出对人体无毒性,能促进细胞早期黏附,并且具有良好的抑菌性。综上所述,Cu2+可被用作材料表面改性来提高抑菌性。
Cu的抑菌机制目前尚未明确,主要的杀菌理论是接触抑菌[17]以及离子析出抑菌。根据ICP-MS的结果可看出,本实验中Cu第28 d的离子析出量是(0.014±0.000 5)mg/L,远小于文献中[18]提到的Cu2+离子析出量400 mg/L。所以注Cu组的主要抑菌机制是接触抑菌。另外,该数值也远低于生活用水标准中Cu的上限值1 mg/L。接触抑菌的原理是:从金属Cu表面溶出,造成细菌损伤;细菌的细胞膜破裂,因为Cu和其他压力的影响,导致膜电位的损失和细胞胞质外泄;Cu2+诱导活性氧生成,进一步导致细菌结构遭到损伤;细菌全基因组 DNA 和质粒发生降解[17]。
因植体需长期与人体组织接触,所以需要具备稳定而持久的抑菌性。传统的镀膜技术与基底合力较差,而采用MEVVA离子注入技术注入的粒子与基底的结合力大,即金属颗粒与TiN层结合紧密,不易脱落,可持久释放离子,发挥抑菌作用。
4 结论
在TiN涂覆的钛合金表面注入一定剂量的Cu2+后,会具有良好的细胞相容性和抑菌性,因此Cu有可能作为具备抑菌性的口腔与骨科植入物表面改性的Ag+的替代物被进一步研究。
(致谢:感谢天津师范大学李丽和龚焕焕同学给予的大力帮助和技术支持)
