可手术周围型非小细胞肺癌192铱源大分割立体后装放射消融术新辅助治疗的效果评价
2019-05-07石翔翔庞皓文孙小杨任培蓉吴敬波林盛
石翔翔,庞皓文,孙小杨,任培蓉,吴敬波,林盛,2
0 引言
肺癌是全球范围内发病率和死亡率最高的恶性肿瘤,其中非小细胞肺癌(non-small cell lung cancer, NSCLC)约占肺癌总数的80%~85%[1-2]。对于早期NSCLC,外科手术依然是治疗的主要手段。虽然近年来外科手术技术的进步使围手术期并发症大大降低,但是行单纯外科手术切除的早期NSCLC患者的术后5年生存率仍为20%~35%[3]。因此目前国内外治疗指南均推荐采用手术联合化疗、放疗等多学科治疗模式,基本治疗策略逐渐过渡到根治性同步放化疗或新辅助治疗后再行根治性手术等综合治疗方案[4]。使用新辅助放疗理论上能够相对安全地降低肿瘤边缘阳性、缩小肿瘤、提高手术的可切除性、减小手术期间肿瘤细胞的种植传播的可能性[5]。立体后装放射消融术(stereotactic ablative brachytherapy, SABT)所提供单次大剂量的辐射能量,使肿瘤细胞更易出现致死性损伤,在杀灭肿瘤后可以引发肿瘤相关抗原表达,破坏局部炎性反应微环境,刺激效应T细胞复能,重塑细胞免疫,对区域或远处转移瘤形成远位抑瘤效应[6-11]。
本试验旨在检验小样本量的可手术非小细胞肺癌患者中使用SABT新辅助疗法的安全性;通过比较SABT前后正电子发射断层扫描(positron emission tomography, PET/CT)和动态灌注CT(dynamic contrast-enhanced computer tomography,DCECT)得到的肿瘤区体积(volume of gross tumor volume, VGTV)、最大标准摄取值(maximum standardized uptake value, SUVmax)、肿瘤血容量(tumour blood volume, TBV)和肿瘤血流量(tumour blood flow, TBF)评价新辅助治疗效果。
1 资料与方法
1.1 患者资料
该研究通过医院伦理委员会批准,招募接受SABT新辅助治疗的患者共13例,均签署知情同意书。入组要求为:>18岁,经活检病理确诊且在入选前被认为是可接受手术切除的周围型NSCLC患者(分期为Ⅰ、Ⅱ或ⅢA期),ECOG评分(Eastern Cooperative Oncology Group performance-status score)为0或1,器官功能正常,预期寿命>6月。排除标准:有严重的医学并发症,SABT或外科手术的其他禁忌证;经影像资料判断无法实施SABT(包括肿瘤邻近大血管、气道、食管等);有广泛的肺外侵犯如纵隔、心脏、大血管、气管、食管、椎体、隆突和恶性胸腔积液、心包积液等,具体资料见表1。
所有患者均接受肿瘤基线分期,包括治疗前活检、支气管镜或纵隔镜、PET/CT、胸部增强CT和头部磁共振成像等评估。患者接受SABT处方物理剂量为30 Gy,等效生物学剂量(biologically equivalent dose, BED)为120 Gy。
BED=D·(1+d/α/β)为应用于SABT中计算BED的公式,其中D为总物理剂量,d为单次物理剂量,肿瘤α/β值取10。
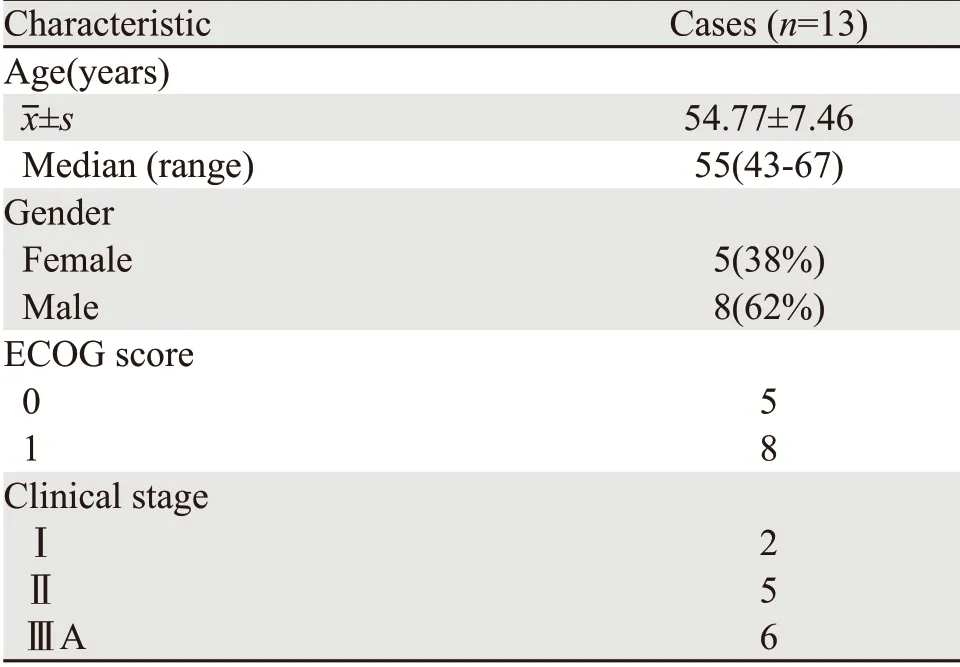
表1 接受SABT新辅助治疗入组患者的一般情况Table1 Baseline characteristics of patients who underwent neoadjuvant SABT
该剂量为后装放射消融治疗晚期肺癌临床试验(Chinese Clinical Trials Register No. ChiCTRONC-12002715)的评估结果[12]和相关文献[13-14]推荐的安全有效剂量,外科手术安排在SABT结束后4~6周。对有临床需要的部分患者,可提供术后常规辅助化疗或纵隔淋巴结局部外照射放疗。
1.2 SABT实施过程
使用共面模板辅助192铱源大分割SABT新辅助治疗,将192铱源通过插植针直接送达肿瘤病灶内部,由于其剂量分布遵循平方反比定律,可以使高剂量集中于肿瘤靶区(gross tumor volume,GTV),同时周围危及器官仅受到较低剂量的辐射。插植针能保证放射源在放疗过程中保持相对肿瘤无运动位移的状态,克服了呼吸动度对治疗的影响[15-16]。
在SABT术前需指导患者合理控制呼吸频率和幅度。采用CT-sim(LightSpeed Plus 4, General Electric Company, USA)模拟定位,机械臂引导共面模板覆盖肿瘤体表位置。嘱患者吸气末屏气后行增强扫描,将扫描图像传至Oncentra 4.3计划系统(microSelectron-HDR, Nucletron, Netherlands),与PET图像融合后由主管医师勾画GTV和危及器官(organ at risk, OAR)。由物理师制作模拟计划,插植针的具体植入数目和深度、192铱源驻留位置和驻留时间依据GTV实际情况进行优化,要求保障危及器官安全受量的前提下,给予肿瘤最大放射剂量,即让GTV D90(GTV体积90%所接受剂量)达到处方剂量,并且100%的GTV需要接受至少90%的处方剂量。再行消毒、铺巾和局部浸润麻醉,并在患者吸气末屏气后将插植针按术前计划的针道和深度植入,采用卡扣固定插植针,嘱患者吸气末屏气后行CT扫描,将呼吸运动对计划制作的影响降低。将扫描图像传至Oncentra计划系统进行实际计划制作,要求同模拟计划。经过主管医师审核批准后,将患者送入治疗室进行近距离放疗。放疗完成后立即将插植针取下,并对植针部位压迫包扎;再行CT胸部平扫检查,排除气胸或血胸等后,将患者送回病房观察至少24 h。
值得注意的是在SABT中,应时刻观察患者生命体征,若出现气胸、血胸等情况,应立刻终止操作,请胸外科医生对症专科处理;SABT结束后,如患者出现咯血、胸闷等不适情况,或已有症状加重,需再次CT扫描,排除迟发性出血、气胸的发生。
1.3 围手术期并发症评估
SABT围手术期并发症包括导致患者需要延长住院时间或紧急抢救治疗的病症(发生在SABT术中或术后1周内)。其中严重并发症包括重度气胸、血胸、严重咯血和血栓栓塞事件等;轻微并发症包括不需要任何医疗措施的轻度血痰、血胸、气胸等。
1.4 新辅助治疗效果评估
治疗前和SABT术后4~6周对患者分别行PET和DCECT扫描,并将两次的扫描结果进行比较,比较参数包括:VGTV、SUVmax、TBV和TBF。若SABT术后4~6周扫描的各项参数小于治疗前,且差异具有统计学意义,即被认为SABT新辅助有效。按照世界卫生组织通用的实体肿瘤疗效具体评价标准分为:(1)完全缓解(complete response, CR):CT扫描中肿瘤完全消失或PET扫描时FDG摄取不存在;(2)部分缓解(partial response, PR):病灶缩小≥50%;(3)微效(minor response, MR):病灶缩小≥25%~50%;(4)稳定(stable disease,SD):病灶缩小<25%或增大≤25%;(5)疾病进展(progressive disease, PD):病灶增大>25%。控制有效率定义为肿瘤减小≥50%(即CR+PR)。
1.5 统计学方法
持续监测患者在SABT围手术期出现的并发症和不良事件。呈正态分布的计量资料,采用SPSS20.0统计软件包和t检验处理数据。除非另有说明,否则实验数据表示为均值±标准差(±s),P<0.05为差异有统计学意义。
2 结果
2.1 SABT围手术期并发症
SABT术中,所有患者未出现呼吸困难、咯血或心悸等;SABT完成后的CT复查中,3例患者出现轻微并发症(其中痰中带有血液1例,未进行任何积极干预;少量气胸1例,自行恢复;肺内血肿1例,范围2 cm×3 cm,止血对症处理后血肿吸收),未出现重度气胸、血胸、咯血或任何其他严重并发症,见表2。SABT术后4~6周,所有患者未出现外科手术禁忌证,均能按计划如期进行外科手术。
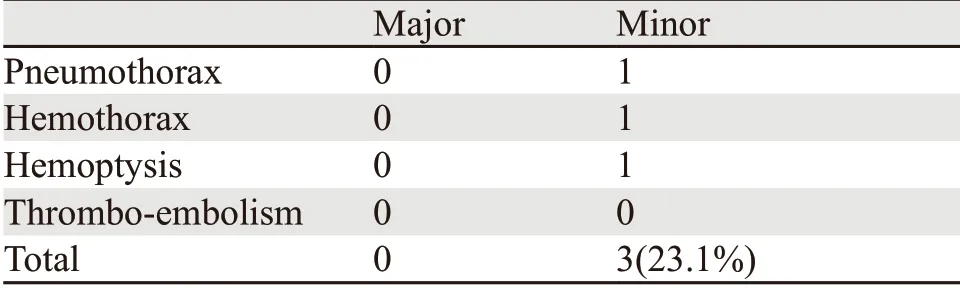
表2 SABT围手术期并发症 (n=13)Table2 Complications of SABT in perioperative period (n=13)
2.2 新辅助疗效
所有患者SABT术后4~6周平均VGTV为(9.76±4.14)cm3,明显小于治疗前的VGTV(16.55±7.37)cm3(t=5.111,P<0.001),其中CR 0例,PR 8例,MR 3例,SD 2例,控制有效率(CR+PR)为62% (8/13)。SABT术后SUVmax、TBF和TBV明显小于治疗前,见表3。图1中显示具代表性的一例患者其SABT新辅助治疗前后的影像学变化。
表3 GTV相关参数在SABT新辅助治疗前后的变化 (±s)Table3 VGTV, SUVmax, TBF and TBV before and after SABT (±s)
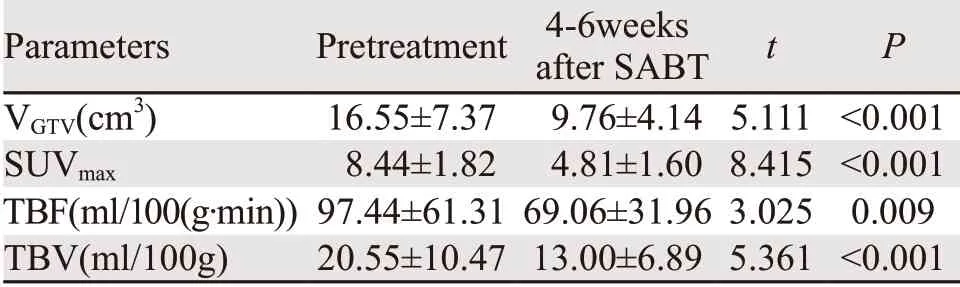
表3 GTV相关参数在SABT新辅助治疗前后的变化 (±s)Table3 VGTV, SUVmax, TBF and TBV before and after SABT (±s)
Parameters Pretreatment 4-6weeks after SABT t P VGTV(cm3) 16.55±7.37 9.76±4.14 5.111 <0.001 SUVmax 8.44±1.82 4.81±1.60 8.415 <0.001 TBF(ml/100(g·min)) 97.44±61.31 69.06±31.96 3.025 0.009 TBV(ml/100g) 20.55±10.47 13.00±6.89 5.361 <0.001
3 讨论
目前,新辅助放疗已成为一些恶性肿瘤(如直肠癌等)治疗的一部分,主要目标是降低局部复发风险、提高手术的可切除性[17]。SABT新辅助治疗是可手术的Ⅰ、Ⅱ和ⅢA期NSCLC患者在术前进行的局部放疗,可缩小肿块、杀灭转移细胞,以保证后续手术顺利开展。部分患者由于肿瘤负荷较重,单纯手术治疗难度较大,经过SABT新辅助治疗后可缩小瘤体,使更多不能手术切除的肿瘤变为可切除。Glover等[18]回顾性研究发现,与单纯手术相比,新辅助治疗并不增加患者的术中出血量、手术时间以及住院死亡率,并且围术期总并发症率没有明显差异。外照射放疗技术,包括先进的立体定向放射疗法(stereotactic body radiation therapy, SBRT),虽然能够为肿瘤区域提供足够的BED,但是对于部分GTV较大的患者难以实现GTV高剂量和OAR低剂量之间的平衡,而且呼吸动度可能导致脱靶漏照,降低治疗效果。有研究认为近距离放射治疗目前已经发展成为不可手术NSCLC的一种安全有效地治疗方式[15,19],然而这些研究只是根据治疗后影像学评估,其真正病理完全缓解率(pathologic complete response rate, pCR)未知,而且患者放疗后的放射性肺损伤,可能影响对局部复发检测的影像学判断。而将近距离放射治疗作为可手术早期NSCLC患者的新辅助治疗手段未见报道。本试验的目的不仅是评估SABT联合手术切除后的临床疗效和毒性,而且可以通过手术标本病理结果确定SABT后的pCR。我们通过小样本量的队列研究证明了SABT作为可手术NSCLC患者新辅助治疗手段的安全性和可行性,并且通过影像学评估SABT的治疗效果。
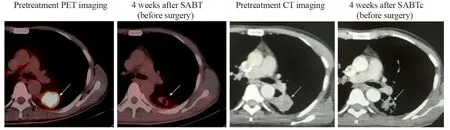
图1 患者在SBAT新辅助治疗前后肺部原发灶的影像学对比Figure1 Patterns of radiologic response to neoadjuvant therapy with SABT
SABT作为一种侵入性技术,需要将插植针经皮植入肺部肿瘤,其最常见的并发症是气胸和出血。使用共面模板引导技术降低了对术者个人经验的依赖,避免因反复调整插植针带来的损害,而且使实际计划与术前计划保持一致,进一步降低了SABT术中和术后并发症的发生率,保证其作为新辅助治疗手段的安全性。近年来,反映肿瘤糖代谢活性的正电子发射断层扫描(PET/CT)在临床上应用日渐广泛。肿瘤的脱氧葡萄糖(fludeoxyglucose, FDG)基线代谢水平被证实具有重要的预后价值,肿瘤的FDG高代谢反应提示肿瘤自身生物学行为较活跃,往往预后较差[20-21]。集合了解剖和功能成像的FDG PET/CT能够提供与肿瘤治疗预后密切相关的重要信息,多项研究[22-23]表明其敏感度、特异性、准确性高于单独使用PET或CT以及其他影像学检查;最重要的是它可以在肿瘤发生形态学改变之前,即可探测到肿瘤代谢活性的改变。因此,FDG PET/CT被越来越多地应用于实体肿瘤治疗效果的评估及预后的判定中[24]。既往多项研究证实DCECT的各种参数(尤其是TBF和TBV)能客观反映活体肿瘤内微血管密度分布和生成情况,从功能学角度反映肿瘤内的这些生理变化和改变,对肿瘤的微血管生理情况和组织的代谢功能作出量化评价,为临床上将DCECT扫描技术用于对肺癌患者治疗后疗效评估和预后预测提供理论基础[25-26]。本研究中我们在治疗前和SABT术后4~6周采集患者的检查数据,并进行对比发现患者肿瘤体积、SUVmax、肿瘤血容量(TBV)和血流量(TBF)均明显下降。8例患者达到PR,3例患者达到MR,所有患者均未出现肿瘤进展的情况,在影像学判断上说明了SABT的新辅助效果明显。
本研究也存在很多局限性:样本量较小,评估参数可能不够充分,而且肺组织在SABT术后改变可能会影响观察者对肿瘤SUVmax的判断。虽然初步结果不足以推广于临床实践,但它提供了SABT作为对可手术NSCLC患者新辅助治疗安全性的早期评估,这些数据保证了继续这项NSCLC综合治疗临床试验的安全,也为正在设计或进行类似研究的同仁提供参考。
