基于色谱-质谱联用技术定量分析氧固醇的研究进展
2019-04-25陈丽姗韩晓菲
陈丽姗, 韩晓菲
(辽宁省糖脂代谢研究重点实验室,大连大学生命科学与技术学院,辽宁大连 116622)
1 概述
氧固醇(Oxysterols)是胆固醇及其前体的氧化形式[1 - 2]。氧固醇家族有众多成员,它们可通过酶催化、活性氧氧化或体外自氧化过程,在胆固醇碳环或侧链上的一个或多个位点引入含氧官能团,例如羟基、酮基、和环氧基等[3]。最早关于氧固醇的研究可以追溯到二十世纪四十年代,Bergström等人[4]研究体液中胆固醇代谢物时,发现胆固醇存在体外非酶促自氧化现象,并指出胆固醇7位相比于其余位点更容易被分子氧氧化。随后,Smith等[5]人的研究工作进一步强调了胆固醇易于自氧化的特点。Kudo等[6]人提出生物样品中大多数氧固醇,如7β-HC(7β-Hydroxycholesterol)、7-KC(7-Ketocholesterol)、CT(Cholestane-3β,5α,6β-triol)、5,6-EC(5,6-Epoxycholesterol)和25-HC(25-Hydroxycholesterol)可能为胆固醇自氧化产物,同时也提出25-HC、7-KC和7β-HC也可通过酶促反应形成[7]。氧固醇研究中的关键问题是如何区分其是通过体内酶催化产生还是在样品储存和制备过程中形成的。尽管近现代色谱-质谱联用技术发展迅速,氧固醇分子全面识别与精确定量分析依旧困扰着研究人员。
近年来氧固醇的生物学功能得到广泛关注,其主要生理活性是在体内胆固醇平衡中起调节作用[8 - 9];氧固醇也可作为核受体的激动剂或反向激动剂,例如它可作为肝X受体α、β的激动剂[10 - 11]和视黄酸相关孤儿核受体α、γ的反向激动剂[12];也可作为G蛋白偶联受体(如EB病毒诱导基因2)的配体[13 - 14];同时氧固醇在免疫系统中也发挥着重要作用,它可通过B细胞抑制IgA的产生,指导生发型滤泡中活化B细胞的迁移并控制单核细胞分化为巨噬细胞[15],巨噬细胞通过产生25-HC(固醇代谢网络的一种成分)经由Stat1信号通路与干扰素反应相关联从而发挥抗病毒作用[16];此外氧固醇还具有作为神经退行性疾病(如阿尔兹海默症)标志物的潜能[17 - 18];而且,氧固醇对脑发育中神经的形成也有重要影响[19]。研究者们希望通过发展针对固醇脂类化合物的分析方法,从而更高效、全面的定量分析这些化合物,并且揭示其代谢异常与疾病的相关性。
氧固醇是一种微量固醇,相比于胆固醇其在生物样品中的含量极低,通常情况下胆固醇含量至少为任意一种氧固醇含量的1 000倍,这也使氧固醇的高通量定量分析成为难点。Dzeletovic等人[20]提出了温和酯水解条件,并建立了适合于气相色谱-质谱联用技术(GC-MS)分析固醇的分离与衍生化方法,使自氧化形成的氧固醇含量减少。氧固醇定量分析方法的优化建立,包括前处理方法、仪器分析方法及数据处理方法等,是进行全面准确分析氧固醇、阐明其生物学功能和获取其代谢过程与疾病相关性信息的先决条件。本文将对近年来针对氧固醇检测分析方法的研究进展进行总结与展望。
2 分析方法
2.1 基于气相色谱-质谱(GC-MS)联用技术
经典的氧固醇定量分析方法是利用GC-MS联用技术,已成功应用于脑脊液(CSF)样本[23]、脑组织样本[26]和细胞样本[27]中氧固醇的定量分析。其中,定量分析0.5 mL脑脊液样品中氧固醇含量时,分析灵敏度约为1 ng·mL-1,相同体积血清的灵敏度则小于0.5 ng·mL-1。该方法测得的结果是游离氧固醇和氧固醇脂肪酸酯的总和,局限性为它不适合用于氧固醇偶联物的定量。Björkhem[28]研究小组改进了GC-MS方法使其适用于胆固醇酸的分析,主要研究对象为脑脊液中的7-HOCA(7-Hydroxy-3-oxo-4-cholestenoic Acid),此方法可定量1 mL脑脊液中ng级的7-HOCA。该过程需要注意的是,含3-oxo-4-en-7-ol基团固醇的羟基在酸、碱条件下均不稳定。
2.2 基于液相色谱-质谱(LC-MS)联用技术
2.2.1无衍生化的LC-MS联用技术McDonald等人[30 - 31]发展了一种针对氧固醇高通量分析的LC-MS方法。该方法可检测出200 μL血浆中1 ng级的氧固醇。McDonald和Russell等利用此方法分析了来自NIST的血浆样品,并且定量了10种氧固醇的浓度。之后他们再次利用此方法检测3 230例血清样品,分析其中60余种固醇及维他命D代谢物,他们成功定量了血清中29种固醇,其中含15种氧固醇[31]。相比于其他LC-MS定量氧固醇的方法,该方法已被应用到最多数量的实际生物样品检测中。
2.2.2衍生化的LC-MS联用技术Honda等人[32]报道了一种将氧固醇衍生化为吡啶基酯,且灵敏度较高的LC-MS/MS分析方法。随后,Ikegami等人[33]利用这种方法分析了丙肝患者(n=55)和正常人(n=113)血清样本中氧固醇,测定了血清中6种氧固醇的浓度,结果显示7α-HC(7α-Hydroxycholesterol)、4β-HC(4β-Hydroxycholesterol)和25-HC在疾病组中的含量较高,当经过抗病毒治疗后检测结果显示这些氧固醇的含量下降。24S-HC(24S-Hydroxycholesterol),26-HC(26-Hydroxycholesterol)和7α-HCO(7α-Hydroxycholestenone)的浓度在疾病与健康对照组间无明显差异。
尼古丁酸(吡啶-3-羧酸)与吡啶甲酸(吡啶-2-羧酸)有极其相似的结构,Sidhu人等[34]用尼古丁酸代替吡啶甲酸测定血浆和脑脊液中游离24S-HC的含量,检测50 μL血浆和200 μL脑脊液样品中24S-HC含量,检出限分别可达1 ng·mL-1和0.025 ng·mL-1。
Jiang等人[35 - 36]尝试采用衍生化手段改进基于LC-MS/MS的氧固醇分析方法。他们将此方法应用于尼曼-匹克氏C1病(NCP1)病人的血浆样品,采用MRM模式分别定量正常对照(n=89)、父母或兄弟姐妹患病的基因携带者(n=45)和NPCI患者(n=109)血浆中7-KC和CT两种氧固醇。在对照组、NPC1患者组和携带者组中7-KC含量的平均值分别为29.0 ng·mL-1、229 ng·mL-1和43.8 ng·mL-1,其中NPC1患者组7-KC含量与其他两组相比有显著差异。CT含量也有类似差异,在NPC1患者中含量最多,但其在三组间含量差异没有7-KC显著。
部分氧固醇含有羰基,例如7α-HCO和7α,12α-diHCO等,羰基可与羟胺溶剂作用形成肟类化合物,在十几年来这一反应常应用于含氧固醇的GC-MS和LC-MS分析[37]。Debarber等人[38-29]利用含氧季铵盐(QAO)试剂(O-(3-Trimethylammonium-propyl)hydroxylamine)衍生含羰基的氧固醇,并应用此方法对脑腱性黄瘤症(CTX)患者进行诊断,此方法对于4 μL血浆中氧固醇的检出限为20 ng·mL-1。研究结果表明7α,12α-diHCO可作为CTX特征性诊断物,其含量在患病成年人中高于正常人的3 000倍,新生儿中超过10倍。
基于LC-MS/MS的氧固醇分析中最常用的衍生化方法是将氧固醇衍生化为吉拉德腙类化合物[40 - 46],吉拉德试剂经常被用于固醇类分析。许多氧固醇含有3β-羟基-5-烯基团,利用胆固醇氧化酶将其氧化后产生的3-氧-4-烯基团[47]可快速与吉拉德试剂发生衍生化。含有3β-羟基-5α-氢的氧固醇也可被氧化为3-氧化合物,这一3-氧化合物与吉拉德试剂的反应速度较3-氧-4-烯慢[48]。通常使用的两种吉拉德试剂为吉拉德试剂T(GT)和吉拉德试剂P(GP)。
酶催化氧化和GP试剂衍生化并用的方法称为酶辅助衍生化的固醇分析(EADSA)[49 - 52]。GP试剂衍生化的一个显著优点是氧固醇衍生化产物产生不同的碎片,从而能区分同分异构体。另一个优点是可以应用于胆酸等氧固醇的下游代谢物。此方法能检测到100 μL血浆中ng含量水平和250 μL脑脊液中30 pg·mL-1含量水平的氧固醇。这一方法也曾应用于维他命D分析[53]。Roberg-Larsen等人[40 - 41]采用上述类似方法,使用GT试剂和单一离子阱,并在进入色谱柱前加入去除多余衍生化试剂的步骤。他们同时采用micro-LC和nano-LC以提高灵敏度,使用nano-LC-ESI-MS/MS可达到fg数量级检出限,也可检测从10 000 个细胞中提取到的氧固醇轮廓谱。蜕皮类固醇是从昆虫中发现的一种多羟基固醇,Shevchenko等人[43]对这种分子的分析也选用了GT衍生化和LC-ESI-MS/MS进行pg数量级的检测。
上述EADSA分析方法的缺点是:某些氧固醇和胆酸本身具有3-oxo-4-ene基团,这使它们与通过胆固醇氧化酶氧化产生3-oxo-4-ene基团的分子难以区分,例如7α-HC和7α-diHCA。为解决这一难题,Griffiths等将第一次过固相萃取柱洗脱下来的氧固醇分为A和B两部分,A中加入胆固醇氧化酶而B中不加。B可显示本身含有Oxo基团的分子信息,A既能显示本身拥有3-OXO基团也可显示氧化产生3-OXO基团的分子信息。从A中的信息除去B中也含有的则可得到因氧化产生3-OXO基团的分子的含量。这一过程需要运行两次独立但连续的LC-MS分析,为简化分析过程,需使用同位素编码的衍生化试剂或定量电荷标记[54]。GP试剂可直接合成为同位素标记的形式,例如通过[2H5]吡啶与溴乙酸乙酯反应生成酰肼,从而得到[2H5]GP试剂。在EADSA方法中,Griffiths等利用[2H5]GP试剂将A衍生化,B的衍生化则用[2H0]GP试剂进行,由于[2H5]GP和[2H0]GP具有相同的质量数但经过MS/MS后产生不同m/z的离子碎片,这样便可以被应用于A和B部分的相对定量。在进样LC-MS分析前立即将两部分混合,A中的分析物比B中相同分析物的多5道尔顿,因此在一次运行的LC-MS分析中A和B两部分可轻松区别。
表1总结了文献中所报道的相应氧固醇的分析方法。
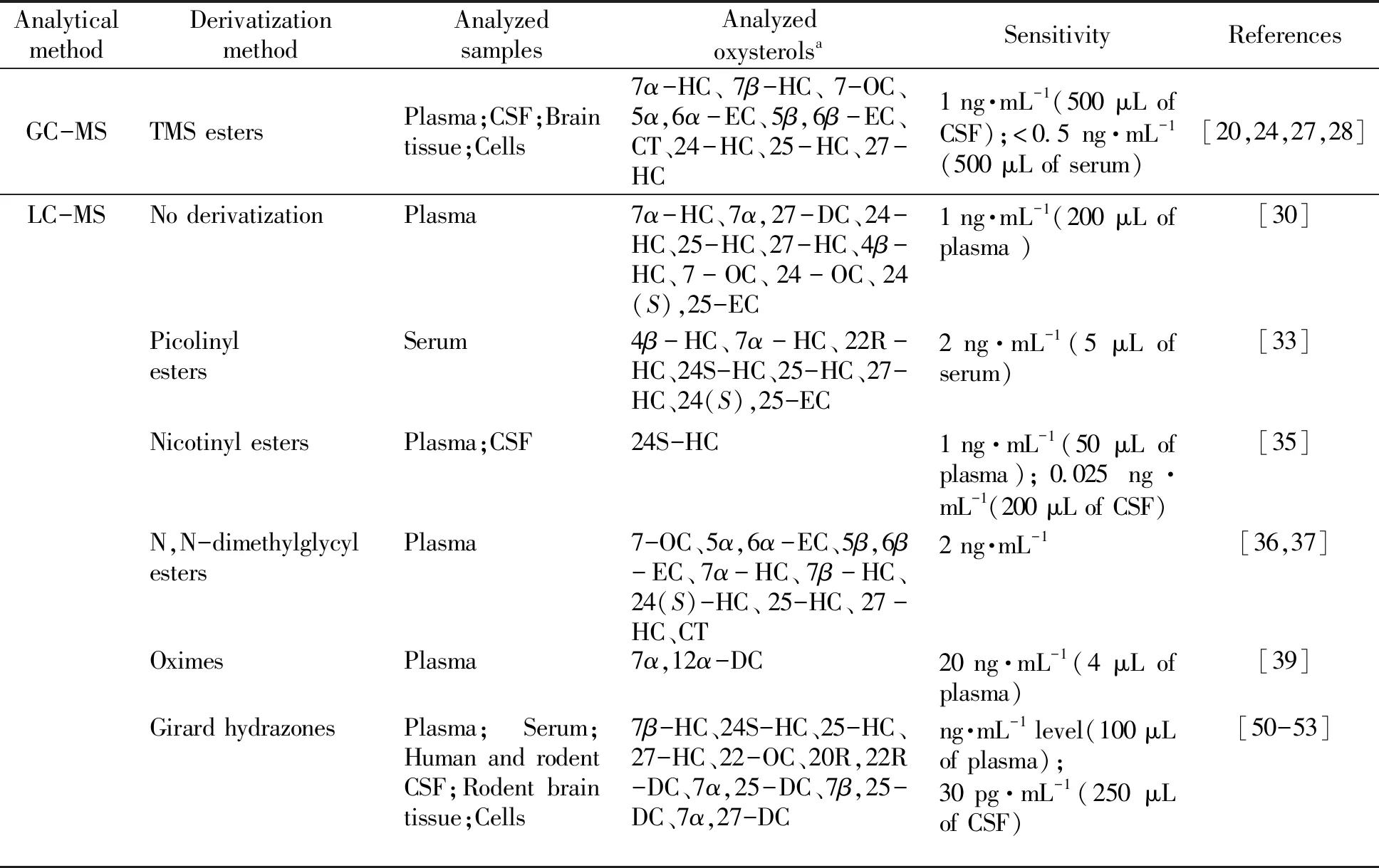
表1 氧固醇分析方法
a7-OC(7-oxocholesterol);7α,27-DC(7α,27-dihydroxycholesterol);24-OC(24-oxocholesterol);24(S),25-EC(24(S),25-epoxycholesterol);22-OC(22-oxocholesterol);20R,22R-DC(20R,22R-dihydroxycholesterol);7α,25-DC(7α,25-dihydroxycholesterol);7β,25-DC(7β,25-dihydroxycholesterol);7α,27-DC(7α,27-dihydroxycholesterol);7α,12α-DC(7α,12α-dihydroxycholesterol).
3 结论与展望
样品储存和制备过程中胆固醇自氧化是氧固醇分析过程的关键,同时氧固醇既可内源性合成也可以通过酶催化氧化或自由基反应形成,这与在空气中氧化形成的氧固醇具有完全一样的结构,对于容易在空气中通过自氧化形成的7α-HC、7β-HC、7-KC、CT和5,6-EC尤为重要。针对这些可能有必要采取防止自氧化的措施,例如使用抗氧化剂(BHT)和金属螯合剂(EDTA),在惰性气体(氩气或氮气)下进行样品前处理步骤,避免过高的温度和尽量除去样品中的胆固醇等。
氧固醇最佳分析方法的选择取决于所研究的目标氧固醇以及拥有的实验条件。目前已建立的LC-MS和GC-MS方法适合应用于诊断胆固醇生物合成和代谢的单基因遗传病,例如脑腱黄瘤病(CTX)在诊断时通常会检测出血浆中(25R)26-HC的含量极低或缺乏和7α,12α-diHCO含量增多,当血浆中含大量(25R)26-HC和3β-HCA时可被推测为7α羟化酶缺失。值得注意的是,欧洲氧固醇研究网(http://oxysterols.com/)组织的实验室内部间调查结果反馈出胆固醇体外自氧化会使7α-HC、7β-HC和7-KC检测浓度的变异系数增高,代表性侧链氧固醇,例如24-HC和(25R)26-HC)在不同实验室间的变异系数大约为60%,此结果说明利用这些代谢物用于诊断目的时仍存在不确定性,需要进行大量工作规范分析方法,降低变异系数,从而提高定量及诊断的精确性。
