多价噬菌体分离筛选及靶向灭活土壤病原菌的应用研究*
2019-04-25赵远超孔令雅万金忠张忠云冰张胜田冯彦房孙明明杜良成
赵远超 叶 茂 孔令雅 万金忠 黄 丹 张忠云 夏 冰张胜田 冯彦房 孙明明 武 俊 胡 锋 蒋 新 杜良成
(1 中国科学院土壤环境与污染修复重点实验室(中国科学院南京土壤研究所),南京 210008)(2 南京农业大学资源与环境科学学院土壤生态实验室,南京 210095)(3 生态环境部南京环境科学研究所土壤污染防治研究中心,南京 210042)(4 安徽省环境科学研究院,合肥 230022)(5 江苏省农业科学院农业资源与环境研究所,南京 210014)(6 University of Nebraska—Lincoln,Lincoln,Nebraska,Lincoln 68588,USA)
由于我国现阶段畜禽粪便安全化处理技术或环境管理仍存在一定的不足或缺失,许多城郊畜牧业养殖厂周边的农田土壤常成为残留和滋生人畜共患病原菌的高风险热点区域,严重影响人体健康和环境安全[1]。因而,针对病原菌污染农田土壤,开展必要的生物修复技术研究十分迫切。
噬菌体疗法(Phage therapy)为修复上述污染土壤提供了一种全新途径。细菌噬菌体(简称噬菌体)是一类较为专属捕食活体宿主细菌而存活的生物体,在土壤、水、空气乃至人/动物体表或肠道内均广泛分布了大量噬菌体,据估算其总量达到1031数量级[2]。噬菌体疗法是指通过分离、筛选、纯化和富集宿主病原菌的专属噬菌体之后,向污染土壤中添加特定噬菌体菌液,定向侵染灭活病原菌的修复方式[3-4]。国外学者已成功将噬菌体疗法应用在灭活辣椒、番茄、葡萄等果蔬的植物病害细菌或人畜共患致病细菌的食品安全保障领域[5-6]。然而,使用噬菌体疗法来削减土壤中病原菌的生物修复技术研究则相对较少。此外,现有研究常认为噬菌体仅限于侵染某一“种”类的宿主细菌,而近年来学术界发现:一些噬菌体经过适当的基因改造或人工加速其宽宿主谱的表达,可针对同一“属”内几种高度同源性的宿主细菌,甚至针对不同种属之间的宿主细菌也具有一定广谱性捕食区间[7-8]。这为噬菌体疗法广泛应用奠定了坚实的理论基础。
本研究以南京城郊典型奶牛场牛粪堆积池塘周边,复合病原菌污染农田土壤为例;先从污染土壤中分离、筛选、加速其宽宿主谱表达获得多价噬菌体;接着在水相和实际污染土壤中验证和优化其同步灭活多种病原菌的效果和能力,并评估修复过程中的微生物生态效应。本研究结果可为靶向灭活农田土壤中多种病原菌提供切实可行的生物修复技术。
1 材料与方法
1.1 供试材料
供试菌株大肠杆菌K12(Escherichia coliK12,K12)与带红色荧光标记(Red Fluorescent Protein,RFP)的铜绿假单胞菌(Pseudomonas aeruginosa,PAO1),均为南京农业大学土壤生态实验室提供。
供试污染土壤为水稻土,采自南京市横梁奶牛养殖场(32°30′45″N,118°94′7″E)牛粪堆积池附近。采用五点取样法,取0~10 cm的表层土壤,共5 kg,混匀,于暗处4°C冷藏保存。测定土样基本理化性质[9]:pH 7.9,全氮1.8 g·kg-1,全磷1.1 g ·kg-1, 全 钾 17.9 g ·kg-1, CEC 19.9 cmol·kg-1,水溶性氮1.8 g·kg-1,砂粒25.5%,壤粒45.3%,黏粒29.2%。
供试仪器与试剂为台式低温高速离心机、恒温培养箱、恒温摇床;大肠杆菌直接琼脂(Escherichia coliDirect Agar,ECD琼脂)、假单胞菌选择性培养基(Pseudomonas SelectiveAgar,PSA)、SM缓冲液、Luria-Bertani(LB)培养基、环境样品病毒核酸提取试剂盒(PowerViral Environmental RNA/DNA Isolation Kit,Mobio公司,型号28000-50)。
1.2 噬菌体的分离纯化
取新鲜土壤样品5 g,加入50 mL无菌水中,28℃、150 r·min-1振荡培养5 h,10 000 r·min-1离心5 min,上清液经0.22 μm滤膜除菌,取9 mL滤液与1 mL生长到对数期的宿主菌(K12或PAO1(RFP))悬液加入40 mL LB液体培养基,加氯化钙固体至溶液终浓度1 mmol·L-1,37℃、150 r·min-1摇床培养12 h。所得培养液10 000 r·min-1离心5 min,再经0.22 μm滤膜除菌,滤液即为含有噬菌体的原液[10-11]。采用双层平板法筛选噬菌体并提纯。取上述滤液100 μL与100 μL的宿主菌悬液混匀,室温静置15 min,加入3 mL的 0.7%LB琼脂培养基,混匀后平铺倒入LB固体平板上,37 ℃培养10~12 h,观察噬菌斑。待出现噬菌斑,挑取单个边缘清晰透明的噬菌斑到含有宿主菌的LB液体中,37℃、250 r·min-1培养8 h;10 000 r·min-1离心5 min,0.22 μm滤膜除菌,滤液保存在SM缓冲液中,于4℃冰箱冷藏保存。取上述滤液适当稀释培养并倒双层平板验证,如此重复4~6次即可获得纯种的噬菌体。
基于上述获得的两株专一型噬菌体(以K12为专一宿主的噬菌体命名为YSZ1;以PAO1(RFP)为专一宿主的噬菌体命名为YSZ5),开展加速其宽宿主谱的表达过程[12-13]。取600 μL保存的噬菌体(YSZ1或YSZ5)原液,分别与200 μL K12和200 μL PAO1(RFP)混合菌悬液,共同加入99 mL LB液体培养基中,再加入氯化钙固体调至终浓度为1 mmol·L-1,37℃、150 r·min-1振荡培养96 h,每隔8 h取样,将离心过滤获得的新噬菌体与PAO1(RFP)和K12分别倒双层平板验证,观察噬菌斑。若出现噬菌斑则证明表达成功,获得多价噬菌体YSZ1R和YSZ5K,挑取单个清晰透明的噬菌斑富集储存。
1.3 噬菌体的生物学特性鉴定
噬菌体的形态观察,将噬菌体原液滴在铜网上,用pH 7.0、2%磷钨酸负染90 s后,用滤纸吸去多余染液,干燥后于日立H-7650型透射电子显微镜下观察其形态。
噬菌体核酸提取及鉴定,噬菌体核酸提取使用环境样品病毒核酸提取试剂盒(核酸提取效率107copies·mL-1,核酸最终体积50~100 μL),提取的核酸用DNaseⅠ、RNaseⅠ和HindⅢ酶切处理并使用琼脂糖凝胶电泳检验,根据酶切图谱鉴定和判断其核酸性状及大小。
噬菌体最佳感染复数,感染复数(Multiplicity of infection,MOI)又称作噬菌体滴度,是指感染发生之前噬菌体与宿主菌数量的比值。最佳感染复数(Optimal multiplicity of infection,OMOI)即获得子代噬菌体最高产量时的MOI。取对数期宿主菌悬液100 μL,按感染复数分别为100∶1、10∶1、1∶1、1∶100、1∶1 000、1∶10 000加入噬菌体。37℃摇床振荡培养5 h。用双层平板法测定各组噬菌体滴度1。
噬菌体一步生长曲线,按最佳感染复数,取500 μL噬菌体与500 μL宿主菌悬液加入9 mL LB液体培养基中,37℃、150 r·min-1振荡培养,每10 min取样,离心过滤,并用双层平板法测定噬菌体滴度[14]。
1.4 试验设计
噬菌体对宿主菌的灭活能力,验证上述分离获得的噬菌体对宿主菌的灭活能力,按照最佳感染复数添加噬菌体与宿主菌各100 μL于100 mL LB液体培养基中,37℃、150 r·min-1振荡培养。每隔2 h取样,每次取200 μL稀释适当浓度,平板计数细菌数量。每个处理同时设置单独不添加噬菌体的对照。
噬菌体疗法在水相中灭活病原菌的效果,设置水相对照组(CK),即:将K12与PAO1(RFP)培养到对数期后,各取100 μL加入100 mL LB液体培养基中,振荡混匀,37℃、150 r·min-1振荡培养。在CK基础上,综合参考最佳感染复数,再设立4个处理:处理1:添加专一型噬菌体YSZ1;处理2:添加多价噬菌体 YSZ1R;处理3;添加专一型噬菌体 YSZ5;处理4:添加多价噬菌体YSZ5K。每种噬菌体均添加100 μL(104PFU·mL-1),每隔4 h取样,共监测48 h,每次取200 μL菌悬液进行细菌计数。根据细菌平板计数判断评估噬菌体疗法在水相中对病原菌的灭活效果。
噬菌体疗法在污染土壤中的灭活验证研究,为进一步验证噬菌体疗法在实际污染土壤中灭活多种病原菌的效果,本环节将进行逐一回接上述分离获得的噬菌体至污染土壤中,开展修复验证实验。重点关注土壤中粪肠杆菌(Fecal coliform)和假单胞菌属(Pseudomonas)菌群等病原菌的灭活效果。共设置5个实验处理:对照组(CK):称250 g污染土壤,每隔8 d以无菌水调控土壤含水率至最大田间持水量的80 %,28℃±4℃,避光培养24 d;处理1:在对照组基础上添加专一型噬菌体YSZ1;处理2:在对照组基础上添加多价噬菌体YSZ1R;处理3:在对照组基础上添加专一型噬菌体YSZ5;处理4:在对照组基础上添加多价噬菌体YSZ5K。每组处理均添加噬菌体500 μL(104PFU·mL-1)。每隔3 d取样,每次取5 g土壤,平板计数法测定细菌数量。使用ECD培养基筛选并测定粪肠杆菌群细菌数目,使用PSA培养基筛选并测定假单胞菌群细菌数目,每个计数浓度设3次重复。
1.5 土壤微生物群落功能的多样性和稳定性分析
将1.4中采集的土壤样品,进行微生物群落功能多样性和稳定性分析。土壤微生物群落功能多样性采用Biolog ECO测定法[15-16]。Biolog ECO微平板中多底物酶联反应采用每孔的平均吸光度值(Average well color development,AWCD)来描述,计算表达式:

式中,C代表含底物试验孔的吸光值,R代表不含底物对照孔的吸光值。土壤群落功能多样性采用培养Biolog ECO微平板孔中吸光值,计算土壤微生物群落功能多样性指数(香农指数H和辛普森指数D)。
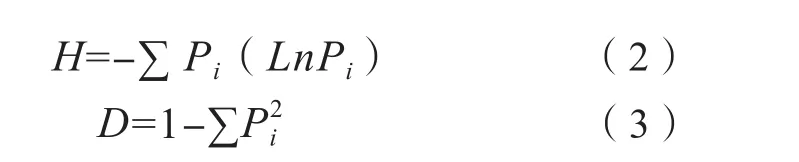
式中,Pi为第i孔相对吸光值(C-R)与整个微平板相对吸光值总和(∑ODi)的比率。
1.6 数据处理
所用数据均为3次重复采样的平均值,利用软件SPSS 21进行数据统计分析。图表采用 Microsoft Excel 2016和软件 OriginPro 9.0绘制。
2 结果与讨论
2.1 噬菌体分离纯化
经5次分离纯化及加速宽宿主谱表达后获得四株裂性噬菌体,分别是:单一攻击K12的噬菌体YSZ1;在YSZ1基础上加速宽宿主谱表达得到能同时攻击K12和PAO1(RFP)能力的多价噬菌体YSZ1R;单一攻击PAO1(RFP)的噬菌体YSZ5;在YSZ5基础上加速宽宿主谱表达得到能同时攻击PAO1(RFP)和K12能力的多价噬菌体YSZ5K。由图1可知,噬菌体YSZ1和YSZ5的噬菌斑呈清晰透明、边缘整齐、无晕环的圆斑,直径约1~2 mm;噬菌体YSZ1R和YSZ5K噬菌斑中间透明、四周无晕环、直径为2~3 mm。

图1 四株噬菌体噬菌斑形态Fig. 1 Plaques of four phages
2.2 噬菌体形态观察
通过透射电镜观察不同噬菌体形态,发现噬菌体YSZ1(图2 A)具有清晰多面体头部,头长径约95 nm,横径约70 nm,尾长约100 nm;YSZ1R可见到球状头部和一条长尾,头长径约60 nm,横径约70 nm,尾长约175 nm(图2 B);YSZ5可见到形状规则的立体结构头部和一条长尾,头长径约100 nm,横径约70 nm,尾长约180 nm(图2 C);YSZ5K可见到椭圆形头部及可收缩的尾鞘,头长径约110 nm,横径约80 nm,尾长约120 nm(图2 D)。根据国际病毒分类委员会(The International Committee on Taxonomy of Viruses,ICTV)第九次报告[17],以上四种噬菌体均属于长尾噬菌体科。

图2 噬菌体的透射电镜观察(×50.0 K)Fig. 2 Transmission electron micrographs of phage(×50.0 K)
2.3 噬菌体核酸产物酶切电泳分析
利用环境样品病毒核酸提取试剂盒提取噬菌体基因组,并对核酸产物用酶切处理,由图3可知,四株噬菌体均能被DNase Ⅰ 降解完全(4、8、B、F泳道),而RNase A处理核酸均无变化(3、7、C、G泳道),说明四种核酸产物均为双链DNA[13]。用限制性内切酶HindⅢ对DNA进行酶切处理后,估算基因组大小(2、6、D、K泳道),四株噬菌体YSZ1、 YSZ1R、YSZ5、YSZ5K基因组分别约为57 Kb、54 Kb、59 Kb和51 Kb。
2.4 噬菌体最佳感染复数
最佳感染复数是表征噬菌体裂解能力的重要指标。从表1可知,当MOI为1∶1 000时噬菌体YSZ1子代产出量最高,达到5.5×108PFU·mL-1,即噬菌体YSZ1的OMOI为0.001;当MOI为10∶1时噬菌体YSZ1R子代产出量最高,达到1.8×108PFU·mL-1,YSZ1R的OMOI为10;当MOI为1∶1 000时噬菌体YSZ5子代产出量最高,达到5.4×109PFU·mL-1,YSZ5的OMOI为0.001;当MOI为1∶10时噬菌体YSZ5K子代产出量最高,达5.8×106PFU·mL-1,YSZ5K的OMOI为0.1。

图3 噬菌体基因组酶切电泳图Fig. 3 Electrophorogram of phages genome

表1 最佳感染复数的测定Table1 Determination of optimal multiplicity of infection (OMOI)
2.5 一步生长曲线的绘制
潜伏期是指从噬菌体侵染宿主细菌到细菌开始裂解时为止的周期;爆发期是指从细菌裂解开始到所有被感染细菌完全裂解的周期;裂解量=爆发末期噬菌体滴度/感染初期宿主细菌数量[18]。YSZ1感染宿主菌的潜伏期为13 min,爆发期为47 min,裂解量为365(图4 A);YSZ1R感染宿主菌的潜伏期为20 min,爆发期为51 min,裂解量为47(图4 B);YSZ5感染宿主菌的潜伏期为12 min,爆发期为49 min,裂解量为418(图4 C);YSZ5K感染宿主菌的潜伏期为18 min,爆发期为42 min,裂解量为24(图4 D)。由此可知,四株噬菌体的潜伏期和爆发期相对较短,具有潜在的修复应用价值。
2.6 专一型噬菌体对单一宿主菌的灭活能力
对上述分离得到的两株专一型裂解性噬菌体在水相中进行灭活能力验证实验。由图5 A可知,单独添加噬菌体YSZ1,能显著抑制K12生长(P<0.05);相较于对照组K12的生长曲线,添加噬菌体YSZ1培养12 h后,K12数量下降至8.9个数量级。此外,由图5 B可知,YSZ5对PAO1(RFP)也具有显著的灭活作用(P<0.05),相较于对照组PAO1(RFP)的生长曲线,添加噬菌体YSZ5培养12 h后,PAO1(RFP)下降至9.2个数量级。

图4 噬菌体一步生长曲线Fig. 4 One step growth curve of phage
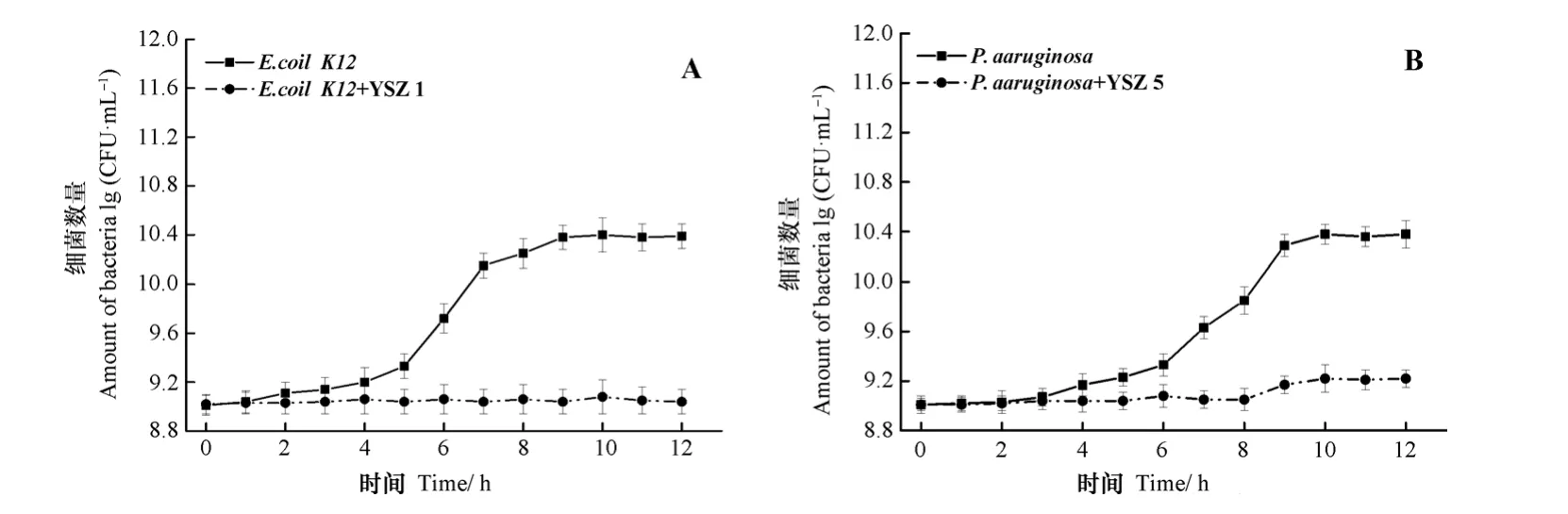
图5 噬菌体灭活能力Fig. 5 Inactivation ability of phage
2.7 水相中检验噬菌体疗法灭活混合病原菌的效果
为了探究噬菌体靶向灭活病原菌的能力,本研究将上述获得的四株噬菌体添加到K12和PAO1(RFP)的混合菌液中,并测定其细菌数量衰减变化。由图6 A可知,专一型噬菌体YSZ1对K12的灭活效果非常显著(P<0.05),与原始CK相比,K12下降约1.5个数量级;而PAO1(RFP)呈现先快速增长,28 h后再缓慢下降的趋势,下降了约0.5个数量级,这可能是由于专一型噬菌体YSZ1在混合病原菌体系中,优先攻击K12宿主菌,随着共培养的自然进化过程,逐渐形成并具备了一定攻击PAO1(RFP)的能力[12]。处理2(图6 B)中添加了多价噬菌体YSZ1R之后,K12生长抑制率相较于图6 A结果略有下降,下降了约1.1个数量级;而PAO1(RFP)生长抑制率则相较于图6 A结果出现一定程度的上升,整体下降了约1.0个数量级。处理3(图6 C)中,添加了专一型噬菌体YSZ5之后,PAO1(RFP)数量呈现显著下降的趋势(P<0.05),下降了约1.9个数量级,同样K12在0~24 h期间出现稳定增长后,呈下降趋势,截止48 h时,共下降了约0.4个数量级,这可能是由于随混合体系中宿主密度增加噬菌体的同时具备较高的吸附速率,其中部分YSZ5噬菌体也进化出攻击K12的广谱灭活能力[12,19]。处理4(图6 D)中,多价噬菌体YSZ5K对K12和PAO1(RFP)的协同灭活效果相较于其他三组处理,最为显著(P<0.05),K12下降约1.0个数量级,PAO1(RFP)下降约1.7个数量级。由此可知,多价噬菌体YSZ5K相对其他种类噬菌体灭活效果具有更加广谱性的捕食范围,可为后续靶向灭活污染土壤中复合病原菌的修复技术研发,提供高效的噬菌体菌种资源。
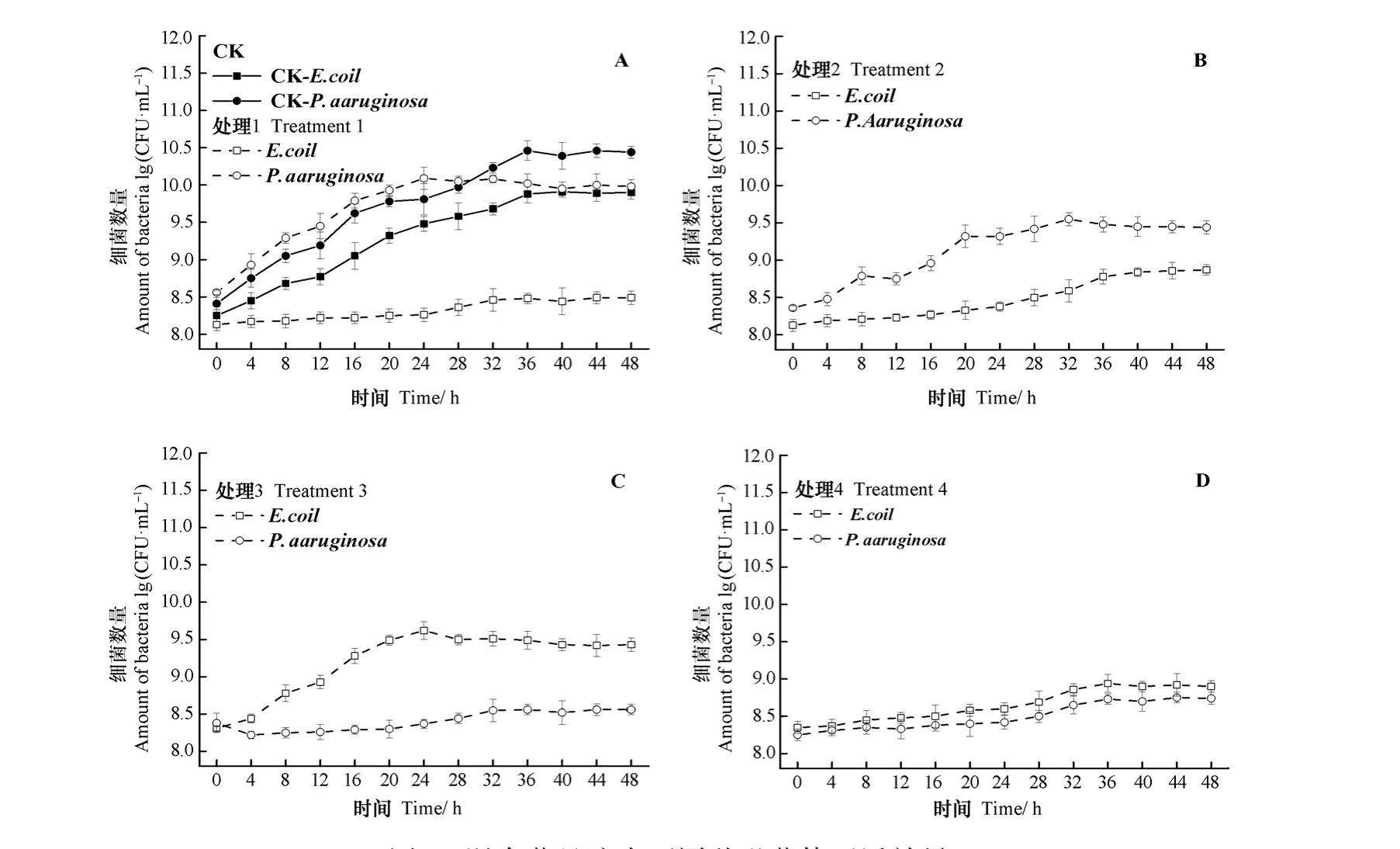
图6 混合菌悬液中不同种噬菌体灭活效果Fig. 6 Inactivation effect of different phages in mixed bacteria suspension
2.8 噬菌体疗法灭活污染土壤中复合病原菌的验证研究
在病原菌复合污染土壤中,病原菌丰度的变化是决定土壤污染程度和修复效果的重要参考。本研究中使用的土壤样品采集自奶牛场牛粪堆积池附近的污染土壤,其中多种病原菌的背景丰度较高,在培养24 d时,粪肠杆菌(Fecal coliform)细菌丰度为8.2×106CFU·mL-1,假单胞菌属(Pseudomonas)细菌丰度为6.8×105CFU·mL-1(图7 A)。在第24天时,处理1中专一型噬菌体YSZ1对土壤中粪肠杆菌系列病原菌的灭活效果高于假单胞菌属的相应灭活效果。在该处理中,粪肠杆菌细菌丰度下降至8.7×105CFU·mL-1,而假单胞菌属细菌丰度下降至6.1×104CFU·mL-1,这一结果可能是由于在实际污染土壤中,YSZ1也逐渐进化出针对PAO1的协同灭活能力[12];处理2(图7 B)中,多价噬菌体YSZ1R对两类病原菌都有明显的灭活能力(P<0.05),粪肠杆菌细菌丰度下降至9.6×105CFU·mL-1,假单胞菌属细菌丰度下降至3.2×104CFU·mL-1;处理3(图7 C)中,专一型噬菌体YSZ5对于假单胞属细菌的灭活效果呈现整体呈下降趋势,在第24天时已下降至1.8×104CFU·mL-1,而对于粪肠杆菌细菌的灭活影响,则呈现出0~15 d之内略有升高,第15天后逐渐下降,第24天下降至2.2×106CFU·mL-1;处理4(图7 D)中,添加了多价噬菌体YSZ5K之后,粪肠杆菌细菌和假单胞属细菌丰度均呈现下降的趋势,第24天,粪肠杆菌细菌丰度下降至6.5×105CFU·mL-1;假单胞属细菌丰度下降至1.2×104CFU·mL-1。多价噬菌体(YSZ1R/YSZ5K)对污染土壤中复合病原菌综合协同灭活能力均显著高于专一型噬菌体(YSZ1/YSZ5),并且噬菌体YSZ5K在实际污染土壤中的灭活效果要大于噬菌体YSZ1R的相应灭活效果。上述灭活土壤中复合病原菌的效果趋势与水相中相关验证结果规律一致,尽管灭活土壤中病原菌群的效果略低于纯水相中的效果,这可能是由于实际污染土壤中不仅存在复合病原菌群,同样也存在大量益生菌群,抵消或削减了实际土壤灭活修复的效果[20-21]。然而,该结果仍然对于靶向修复高丰度病原菌污染土壤具有显著的指示意义。

图7 污染土壤中粪肠杆菌和假单胞菌属细菌丰度的动态变化Fig. 7 Dynamic of fecal coliform and Pseudomonas bacterial abundance in contaminated soil
2.9 噬菌体疗法对土壤微生物群落多样性的影响
噬菌体疗法在靶向灭活土壤中复合病原菌的同时,可能也会对土壤其他益生菌群或整体微生物群落结构和功能多样性造成一定程度的影响[22]。因此,对施用过噬菌体疗法的污染土壤进行生态风险评估十分必要。AWCD数值的变化可以反映土壤微生物整体代谢活性的波动;香农丰富度指数H反映的是群落的丰富度, 其值越大说明群落多样性越高;辛普森优势度指数D可反映土壤微生物群落常见种的优势度变化, 数值越大表明得到同一物种的几率越大, 其微生物多样性越低。
如图8所示,0~120 h 内AWCD值快速增长,进入对数增长期;在培养的120 h后,AWCD值随培养时间的延长趋于缓慢并达到稳定。AWCD值在0.1~0.7之间,AWCD值表现为YSZ5K>YSZ1R>CK>YSZ5>YSZ1。
此外,从表2可知,不同处理之间,多价噬菌体的丰富度指数H显著高于单一性噬菌体的丰富度指数,而优势度指数D则为多价噬菌体处理显著低于专一型噬菌体处理(P<0.05)。在这些指数的变化过程中均具有类似规律,即分别单独添加多价噬菌体YSZ5K处理和YSZ1R处理,均可在一定程度上显著促进修复后土壤微生物功能多样性和稳定性(P<0.05),而分别单独添加专一型噬菌体YSZ5处理和YSZ1处理,土壤微生物多样性出现了一定程度的降低。
由此说明,多价噬菌体疗法对于维持或改善土壤微生物群落代谢活性具有一定的良性作用;而专一型的裂解性噬菌体对于土壤微生物群落代谢活性的影响,则存在一定负面风险。这可能是由于多价噬菌体的捕食范围较广,其自身进化和拓展捕食宿主细菌的能力较强,因而有助于提升土壤微生物群落的多样性和稳定性。相反专一型宿主噬菌体在实际污染土壤环境中靶向灭活宿主菌的专属性过强,则有可能导致某一属种的宿主细菌大幅度灭活,致使土壤微生物群落系统中某一类细菌出现生态位的缺失,造成土壤微生物群落代谢活性降低的短期现象。因而,在实际噬菌体疗法的应用中,使用多价噬菌体同步灭活多种病原菌的技术具有广谱性高、生态风险低、环境友好的优点。

图8 不同处理方式下AWCD值的变化Fig. 8 Variation of AWCD value relative to different treatment
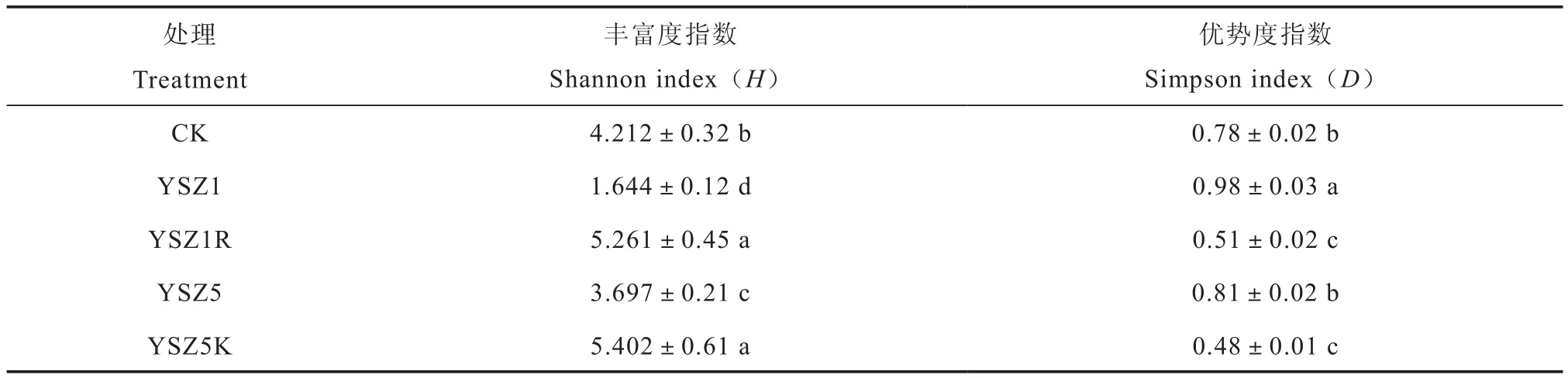
表2 不同处理方式土壤微生物群落功能多样性指数Table 2 Diversity indices of soil microbial communities relative to different treatment
3 结 论
针对当前病原菌复合污染土壤的环境问题,本研究提出了基于噬菌体疗法靶向灭活土壤中多种病原菌的修复技术。研究分离筛选出的多价噬菌体在水相和实际污染土壤中同步灭活粪肠杆菌和假单胞菌属细菌的能力显著高于专一型噬菌体的相应灭活能力,同时使用多价噬菌体疗法也有助于维护和改善修复后土壤微生物生态功能多样性与稳定性。
