以彝族药痛舒胶囊开发为例探索民族药创新发展路径*
2019-04-20符德欢朱兆云曹国丽
杨 洋,周 林,谭 慧,符德欢,朱兆云,曹国丽**
(1. 云南省药物研究所 昆明 650111;2. 云南白药集团创新研发中心 昆明 650111;3. 云南省中药和民族药新药创制企业重点实验室 昆明 650111)
民族药是少数民族群众的集体智慧和长期实践总结的结晶,为了使其服务于更广阔的人群,亟需开展民族药研究和应用开发,是保护、传承和发展民族药的必经之路。据统计,目前中国民族成药生产企业共154家,民族药产业发展十分迅速,以部分发展良好的民族药企业的2014年度销售收入为例,云南白药为188.14 亿元,比上年同期增长18.97%;贵州益佰31.57亿元,比上年同期增长13.36%[1]。然而,民族药研究开发及产业化过程中却存在基础研究薄弱、资源利用可持续性差、知识产权保护不足、市场意识不足等缺陷,严重影响了民族药的创新发展。本文将以云南省药物研究所自主开发的彝族药新药痛舒胶囊为例,并结合本单位在民族药开发方面的实践经历,探索以民族药知识及应用经验为导向的民族药创新发展路径,以期为民族药的新药开发、产业化发展及国际化提供参考。
1 痛舒胶囊开发
上世纪90 年代末,云南省药物研究所承担了“低纬高原地区(云南)天然药物资源野外调查及研究开发”项目,历时12年,较为系统的掌握了低纬高原地区(云南)天然药物资源现状。痛舒胶囊正是基于此项目的深入实施,结合云南大理巍山彝族民间医药实践,成功开发的具有自主知识产权的彝族药新药。痛舒胶囊的开发从彝族民间用药经验调查入手,经过药用资源调查、组方筛选等一系列系统的现代研究开发而成,其开发过程简介如下。
1.1 民间调查,寻访民族用药经验
大理巍山彝族自古就有习武和练功的传统,加之其地势多不平坦,常出现肿胀、出血、骨折等外伤。为了治疗跌打损伤类疾病,彝族人民就地取材,形成了独具民族特色及地方特色的彝族用药方案。创办于清代光绪年间的大理巍山县“慎德堂”,收集并整理了大量流传于民间的跌打损伤用药,在多年的临床应用中,不断总结出彝族药对治疗跌打损伤的选方、验方,并验证了其疗效。
云南省药物研究所在实施低纬高原地区民族用药经验和天然药物资源调研系统工程的基础上,构建了以民族民间用药经验为线索的药物筛选方法和评价体系。主要研究者基于巍山“慎德堂”在当地长期积累的彝族民间用药经验,结合彝族医药理论,筛选出用于治疗跌打损伤、风湿关节炎、肩周炎、痛风等病的内服常用药物组合,即痛舒胶囊的药味组成——七叶莲、三七、灯盏细辛、玉葡萄根、珠子参等药材。
1.2 资源考查,系统掌握种源和资源
正确的种源是保证药品有效性的基础,丰富的资源是产业化的原料保障。民族药在民族民间存在大量的同物异名、同名异物现象,必须有效梳理组方所列的药物产地、功效、形态,弄清民族民间采用种类及药物使用习惯等。痛舒胶囊研究团队为了确定组方中每味药物种源,对云南巍山、楚雄等地的彝族民间进行了详细查访,详尽了解相关用药信息,遍及大理、怒江、东川等地采集凭证标本及对口药材,根据掌握的信息,对原植物标本进行分类等,确定了种源、摸清了资源。
1.3 现代科技,助推痛舒胶囊开发
现代科技加速了痛舒胶囊从民族地区走向服务于全国相关患者的新药大市场。按照中药新药的注册要求,对彝族药痛舒胶囊进行了系统研究开发。
在彝族传统用药经验中,内服组方常以汤剂口服给药,在结合药效、安全性、质量稳定的基础上,确定了以水煎煮提取为主的制备工艺,该工艺尊重传统,既保证了临床疗效也易于产业化。经反复研究,采用质量稳定的中试样品进行了质量标准、药理活性(抗炎、镇痛、消肿)、毒性评价(急性毒性实验和长期毒性实验)等临床前研究,明确其安全性、有效性及质量可控性;在此基础上进一步采用临床试验对安全性和有效性进行研究验证。产品上市之后,为将痛舒胶囊开发为具有较高安全性、有效性、机理相对清楚的现代化民族药,进一步对其作用机理进行了深入研究。
2 痛舒胶囊产业化
2.1 资源的可持续利用
随着痛舒胶囊产业化转化的成功实施,产销量不断增加,资源可持续利用问题显得尤为突出。2007年,云南省药物研究所开展了药材资源的战略性研究工作。
研究团队展开了深度的药材资源及采供情况调研,深度分析了药材分布区域近5年的产收量、资源蕴藏量及推广栽培状况,调查了省内有关药物科研、生产、经营等机构以及企业的药材经营、开发和使用等情况。在调研项目的基础上制定了药材种植发展计划、原料药材的采供战略等。云南省药物研究所大力扶持种植基地,推广人工栽培,重点对珠子参、多芽滇重楼、七叶莲、玉葡萄根等4个品种进行了优良品种选育、种植推广等。例如,选育出三个珠子参优势种源,获得新品种鉴定证书;通过多地区的滇重楼进行系统筛选、扩繁,选育得到多芽滇重楼优良品种1 个,命名为“云全一号”;利用多芽滇重楼新品种优良的生物学特性,通过分株繁育的方式,缩短了滇重楼常规种植周期,建立规范化种子育苗基地。通过以上深入调研及有力措施的实施,基本解决了资源的可持续利用问题。
2.2 知识产权保护
实践证明,民族医药行业核心竞争力在于技术,用法律及法规保护民族医药知识产权,在一定程度上对其新药开发和参与市场竞争起到了积极的作用,也将有利于整个行业健康发展。对痛舒胶囊实行知识产权保护,从处方到制备工艺再到产品外观设计等方面实施全方位、多层次的专利立体式保护;将痛舒胶囊同系列6 个产品注册为“金品”商标,“金品”商标于2006年被评为“云南省著名商标”。
3 痛舒胶囊国际化注册
近年来,国家不断出台各项政策、规划,鼓励中医药企业走出去,提高中药科技含量,从而进军世界主流医药市场,为中药及民族药国际化提供了有力的支持。2016 年,复方丹参滴丸完成美国食品药品管理局(U.S.Food and Drug Administration,FDA)新药注册的Ⅲ期临床研究,为中药的国际化、进入世界主流医药市场带来了巨大信心。
基于痛舒胶囊良好的疗效和安全性,以及对美国市场相关适应症化学药品情况的分析,云南省药物研究所确立了痛舒胶囊以植物药形式向FDA 注册申报,最终确立以处方药进入美国市场的研究目标。目前,已完成研究团队组建、新药临床前(Pre-Investigational New Drug, Pre-IND)相关研究及新药临床研究申请(Investigational New Drug,IND),并获得美国FDA 的Ⅱ期临床许可。

表1 Pre-IND会议流程扼要
3.1 组建研究团队
为了满足痛舒胶囊作为新药在美国注册上市的研究需求,云南省药物研究所组建了研究团队,包括:规范化种植研究(Good Agricultural Practice,GAP)组、化学-控制(Chemical-Control, CC)组、规范化生产研究(Current Good Manufacture Practice, CGMP)组、提取组、制剂组、药理组、毒理组、药代组、临床研究组、注册组等,涵盖了生产、临床前研究、临床研究和产品注册等人员。研究团队深入学习美国植物药新药注册的法律法规、实施细则及药品临床前和临床试验的国际惯例和指导原则,如《植物药生产指南》、国际协调会议(International Conference on Harmonization,ICH)指导原则、FDA 指导原则等,对痛舒胶囊国际化注册的临床前研究、IND 申请、新药上市申请(New Drug Application,NDA)等法规和技术有了充分的理解和掌握。生产和试验研究组按国际化标准,建立从药材种植到药品生产的GAP及GMP体系,以及质量控制和管理体系,结合民族药特色,进行药材质量、生产工艺、毒理学、药理学、药代动力学及临床试验的系统研究,用实验数据回答FDA 所关心的痛舒胶囊安全性、有效性和质量一致性问题。注册组负责按照美国植物药新药注册相关法律法规要求,整理和编写不同注册阶段的注册申报资料,同时协调试验研究组的工作,建立起一整套符合国际要求的植物药研究注册方法体系,逐步推进项目进程。
3.2 申请新药临床前会议
中药、民族药国际化包括临床前研究、临床研究申请、新药上市申请等一系列工作。在申报IND 之前,企业与FDA 将针对新药注册的相关问题进行Pre-IND 会议,通过该会议积极与FDA 进行交流沟通,企业可以获取更多FDA 对于药物开发方面的建议,掌握FDA 的要求,从而少走弯路和走错路,提高申报成功率。处方药申报者付费法案(Prescription Drug User Fee Act, PDUFA)将FDA 与申办方之间的会议分为Type A、Type B、Type B (end of phase,(EOP))、Type C 四种类型,Pre-IND 会议属于Type B,Pre-IND 会议流程见表1[2]。
为此,研究团队按照FDA 的要求,先后形成Pre-IND 会议申请文件和Pre-IND 会议文件包,包括痛舒胶囊研究、生产和销售资料,原药材、中间品和制剂成品三个层次的“化学、生产和质量控制”资料,市场应用、药理和毒理、临床有效性和安全性等资料。研究团队与FDA 召开Pre-IND 会议,就质量控制、药理毒理学研究、临床试验计划以及适应症选择等诸多关键问题进行了沟通,与FDA 有关专家对研究策略的选择进行了深入交流和探讨,并有效达成一致意见。根据与FDA 交流沟通的结果,研究团队灵活制定了各项研究方案及开发计划,根据每一项研究的紧急/重要程度安排开展时间,以最少的时间补充相关必要的研究,满足FDA 提出的IND 申报要求,为IND 申请做好充分准备。例如,只需在新药上市申请前建立符合ICH和FDA规范的标准操作规程(Standard Operating Procedure,SOP)体系和GXP体系即可,该项研究可在IND申请提交后同时进行。
3.3 创新研究
FDA 在对待药品的安全性、有效性和质量可控性的重要程度上,首先考虑的是安全性问题[3]。为保证痛舒胶囊美国Ⅱ期临床研究的顺利申报及实施,研究团队对痛舒胶囊进行了系统的安全性评价,结合2015年颁布的《植物药指南》,探索适合植物药多成分特点的药代动力学创新性研究。为保证后期临床样品的批间一致性,研究团队自主创新,借鉴中药多组分、多靶点特点的多元指纹图谱,依靠质量控制与分析技术,完整地表征从种植、提取到制剂全过程的药效物质组成和变化规律,使产品从原药材→中间品→成品的全过程得到有效的质量控制。
3.4 美国药物非临床研究质量管理规范(FDA-Good Laboratory Practice,FDA-GLP)依从性检查
在收到云南省药物研究所提交的IND 申请后,FDA 对云南省药物研究所药物安全性评价中心(以下简称“安评中心”)进行了针对性检查。美国联邦食品药品和化妆品法、公共卫生服务法要求被FDA 监管的产品,在申请研究和上市申请时提交产品安全的证据,这些产品包括食品、色素添加剂、动物用药、人用药和生物制品、人类医用设备、诊断制剂以及电子产品。FDA-GLP 检查的目的主要包括三个方面:(1)核实为研究和上市提交的数据的质量和完整性。(2)检查为申请研究或上市实施安全性研究的非临床研究实验室。(3)审核安全性研究试验,确定GLP 法规的遵从性程度。检查分为监督检查及针对性检查。常规监督检查(一般二年一次)是定期性的、常规性的,以确定实验室遵从GLP 法规,包括对机构的检查、对正在进行的试验和(或)近期内完成试验的审核。针对性检查是为了某种具体目的而进行的。[4-5]
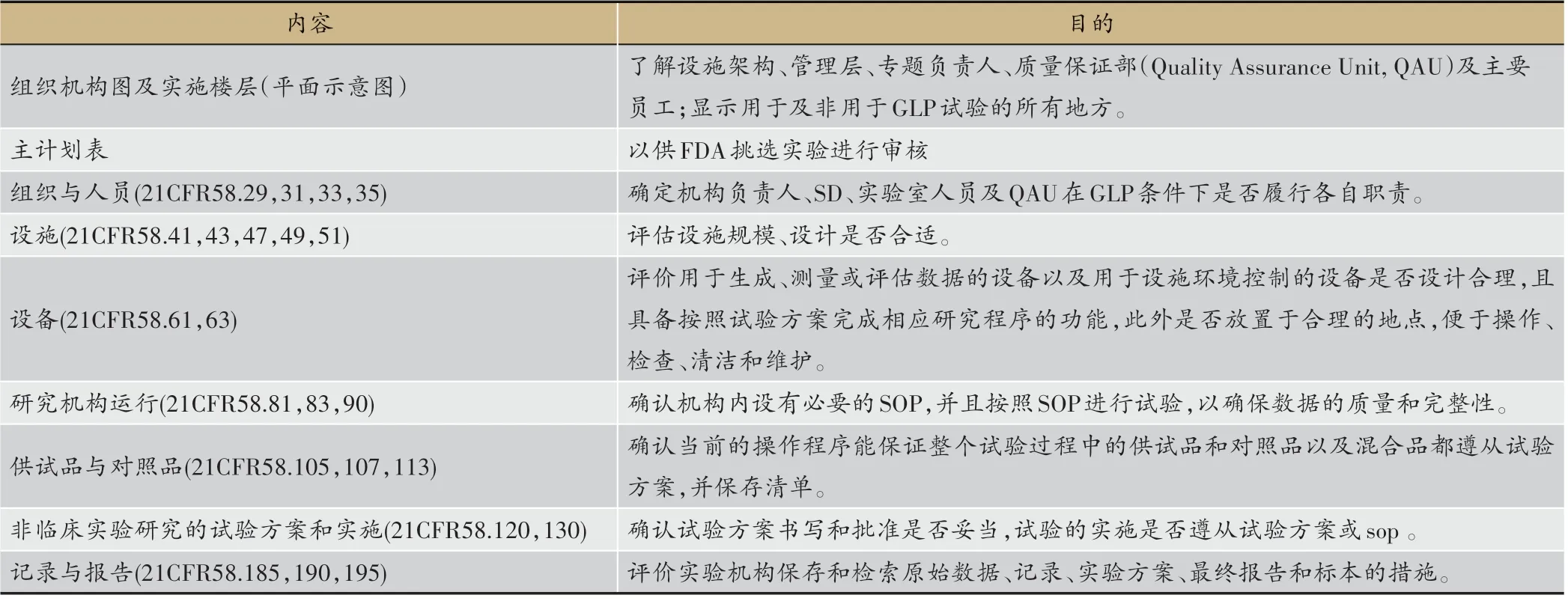
表2 FDA-GLP依从性检查需提供及检查的内容
FDA 检查程序包括检查前通知,情况介绍会,检查为期5-10 天,总结会,GLP 检查报告。根据调查操作 手 册(Investigations Operations Manual, IOM)[5]及21CFR Part58[6],需提供及检查的内容见表2。
2018 年5 月7 日至2018 年5 月14 日,FDA 针对研究项目对安评中心进行了为期6天的GLP遵从性的针对性检查,证实来自申办方提交给FDA 的非临床研究的审查结果,确定是否接受相关试验。针对此次检查,安评中心充分做好检查前的准备,对自身的GLP体系是否符合FDA 的GLP 标准进行差距分析,由机构负责人领导,针对差距分析发现的不足采取改进行动;向有经验的GLP 机构了解FDA 检查模式,培训FDA 检查时的员工行为要求,并模拟检查,消除紧张,提高交流效率。此外,提前设计检查路线并审计日程安排,成立了FDA 领导检查小组,包含负责人、FDA 主要联系人、陪同人员、记录员等,该小组全面负责管理和协调FDA检查相关事宜,并安排FDA检查专员办公地点及落实回答相关专业问题的主要负责人。
在6 天的时间里,检察官深入安评中心设施的每个部分,按照表2列举内容,现场抽检了云南省药物研究所IND 申请时递交材料的安全性评价实验现场操作,检查多台实验仪器的使用管理、原始数据记录、资料存储、档案管理和样品管理等,询问了多位实验项目负责人、技术操作人员及相关管理人员,对于整体实验设施运行、质量保证体系、人员队伍建设、实验项目实施、实验数据的管理和项目管理流程等,进行了系统、全面、缜密的检查。检查中未发现违背FDAGLP规范、影响试验质量及完整性的重大问题,GLP运行符合美国FDA 的GLP 规范。检查总结会上,FDA 检查专员也对安评中心存在的不足和需要改进的地方提出了诚恳的意见,为今后安评中心的提升和建设指明了方向。
4 民族药创新发展路径探索
基于痛舒胶囊开发的成功经验,作者探索提出民族药创新发展路径(见图1),即,开展民族民间用药经验及疗效的调研,筛选出疗效较好的经验方;对组方中的药用植物进行基原调研;按确定的中药新药申报目标,基于现代科学手段完成成药性评价,并进一步完成民族药新药创制研究;进行新药创制成果的产业化;选择市场反馈较好的品种,开展与国际接轨的各项关键技术研究,争取实现国际化。需要注意的是,在上述路径中,基础研究与成果经济效益的实施相互促进,因而,实现经济效益后需进一步对基础研究平台进行维护提升,形成良性循环,不断促进民族药创新发展。

图1 民族药创新发展路径示意图
5 讨论
5.1 我国民族药产业发展水平低、研发能力有待提高
我国民族药产业从整体上看发展水平较低,企业研发能力不足。现有的民族药品种中,相当数量为传统剂型,《中华人民共和国药典》(2015 年版)收录民族药成方制剂品种39 个,32 个品种剂型为丸、散、膏、丹[7];药效物质基础研究薄弱导致缺乏有效的质量控制手段;作用机理不清,以及产品功效与现代疾病的关系缺乏有效验证,阻碍产品市场推广;现有民族药企业大部分规模小,创新能力严重不足,多数企业没有自主研发的产品[8-9]。总之,我国民族药产业发展水平低,研发能力有待提高。民族药企业应转换发展意识,加大技术和资金投入,提高自主研发创新能力;同时,通过加强产学研合作,将科研成果切实转化为生产力,促进民族药产业的创新发展。
5.2 以民族药知识及应用经验为导向是民族药新药研发的重要途经
民族传统药物是人类最早应用的药物[10],其有效性及用药经验已得到数百乃至数千年的实践证明,在民族民间传统应用的基础上对民族药进行有目的的系统筛选和新药开发具有极大的可能性,可节约新药开发的时间、人力及资金成本。例如,苗药灯盏花系列新药(灯盏花素片、灯盏花素注射液、益脉康片、灯盏细辛注射液)的成功研制,正是基于对云南省文山州丘北县罗姓苗族老医生的献方辅以现代研究手段开发的创新型新药[11];本文举例痛舒胶囊的开发也是基于此思路。灯盏花系列新药及痛舒胶囊的成功研制是典型的以民族药知识及应用经验为导向的新药开发实例。
5.3 产业化过程中民族药企业知识产权保护意识亟待提高
目前,民族药产业化过程中主要存在对知识产权保护意识不强的问题,突出表现在以下三方面:①民族药生产企业间同品种低质量仿制严重,重复生产现象明显[12];②多数民族药产品专利质量不高,难以达到有效维权目的[13];③企业就“专利保护”与“中药品种保护”选择避难就易[14],严重阻碍了民族药的市场扩大、占有率及创新水平的提高,影响民族药产业的健康发展。因此,民族药生产企业应自我增强对知识产权保护与利用的意识,针对民族药复方的特征,提高技术创新,有效保护民族药的合法权利,以“专利法”为核心,结合行政保护手段,有效保障生产企业获得相应利益,推动民族药产业内在创新和发展。
5.4 融合创新推进民族药国际化进程
民族的就是世界的,造福我国数千年的传统医药应该走向世界,与全人类共享其文明成果,但传统医药国际化道路仍任重道远,如何尊重传统医药复方制剂的特点,并且能够按国际金标准科学要求获批注册仍是瓶颈问题。传统医药在FDA 法规下的研发实践是一个不断深入、不断完善的过程,是与FDA 不断沟通、不断理解的过程,更是一个双方共同全面创新、保证产品质量的系统工程[15]。目前,云南省药物研究所正采用FDA 最严格的标准,不断引入多项创新,证明痛舒胶囊的安全性、有效性和质量可控性。在与FDA沟通的过程中,研究团队体会到FDA 鼓励民族植物药进入美国市场,对植物药审评持灵活、开放的态度,在具体问题上与申办方共同探索,可以争论,正如前FDA 官员孙鹤所说:“他们的工资是由纳税人提供的,其责任就是帮助纳税人在全球范围内找到更好的、更有价值的药品。”但是,对于研究方案设计等方面的要求则与化学药一样严格。FDA 对植物药审评表现出的灵活性、开放性,能够科学对待植物药的国际化拓展,这也为我国中药、民族药的国际化增加了信心。
