凡纳滨对虾多酚氧化酶的纯化及性质分析
2019-04-19鲍俊旺张凌晶孙乐常曹敏杰
鲍俊旺,李 越,翁 凌,2,张凌晶,2,孙乐常,2,曹敏杰,2
( 1.集美大学食品与生物工程学院,福建 厦门 361021;2.水产品深加工技术国家地方联合工程研究中心,福建 厦门 361021)
0 引言
凡纳滨对虾(Litopenaeusvannamei),通称白对虾(white shrimp),是世界上养殖量最大的三大虾类之一。凡纳滨对虾肌肉中含有多种人体必需氨基酸,而含量最高的是与呈味性质相关的谷氨酸,其次还含有大量的精氨酸及天冬氨酸。此外,对虾肌肉中还含有不饱和脂肪酸,其中促进人脑智力发育的二十碳五烯酸(eicosapentaenoic acid,EPA)、二十二碳六烯酸(docosahexaenoic acid,DHA)的相对含量在脂肪酸总量中占比近20%[1]。同时,由于凡纳滨对虾具有生长迅速、环境适应能力强以及肌肉含量高的特点,因此,它在我国沿海地区占有相当大的海水以及淡水养殖份额。广东省、广西省、浙江省、福建省等水温水质适宜的省份,已成为我国凡纳滨对虾的重要养殖地和出产地[2]。2016年,我国凡纳滨对虾的养殖总产量达167万t[3]。
然而,对虾死后常出现由体内多酚氧化酶(polyphenol oxidase,PPO)作用所引起的黑变现象。黑变现象不仅严重影响了对虾的感官品质和新鲜程度,也大幅降低了其商品价值。据研究,对虾肝胰腺中的丝氨酸蛋白酶在对虾死后因肝胰腺破裂而释放,导致无黑变效应的酚氧化酶原(prophenol oxidase,proPO)在丝氨酸蛋白酶的作用下转化为具有活性的PPO[4-5]。PPO是一种以铜离子为催化中心的金属氧化酶,可将单酚类物质氧化为双酚类物质,而双酚类物质可被进一步氧化,生成具有颜色的醌类物质。这些醌类物质与蛋白质或氨基酸相结合,产生肉眼可见的黑色物质,即为引起对虾黑变的主要原因[6]。
对于虾类体内PPO的研究已有很多报道,如:Simpson等[7]利用亲和层析法从白对虾(Penaeussetiferus)分离获得分子质量为30 ku的PPO;Benjakul等[8]从日本对虾(Penaeusjaponicus)体内分离得到分子质量为160 ku的PPO;Zamorano等[9]从长额拟对虾(Parapenaeuslongirosteis)中分离的PPO分子质量为200 ku;Lai等[10]利用分子克隆技术从凡纳滨对虾中克隆了PPO基因全序列,并推测该酶的分子质量为78.1 ku。综合国内外的研究结果,来源于不同种类的对虾的PPO分子质量在30~200 ku不等,差异很大。更值得关注的是,从蛋白质水平对PPO的研究没有解决其结构问题,而从基因水平的研究则缺乏酶学性质的分析。鉴于PPO在对虾保鲜加工中的重要作用,有必要对其理化性质做更加深入全面的解析。因此,本研究采用盐析、DEAE-Cellulose、Phenyl-Sepharose HP、Hi-Trap Capto-Q等多种柱层析方法将凡纳滨对虾PPO进行分离纯化,利用质谱技术对PPO的一级结构进行解析,探讨不同温度、pH值、抑制剂对其活性的影响,并对其二级结构作了分析,以期为进一步阐明凡纳滨对虾PPO的特性并有效抑制对虾的死后黑变提供理论参考。
1 材料与方法
1.1 材料、试剂与仪器
鲜活凡纳滨对虾(L.vannamei),购于厦门集美菜市场。清水洗净后,置于冰水中猝死,取虾头用于实验。
DEAE-Cellulose,美国Whatman公司产品;Phenyl Sepharose HP、Hi-Trap Capto-Q,美国GE Healthcare公司产品;蛋白质标准品,立陶宛 Fermentas 公司产品;左旋多巴(L-Dopa),美国Aladdin公司产品;茶多酚(Tea Polyphenols/GTP),上海 EKEAR公司产品。其他试剂均为国产分析纯(AR)。
组织捣碎机PT-2100(Kinematica,瑞士);高速冷冻离心机(Avanti JA-26.5 Beckman,美国);凝胶成像仪(G-BOX Syngene,英国);圆二色光谱仪(Chirascan Applied Photophysics,英国);恒温水浴锅(Memmert,德国);pH计(Sartorius,德国)。
1.2 实验方法
1.2.1 凡纳滨对虾PPO的分离纯化
原料的前处理方法参照Nirmal等[12]的方法作适当修改,取0.5 kg对虾头部剪碎,加入到5倍虾头质量的冰冷50 mmol/L 磷酸缓冲液(PBS,pH =7.2)中,用组织捣碎机充分捣碎,加入体积分数0.2%Triton X-100促溶,搅拌静置后离心(12000g,30 min)。所获得的上清溶液进行0~40%饱和浓度的硫酸铵盐析,离心取沉淀。将沉淀用适量的50 mmol/L PBS(pH=7.2)溶解后装入透析袋中对相同缓冲液充分透析。用DEAE-Cellulose(2.5 cm×15 cm)阴离子交换柱进行分离,并以含0~0.5 mol/L NaCl的50 mmol/L PBS(pH=7.2)溶液进行线性洗脱,同时测定每个组分中的酶活力及蛋白质含量(A280)并收集PPO酶活力较高的组分(粗酶液)。
向粗酶液中加入等体积的1 mol/L (NH4)2SO4,搅拌混合均匀后用0.22 μm膜抽滤。上样于Phenyl-Sepharose HP(5 mL)疏水层析柱,先用含有0.2 mol/L (NH4)2SO4的缓冲液进行洗脱,后用含0.2~0 mol/L (NH4)2SO4的缓冲液进行线性洗脱,测定每个组分中的酶活力及蛋白质含量,收集酶活力较高的组分。将收集的组分用50 mmol/L PBS(pH=7.2)透析,0.22 μm膜抽滤,上样于Hi-Trap Capto-Q(5 mL)阴离子交换柱,用含0~0.5 mol/L NaCl的50 mmol/L PBS(pH=7.2)进行线性洗脱。测定各组分的酶活力及蛋白质含量,收集酶活力较高的组分,用SDS-PAGE鉴定其纯度。
1.2.2 PPO的活力测定
PPO的活力测定参照Chen等[13]的方法略作修改。以左旋多巴(L-Dopa)为底物,将50 μL粗酶液加入500 μL含底物L-Dopa(15 mmol/L)的缓冲液(pH=6.0)中,在40 ℃下反应10 min,用紫外分光光度计迅速测定反应液在475 nm处的吸光度值。PPO作用于底物后,在475 nm处释放出有最大吸光度的物质,以该物质的浓度来衡量该条件下酶活力的大小。在上述条件下,将每分钟催化底物使反应体系吸光度值增加0.001所需要的酶量定义为一个酶活力单位。
1.2.3 SDS-PAGE
采用聚丙烯酰胺质量分数为7.5%的凝胶进行SDS-PAGE分析,电泳结束后进行硝酸银染色,用凝胶成像仪记录染色后的结果。
1.2.4 PPO的多巴活性染色
PPO活性染色的方法参照Nirmal[11]的方法略作修改。在不加热粗酶液样品的前提下,于4 ℃下进行Native-PAGE。电泳后,将凝胶与底物在40 ℃下孵育30 min。由于固定在凝胶上的PPO与L-Dopa反应将产生黑色物质,因此在凝胶相应的位置上会出现黑色条带。
1.2.5 PPO的肽指纹质量图谱分析
纯化的PPO样品进行聚丙烯酰胺质量分数为7.5%的SDS-PAGE分析,用质谱银染法进行染色。将样品使用胰蛋白酶酶解处理后,使用串联飞行时间质谱仪(5800 MALDI-TOF/TOF,AB SCIEX)进行测试分析,设置激光源为Nd:YAG 激光器(波长335 nm),加速电压为2 kV,扫描范围为800~4 000 u,采用正离子模式和自动获取数据的模式采集数据。其中,一级质谱(MS)中选择8个信噪比大于50的母离子进行二级质谱(MS/MS)分析,二级质谱(MS/MS)激光累计叠加2500次。
质谱结果用Mascot 2.2软件在NCBI数据库检索,最后得到鉴定的蛋白质结果,根据Mascot 2.2标准(P<0.05)对目的蛋白进行评分。
1.2.6 PPO的最适温度和热稳定性
PPO最适温度的测定在0~80 ℃下分别进行,按照节1.2.2描述的酶活力测定方法进行测定。而PPO的热稳定性测定,是将PPO置于0~80 ℃下(每10 ℃一个间隔)孵育30 min后,恢复至室温,再测定酶活力。
1.2.7 PPO的最适pH值及pH值稳定性
PPO的最适pH值及pH值稳定性的测定参照蒋经伟等[14]的方法略作修改。最适pH值的测定方法为:在40 ℃下,于不同pH值的缓冲液中加入终浓度为15 mmol/L的L-Dopa,测定PPO在不同pH值反应条件下的活力。pH 值稳定性的测定方法为:将纯化的酶液置于pH=3.0~9.0的一系列缓冲液中孵育30 min后,取出少量酶液置于pH=6.0的缓冲液中,测定其酶活力。
1.2.8 PPO的圆二色谱测定
将纯化的PPO溶液超滤浓缩,调整其蛋白质质量浓度至0.2 g/L,放入0.2 cm光径长度的比色皿中进行圆二色谱分析。设置波长范围为190~260 nm,步进值为1.0,带宽为1 nm,单点扫描时间为0.5 s,温度为20 ℃,对同一样品重复测量3次。
1.2.9 抑制剂对PPO活性的影响
将酶液置于pH=6.0的缓冲液中,加入不同的抑制剂至相应终浓度,在37 ℃下孵育30 min。在孵育后的体系中加入底物L-Dopa 至终浓度为15 mmol/L,反应30 min后,测定酶活力。
2 结果与讨论
2.1 PPO的分离纯化
图1为对虾PPO分离纯化的柱层析图谱。由图1a可知,样品经过DEAE-Cellulose阴离子交换柱后,去除了大量未吸附杂蛋白质,而以L-Dopa为底物的具有活性的对应组分被吸附。采用含0~0.5 mol/L NaCl的50 mmol/L PBS (pH=7.2)对上述组分进行线性洗脱,收集活性组分并加入(NH4)2SO4固体至终浓度为1 mol/L,之后对该溶液进行Phenyl-Sepharose HP疏水柱层析。样品经过Phenyl-Sepharose HP柱层析的结果如图1b所示。经0.2 mol/L (NH4)2SO4缓冲液阶段洗脱,去除了大量的未吸附杂蛋白质。将目的蛋白用浓度为0.2~0 mol/L的(NH4)2SO4进行线性洗脱,收集活性组分进行Hi-Trap Capto-Q强阴离子交换层析。样品经过Hi-Trap Capto-Q层析的结果如图1c所示,目的蛋白与杂蛋白得到了有效分离,且酶活力峰与其中一个蛋白质峰重叠,说明该蛋白质峰为具酶活力的主要组分。
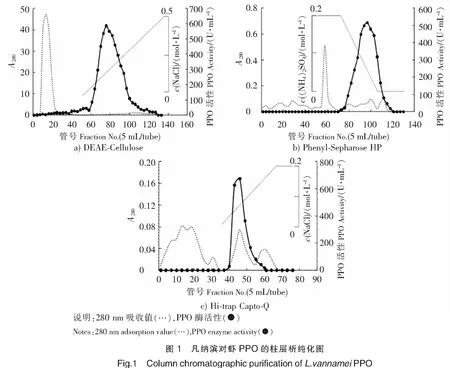
将经过Hi-Trap Capto-Q纯化后的组分进行SDS-PAGE、Native-PAGE及多巴活性染色分析,其结果如图2所示,可见,SDS-PAGE及Native-PAGE中均显示单一条带,表明本研究中的PPO得到了纯化,其分子质量约为210 ku。纯化后的PPO经活性染色处理后,对应的条带位置与Native-PAGE的条带位置一致,进一步说明所得到的物质为PPO。相比于前期对PPO的研究结果报道,本文所获得的PPO分子质量不同于Simpson等[7]从白对虾(Penaeussetiferus)分离的PPO(30 ku)和Benjakul等[8]从日本对虾(Penaeusjaponicus)中获得的PPO(160 ku),而与Zamorano等[9]从长额拟对虾(Parapenaeuslongirosteis)中分离的PPO(200 ku)相似。
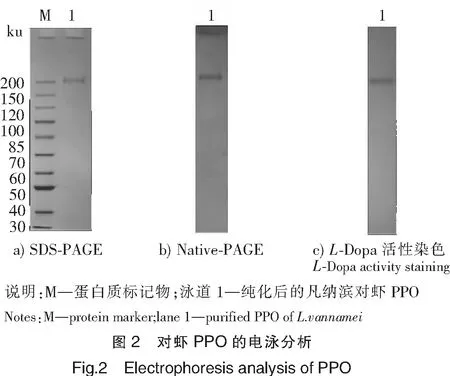
为了获得PPO的一级结构信息,对纯化PPO进行质谱分析。选择一级质谱结果中信噪比大于50的肽段进行MS/MS分析,二级质谱结果如图3所示,共得到14个肽段,含有187个氨基酸残基(见表1)。将MS/MS分析结果与NCBI数据库中的蛋白质序列进行比对发现,与凡纳滨对虾(L.vannamei)的酚氧化酶原(gi|147724160)的序列相似性为100%(见图4),进一步证明纯化的酶为酚氧化酶。但是,酚氧化酶原全长仅为690个氨基酸残基(见图4),推测分子质量为78.5 ku,远低于SDS-PAGE所显示的210 ku(图2)。分析原因,可能是由于PPO易生成难于被SDS化解离的多聚体而导致的。Zamorano等[9]利用活性染色法对长额拟对虾PPO的研究发现了分子质量为500 ku的条带,表明PPO易形成多聚体。在本文中,仅图2a的样品经非还原的SDS化,而图2b、图2c的样品均未经加热处理,PPO仍可能以多聚体的形式存在,详细原因有待进一步分析。

表1 二级质谱所获得的肽段序列
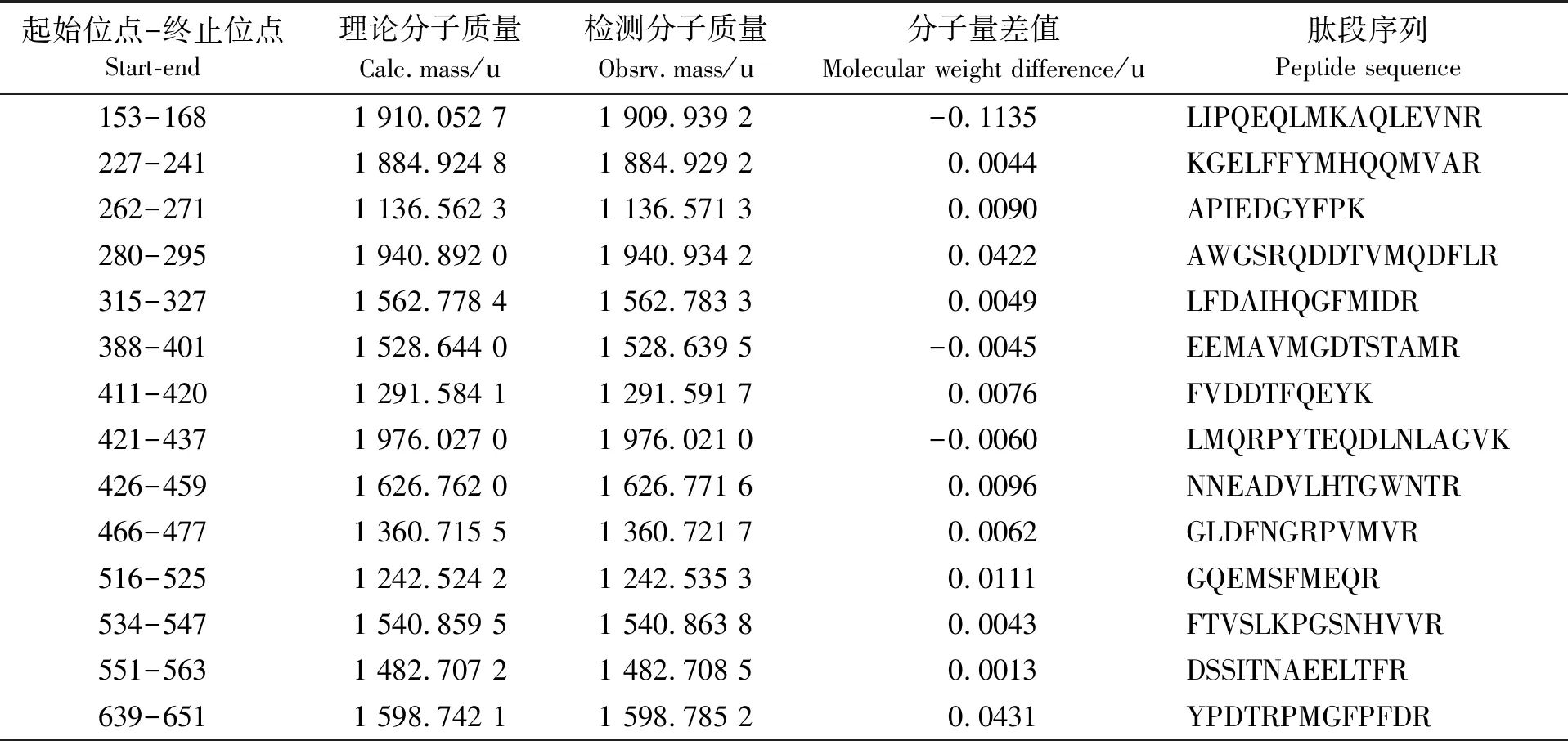
起始位点-终止位点Start-end理论分子质量Calc.mass/u检测分子质量Obsrv.mass/u分子量差值Molecular weight difference/u肽段序列Peptide sequence153-1681 910.052 71 909.939 2-0.1135LIPQEQLMKAQLEVNR227-2411 884.924 81 884.929 20.0044KGELFFYMHQQMVAR262-2711 136.562 31 136.571 30.0090APIEDGYFPK280-2951 940.892 01 940.934 20.0422AWGSRQDDTVMQDFLR315-3271 562.778 41 562.783 30.0049LFDAIHQGFMIDR388-4011 528.644 01 528.639 5-0.0045EEMAVMGDTSTAMR411-4201 291.584 11 291.591 70.0076FVDDTFQEYK421-4371 976.027 01 976.021 0-0.0060LMQRPYTEQDLNLAGVK426-4591 626.762 01 626.771 60.0096NNEADVLHTGWNTR466-4771 360.715 51 360.721 70.0062GLDFNGRPVMVR516-5251 242.524 21 242.535 30.0111GQEMSFMEQR534-5471 540.859 51 540.863 80.0043FTVSLKPGSNHVVR551-5631 482.707 21 482.708 50.0013DSSITNAEELTFR639-651 1 598.742 11 598.785 20.0431YPDTRPMGFPFDR

2.2 凡纳滨对虾PPO的性质分析
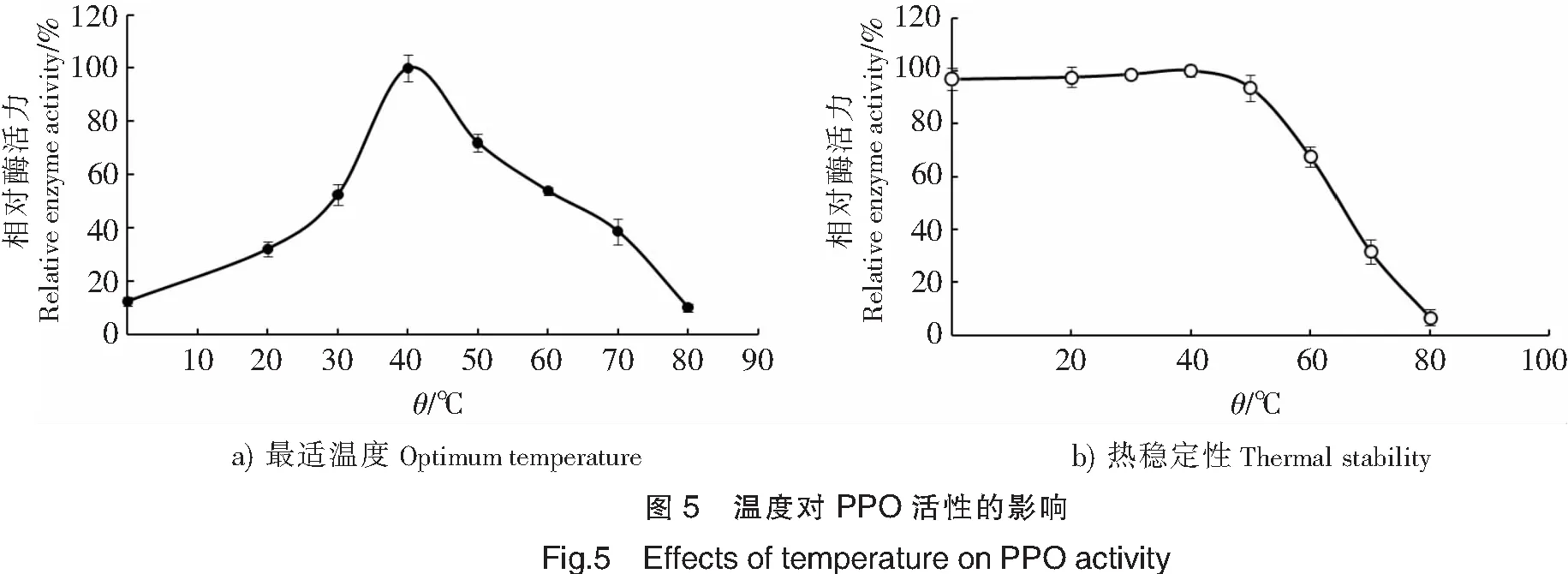
2.2.1 PPO的最适温度和热稳定性
由图5a可见,PPO的最适温度为40 ℃。对PPO热稳定性的测量结果如图5b所示,由图5b可见,在0~40 ℃下,酶活力基本保持不变,当温度高于40 ℃时,酶活力呈现明显的下降趋势,并于80 ℃时消失。PPO的最适温度为40 ℃,与挪威海龙虾(Nephropsnorvegicus)[6]、中国对虾(Fenneropenouschinesis)[15]、日本对虾的PPO最适温度一致[17],高于长额拟对虾(Parapenaeuslongirosteis)[10]PPO的最适温度(30 ℃)。在热稳定性方面,PPO在0~50 ℃下保持相对稳定,当温度高于50 ℃时,酶活力迅速下降。
2.2.2 PPO的最适pH值和pH值稳定性
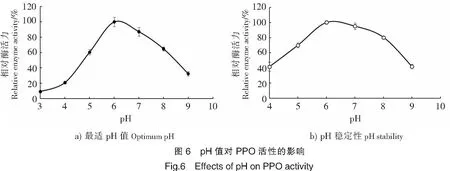
由图6a可知,PPO的最适pH值为6.0,随着体系中pH值的下降或升高,其酶活力均呈下降趋势。当pH>8.0或pH<6.0时,酶活力下降十分明显。
体系中的pH值对PPO稳定性的影响结果如图6b所示。在pH=5.0~8.0较为稳定,相对活性保持在70%以上。当pH<5.0或pH>8.0时,酶活力开始下降。
2.2.3 PPO的圆二色谱分析
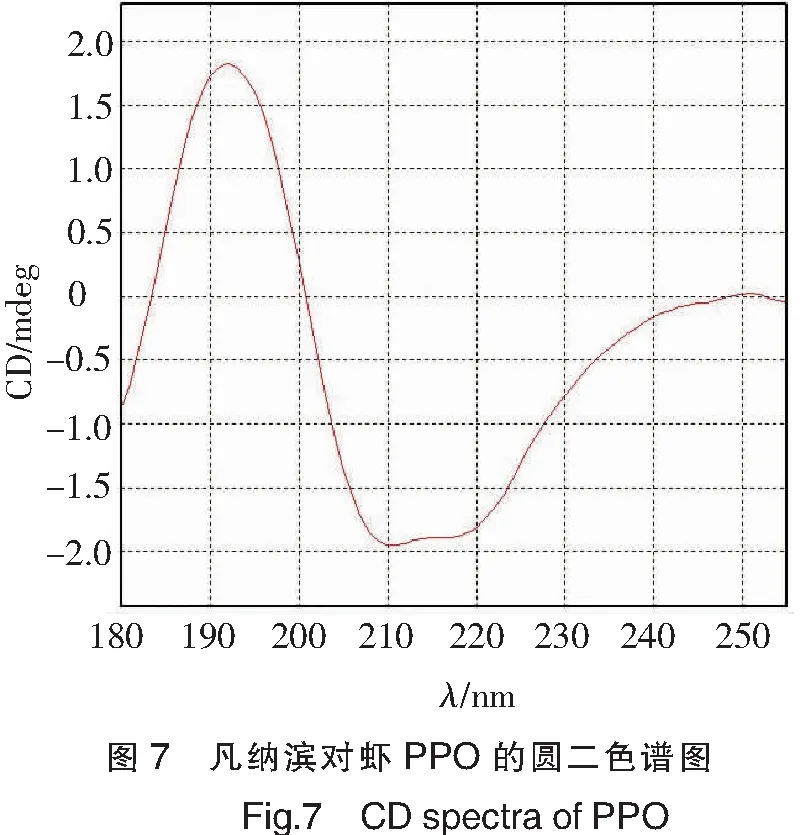
圆二色谱扫描结果如图7所示。通过软件分析180~260 nm部分的数据,PPO的主要二级结构为反平行β折叠和无规则卷曲。其中,反平行β折叠占33.6%,无规则卷曲占28.2%,β转角占19.6%,α螺旋占13.6%,平行结构占4.6%。蛋白质分子中,α螺旋结构、β折叠作为维持蛋白质结构稳定性的重要组成部分,其在蛋白质结构中所占比例在很大程度上影响该蛋白质的稳定性。凡纳滨对虾PPO中α螺旋和β折叠结构占比为47.2%,比其他能够保持较好稳定性的蛋白质如原肌球蛋白[16]低,因此,对应了其对温度、pH值较为敏感的表现。
2.2.4 抗坏血酸对PPO的抑制作用
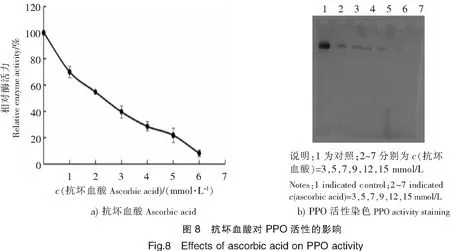
不同浓度的抗坏血酸对PPO活性的抑制作用结果如图8所示。由图8a可以看出,随着体系中抗坏血酸浓度的逐渐上升,PPO活力逐渐下降,当抗坏血酸浓度达到6 mmol/L时,PPO的活力几乎完全丧失。同样结果也可从图8b的活性染色中得到,当蛋白质条带经不同浓度的抗坏血酸孵育后,随着浓度的上升,活性染色显示出的条带颜色也在逐渐消退。当抗坏血酸浓度达到15 mmol/L时,该条带基本消失,进一步说明抗坏血酸对PPO的活性具有抑制效果。
2.2.5 茶多酚对PPO的抑制作用
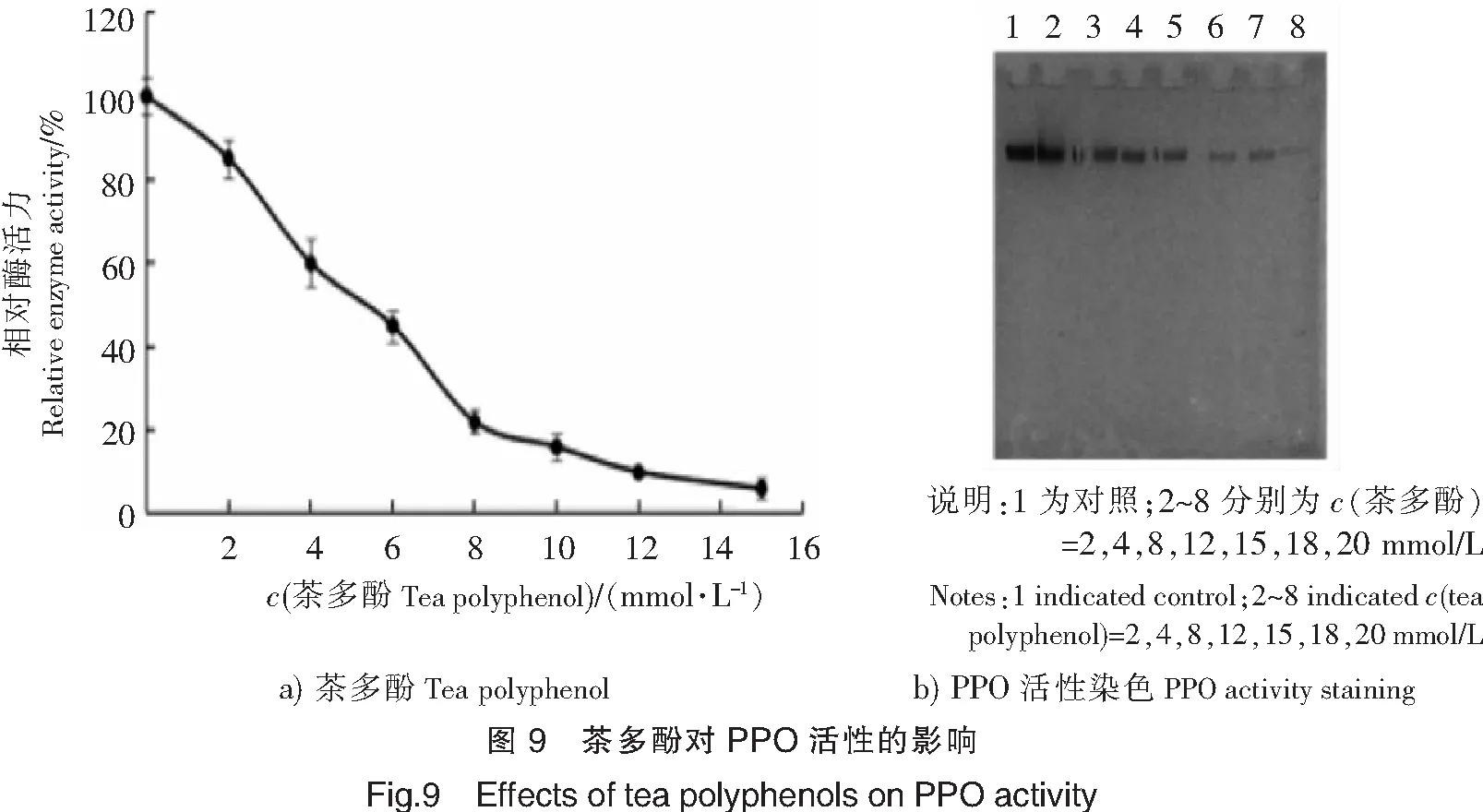
不同浓度的茶多酚对PPO活性的抑制作用结果见图9。由图9a可知,随着茶多酚浓度的逐渐上升,PPO的活力逐渐下降,当茶多酚浓度达到15 mmol/L时,PPO的活力基本丧失。图9b的活性染色也反映了同样的结果,当茶多酚浓度达到16 mmol/L时,相对酶活力下降至20%,说明茶多酚对PPO的活性具有良好的抑制效果。
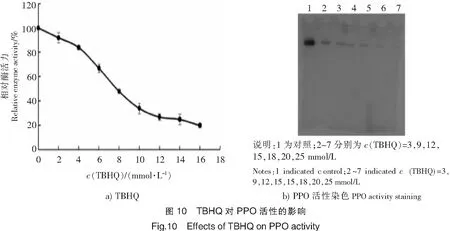
2.2.6 TBHQ对PPO的抑制作用
由图10a可知,随着TBHQ浓度的上升,PPO的相对活力逐渐下降。从图10b的电泳分析结果也可以看出,随着溶液中TBHQ浓度的上升,对应条带逐渐变淡,当TBHQ浓度达到20 mmol/L时,该条带基本消失。进一步说明TBHQ浓度与PPO抑制效果之间的正相关性。
阻止或延缓对虾在冷藏过程中黑变的发生是提升其商品价值的重要手段。实际生产中,低温并添加可抑制黑变的食品添加剂是主要做法。因此,本研究选择抗坏血酸、茶多酚和TBHQ等3种常见并符合国家要求的食品添加剂对PPO的活力影响进行研究。结果表明,PPO对抗坏血酸的浓度较为敏感,6 mmol/L的抗坏血酸对PPO的活性抑制率高达91.7%,这与樊廷俊等[15]的研究结果基本一致。茶多酚对该酶的活性具有一定的抑制作用,15 mmol/L的茶多酚对PPO的活性抑制率高达94.0%。Nirmal等[12,17]的研究表明,当儿茶酚作为PPO的抑制剂时,其反映出的混合型抑制性质表明,其对PPO及其底物复合物均有着较强的结合作用。TBHQ对PPO的活性亦产生一定的抑制作用,当TBHQ的浓度达到15 mmol/L时,其对PPO的抑制率达77%。但TBHQ是脂溶性物质,几乎不溶于水,影响了其在对虾保鲜中的实际使用。最近,Sun等[18]报道了利用酸性电解水抑制对虾黑变,其原理是酸性电解水以混合型抑制方式抑制了PPO的活性,并使PPO蛋白质结构中α螺旋比例下降而无规则卷曲比例增加,从而达到破坏PPO构象的效果。
3 结论
利用现代分离技术从凡纳滨对虾中分离获得高纯度PPO。PPO的分子质量为210 ku,可能以多聚体的形式存在,其最适温度和最适pH值分别为40 ℃和6.0。该酶的二级结构以反平行β折叠和无规则卷曲为主,占61.8%。食品添加剂抗坏血酸、茶多酚等对其活性有良好的抑制效果。
