腐植酸对香根草吸收和去除扑草净的影响
2019-04-16贾继维李鑫圆孙仕仙
贾继维 张 坤 李鑫圆 孙仕仙
( 1. 西南林业大学生态与水土保持学院,云南 昆明650224;2. 云南农业大学植保学院,云南 昆明 650201;3. 西南林业大学湿地学院,云南 昆明650224;4. 西南林业大学风景园林学博士后流动站,云南 昆明 650224)
扑草净为均三氮苯类选择性除草剂,化学名称为 4, 6-双异丙胺基-2-甲硫基-1, 3, 5-三嗪,分子式为C10H19N5S[1],被广泛应用于农田中杂草和水产养殖中藻类的去除[2]。扑草净化学性质稳定,在水体、土壤和植物体中残留期长[2],也可通过渗透进入地下水,在水生动物及植物体内富集[3],通过食物链进入人体,使人体内分泌紊乱,对人体健康危害极大[4]。目前扑草净污染的修复方法多为微生物修复[5-6],植物修复因其低成本,环境友好,适应范围广而逐渐受到关注[7],但是关于影响扑草净修复效果的研究较少。
香根草(Vetiveria zizanioides)是一种两栖植物[8],被认为是“世界上具有最长根系的草本植物”[9]。香根草已被发现是一种抗逆性很强的植物,它对酸、碱、盐、贫瘠、重金属等都表现出了较强的抗性[10-11],尤其是香根草被发现对有机和无机污染物都具有极高的亲和力[12-14]。目前,香根草被广泛应用在病虫害绿色防控、园林绿化、水土保持、工程保护和污染治理等方面[15-18],是具有修复潜力的优势植物。
腐植酸是动植物遗骸经过微生物的分解和转化,以及地球化学的一系列过程造成和积累起来的一类大分子有机物质,其中含有大量的极性基团,对金属离子有较强的吸附性能和络合能力[19-20],广泛存在于各类型水域中,是影响环境生态平衡的重要因素,也是潜在的、可大力开发和综合利用的有机资源[21]。近年来,腐植酸的开发利用工作取得了长足进步,研究发现使用腐殖酸可以促进植株对氮素的累积和提高氮肥的利用率[22],降低土壤对钾素的固定量进而提高植物对钾的利用率[23],可以加速植被生长,增强植物抗性[24-25]。现在腐殖酸也被广泛应用于重金属污染的去除效果研究[19,26]。而腐殖酸对植物吸收积累农药的效果的影响研究鲜有报道。
根据课题组前期研究结果,香根草能够显著提高营养液中扑草净的去除率[27]。本研究试图探索腐殖酸对香根草吸收和去除水体中扑草净的影响,以期能够增加腐殖酸开发利用,同时为植物修复水体中农药污染提供基础数据。
1 材料与方法
1.1 实验材料
1.1.1 药品与试剂
扑草净(色谱纯,中国农药部),乙酸乙酯(色谱纯,赛默飞世尔科技有限公司),乙腈(色谱纯,赛默飞世尔科技有限公司),正己烷(色谱纯,赛默飞世尔科技有限公司),无水硫酸钠(分析纯,天津市风船化学试剂科技有限公司)。
1.1.2 实验植物
实验用香根草由云南光宝生物技术有限公司提供。实验开始前以(200±0.5)g为一组预培养1周。
1.2 实验设计
设置4组实验,第1组不种植香根草,不添加腐植酸;第2组不种植香根草,添加腐植酸;第3组种植香根草,不添加腐植酸;第4组种植香根草,添加腐植酸。每个处理设置3个重复。所有处理的扑草净初始浓度为0.5 mg/L,腐殖酸初始浓度为200 mg/L,统一使用铵态氮营养液为培养液,每个桶以称量法称取2 L营养液。所有处理栽培管理条件一致。
1.3 样品采集与处理
1.3.1 采样方法
于植入扑草净的当天(第0天),第6天,第12天,第18天,第24天,第30天分别取水样和植物。每次采样前先对培养桶及桶中剩余营养液称量,用质量差法测定蒸腾耗水量,然后用铵态氮营养液补充到初始溶液量。用玻璃注射器准确取70 mL水样。将采得的水样带回实验室,用脱脂棉过滤后,待提取。
每桶香根草叶茎和根系各采集(5.0±0.5)g。取回样品后,与实验室内用去离子水洗净,滤纸干燥,再将其剪成2~3 mm的碎片,待用。
1.3.2 提取方法
水样提取:准确量取50 mL已过滤的水样,加入50 mL乙酸乙酯,用分液漏斗将水样和乙酸乙酯混匀后静置2~3 min,待液体分层后,将乙酸乙酯层转移,再加入50 mL乙酸乙酯重复提取1次,最后将萃取液(乙酸乙酯层)合并,过无水硫酸钠,转移至旋转蒸发瓶中,于40 ℃水浴旋转蒸发至干,用3 mL正己烷溶解,过0.45 μm有机相滤膜,待测。
植物样提取:称取2 g植物样品(精确到0.01 g),转移至100 mL具塞锥形瓶中,加入40 mL乙腈和适量无水硫酸钠,盖上瓶盖,于超声清洗机中超声40 min,滤入250 mL平底烧瓶中,再用20 mL乙腈重复提取1次,合并提取液,于40 ℃水浴中旋转蒸发至干,用3.0 mL正己烷溶解,过0.45 μm有机相滤膜,待测。
1.4 测定仪器及条件
用GC-MS(Agilent 7890B-5977MSD)进行定性和定量分析。仪器工作条件:气相色谱参数:色谱柱HP-5MS毛细管色谱柱(30 m×0.32 mm i.d.×0.25 μm);进样口温度260 ℃;不分流进样,进样量为1 μL;载气为氦气(纯度大于99.999%),流量为1.0 mL/min;柱程序升温:初始温度70 ℃,保持1 min;以25 ℃/min速率升至180 ℃;再以5 ℃/min速率升至220 ℃;最后以20 ℃/min速率升至280 ℃,保持3 min。
质谱条件电子轰击离子源(EI),电子能量70 eV,离子源温度230 ℃;接口温度280 ℃,四极杆温度150℃;溶剂延迟时间为3.75 min;扫描方式为全扫描模式(SCAN)与选择离子监测模式(SIM)同时进行,SCAN扫描范围(m/z) 50~350,SIM监测离子为m/z 241,184,226,199 ;定量离子m/z 184。
2 结果与分析
2.1 扑草净标准溶液的配制及标准曲线
用电子天平准确称取200 mg扑草净标准品,用乙酸乙酯溶于200 mL容量瓶,得1000 mg/L扑草净标准储备液。然后用正己烷逐级稀释为1.0,2.0,4.0, 6.0,8.0,10.0 mg/L 的标准溶液。
按1.4.1仪器工作条件对扑草净标准溶液进行测定,以扑草净的质量浓度为横坐标,对应的色谱峰面积为纵坐标绘标准曲线,见图1。结果表明:扑草净在0~10 mg/L范围内线性良好,线性回归方程为y=273058x-11109,相关系数为0.9998。方法的检出限为0.002 mg/L。
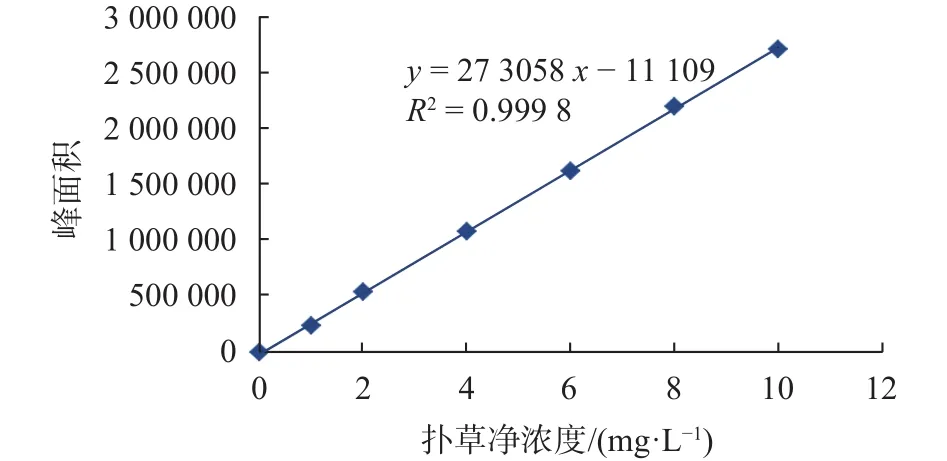
图1 扑草净的标准曲线Fig. 1 The standard curve of prometryn
2.2 加标回收率
取 70 mL空白水样 3份,分别加入0.070、0.056、0.084 mL的1000 mg/L扑草净标准溶液;称取3份2 g植物样品,分别加入0.070、0.056、0.084 mL的1000 mg/L扑草净标液;每个添加水平重复3次,按未加标样品处理步骤和测定方法对加标样品进行处理和测定,测定结果见表1。
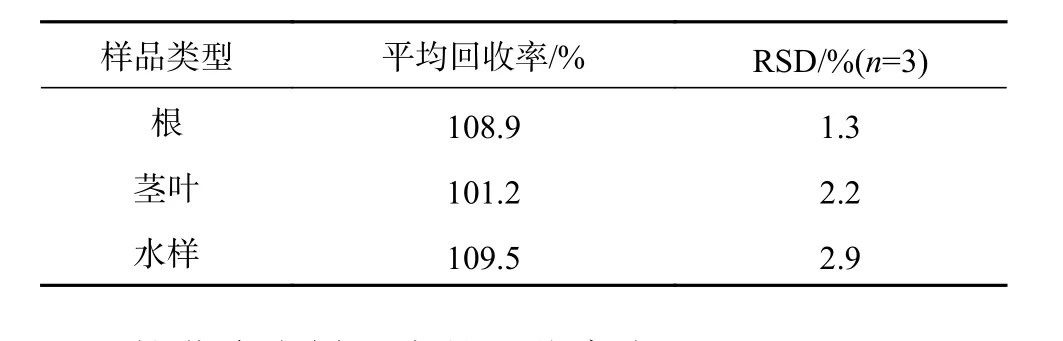
表1 加标回收率Table 1 The adding standard recovery
扑草净在样品中的回收率在91.34%~116.69%之间,平均回收率为107.70%,说明整个样品采集和扑草净的提取过程精密、准确,相对误差较小,该方法能够准确测定水溶液及植物样品中扑草净的浓度。
2.3 营养液中扑草净浓度动态
如图2所示,在所有处理中,扑草净在营养液中的浓度从第0天到第30天显著下降(P<0.01)。前6 d种植香根草和未种植香根草之间,营养液中扑草净浓度没有显著差异(P>0.05)。第6天之后,种植香根草与未种植香根草相比,种植香根草处理的营养液中扑草净浓度比未种植香根草处理显著降低(P<0.01),表明香根草对溶液中扑草净的吸收去除有显著影响。在无香根草组,添加腐植酸和未添加腐植酸处理,扑草净在营养液中的浓度差异不显著(P>0.05),说明腐植酸对水溶液中扑草净的去除作用不显著。种植香根草组,添加腐植酸和不添加腐植酸对扑草净在营养液中的浓度影响不显著(P>0.05),说明腐植酸对香根草吸收去除扑草净的作用影响不显著。
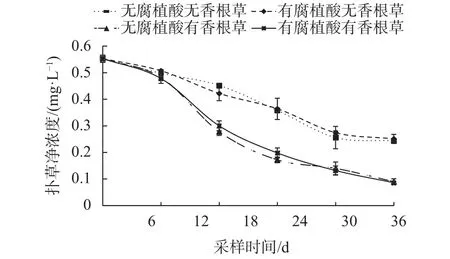
图2 营养液中扑草净随时间变化的残留浓度动态Fig. 2 The concentration of prometryn in nutrient solution changed with time
如图3所示,溶液中扑草净的浓度和采样时间的关系符合一级动力学方程(x为采样时间,y为该时间对应的扑草净浓度)。从扑草净浓度变化的一级动力学方程可以看出,在未种植香根草的两组处理中,添加腐植酸处理的扑草净降解半衰期比未添加腐植酸处理增加了1.21 d,无显著差异(P>0.05)。在种植香根草的两组处理中,添加腐植酸处理的扑草净降解半衰期比未添加腐植酸处理增加了0.24 d,无显著差异(P>0.05),说明腐殖酸不能显著影响香根草对溶液中扑草净的去除效率。综上所述,认为初始浓度为200 mg/L的腐殖酸,不能显著影响扑草净在溶液的自然降解,也不能显著影响香根草对溶液中扑草净的去除。
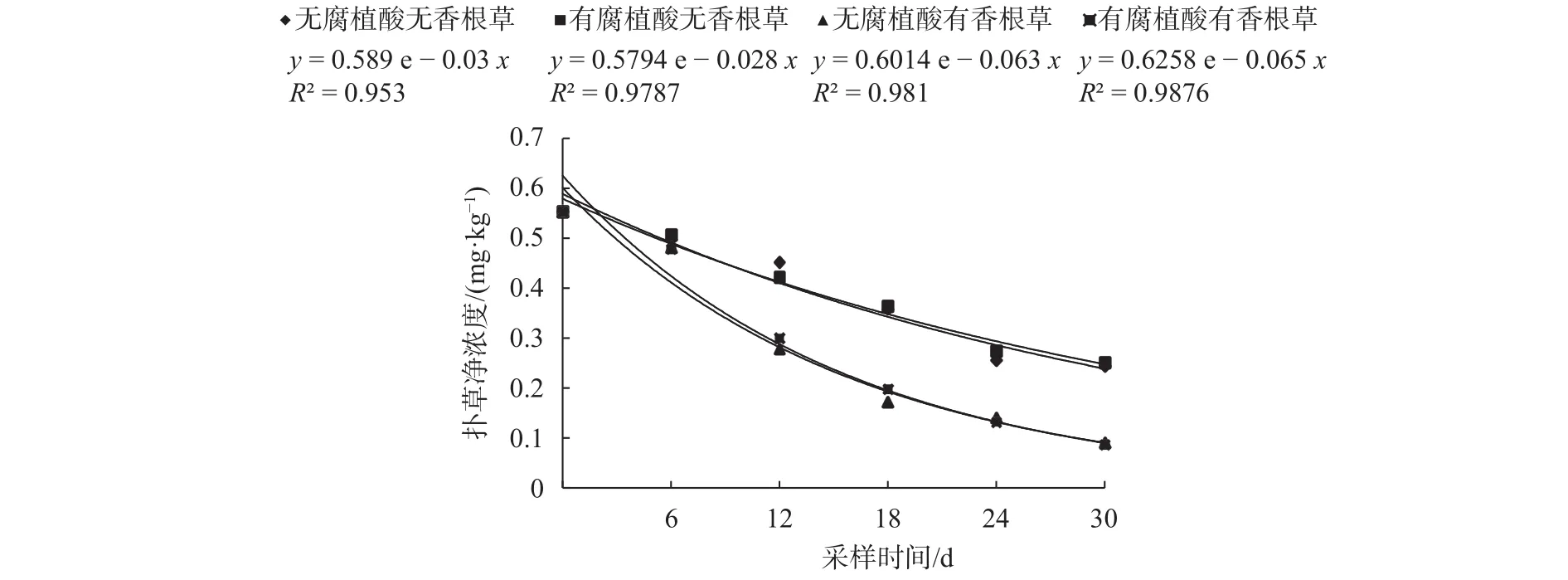
图3 营养液中扑草净随时间变化的去除动态和动力学方程Fig. 3 The dynamic removed equations of prometryn in nutrient solution changed with time
营养溶液中扑草净的去除率随时间变化规律如表2。
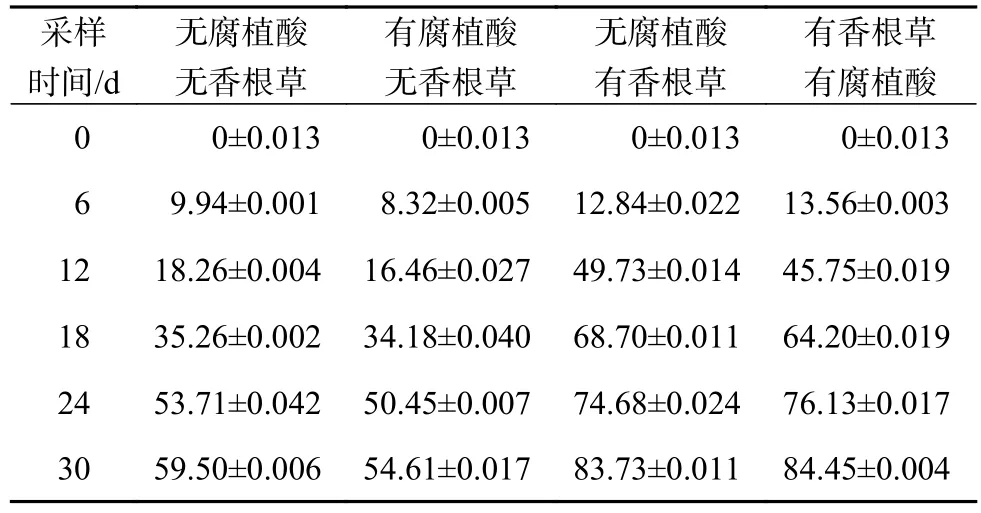
表2 营养液中扑草净的去除率Table 2 The rate of prometryn removal from nutrient solution%
从表2可知:在第30天,未种植香根草的两组处理中,未添加腐植酸的营养液中扑草净去除率为59.50%,添加腐植酸的营养液中扑草净的去除率为54.6%,差异不显著(P>0.05)。种植香根草的两组处理中,添加腐植酸的营养液中扑草净的去除效率为84.5%,比未添加腐植酸的营养液中扑草净的去除效率(83.7%)高0.72%,差异不显著(P>0.05),说明添加腐殖酸对香根草去除营养液中扑草净的效率影响不显著。
2.4 香根草根和茎叶中扑草净的浓度动态
如图4所示,有无腐殖酸的2组处理中,香根草根系中扑草净的浓度变化趋势一致。在实验6~12 d,扑草净在香根草根系中的浓度出现第1个峰值,并且在第6天,无腐殖酸处理组扑草净的浓度显著高于有腐植酸处理组(P<0.01)。第24天时,扑草净在香根草根系中的浓度出现第2个峰值,添加腐植酸的处理中根系中扑草净浓度(1.347 mg/kg)高于未添加腐植酸的香根草根系中扑草净浓度(1.232 mg/kg),但差异不显著(P>0.05)。其余采样时间扑草净浓度在两组不同处理中差异不显著(P>0.05),但添加腐殖酸组扑草净的浓度平均高于未添加腐殖酸组。说明腐植酸能促进香根草根系对营养液中扑草净的吸收。
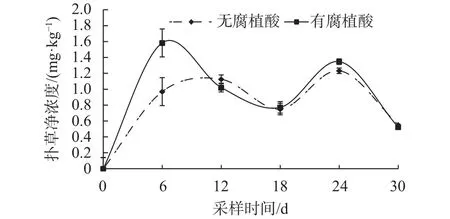
图4 香根草根系中扑草净浓度动态Fig. 4 The kinetic uptake of prometryn by the root of vetiver grass
如图5所示,香根草茎叶扑草净浓度在两组不同处理中变化趋势相一致。在第6天,未添加腐植酸处理的香根草茎叶中扑草净浓度显著高于添加腐植酸的处理(P<0.05),其余几天浓度差异不显著(P>0.05)。但未添加腐植酸处理的香根草茎叶中扑草净浓度全部高于添加腐植酸的处理(第12天浓度相等除外),表明添加腐植酸反而抑制了香根草对扑草净从根系到茎叶的转移。
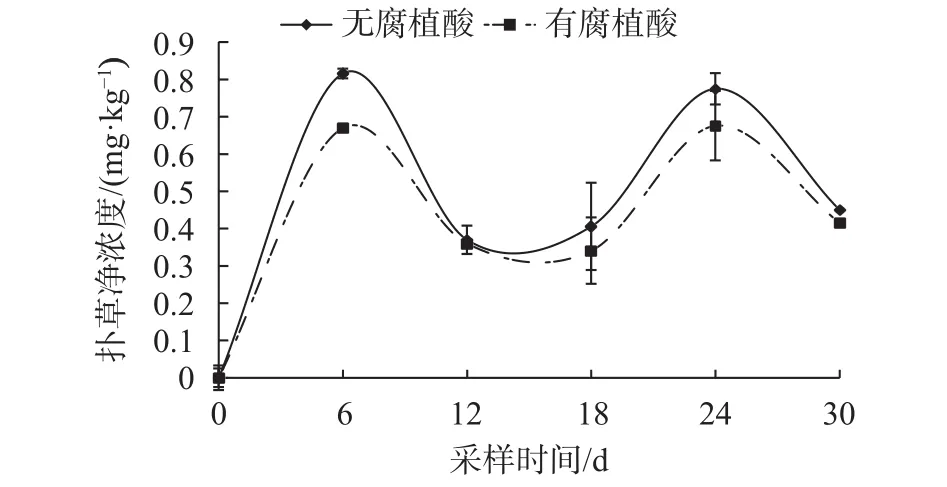
图5 香根草茎叶中扑草净浓度动态Fig. 5 The kinetic uptake of prometryn by the shoot of vetiver grass
扑草净在香根草体内的转移系数(转移系数=茎叶中扑草净的浓度/根中扑草净的浓度)随时间的变化如表3所示。第12天,添加腐植酸组香根草的转移系数高于未添加腐植酸组,其余各天添加腐植酸组香根草的转移系数均低于未添加腐植酸组,说明添加腐植酸抑制了香根草对扑草净从根系到茎叶的转移。
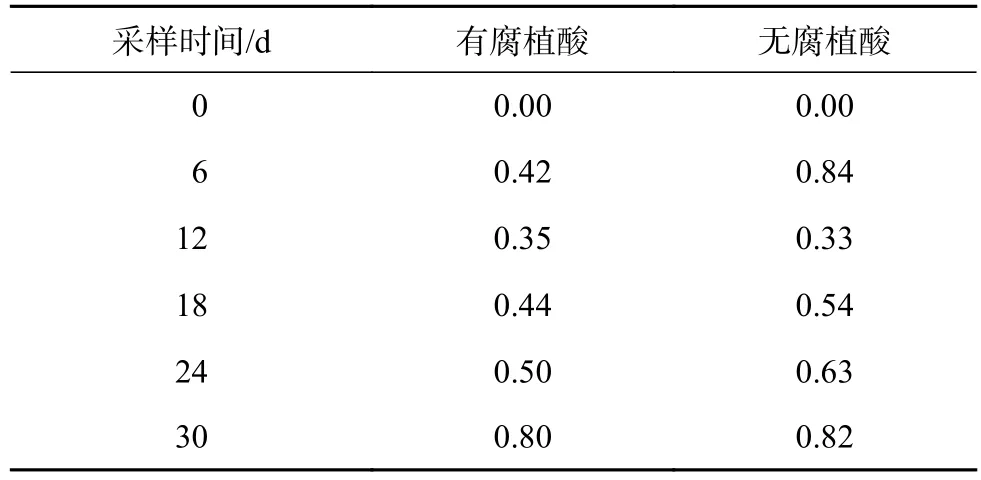
表3 扑草净在香根草根系到茎叶的转移系数Table 3 Transfer coefficient of prometryn from roots to shoots in vetiver grass
3 结论与讨论
添加腐殖酸(200 mg/L)能显著提高香根草根系对水溶液中扑草净的吸收,特别是在第6天,根系中的扑草净提高了50%,但从根系转移到茎叶中被显著抑制。未种植香根草的对照处理组,添加腐植酸对溶液中扑草净的去除作用影响不显著(P>0.05)。添加腐殖酸对溶液中扑草净的去除效果无显著影响(P>0.05)。
研究表明:腐殖酸与农药分子之间所发生的广泛的作用力,可能会对农药的降解出现促进或抑制作用[28]。张珽[29]的研究表明溶解态的腐殖酸对涕灭威及其砜和亚砜的水解起抑制作用。李绍峰等[30-32]的研究表明腐殖酸对扑草净降解的影响表现为低浓度促进、高浓度抑制。赵倩等[33]研究发现腐殖酸能够增加斑马鱼染毒初期(第1天和第5天)体内扑草净的富集量,而在染毒的中后期(10~40 d)会降低扑草净在鱼体内的富集量。刘琳等[34]研究发现不同特性的腐殖酸对作物对砷的吸收和向地上部分转移会出现抑制或促进的作用。朱昱豪等[35]的研究发现高浓度腐殖酸会抑制李氏禾(Leersi ahexandra)对铜和镍的吸收,低浓度腐殖酸可促进李氏禾对铜和镍的吸收并能够更好地促进李氏禾对铜和镍的转运。腐殖酸对香根草吸收和转移溶液中的扑草净的效率还可能与添加腐殖酸的浓度有关,溶液中扑草净的去除效果还受植物的生物量和种植密度等影响。因此,还需要进行更进一步的研究,找出关键的影响因素,得出腐殖酸对溶液中扑草净去除的影响规律。
