功能磁性核壳纳米颗粒制备及对双酚A的吸附
2019-04-12贾永胜李恩泽潘子鹤杜志平程芳琴
贾永胜,李恩泽,潘子鹤,杜志平,程芳琴
(低附加值煤基资源高值利用协同创新中心,国家环境保护煤炭废弃物资源化高效利用技术重点实验室,山西大学资源与环境工程研究所,山西太原030006)
焦化废水中含大量有毒有害物质,酚类有机物作为典型污染物约占20%,对生态环境和人类健康存在严重威胁[1]。焦化废水处理中,酚类污染物主要在生化阶段被去除[2]。由于高浓度酚类有机物对生化阶段微生物影响大,若能在生化处理阶段前期降低酚类污染物的浓度,不仅为生化处理阶段减轻压力,同时节约整个工艺处理成本。所以笔者致力于制备一种易于分离且对酚类具有高效选择性的吸附剂,在焦化废水预处理阶段吸附部分酚类污染物,达到降低其在生化处理中浓度的目的。
特定功能性吸附剂的开发和制备,是实现选择性吸附的关键。目前,磁性介孔纳米材料因具有较大的比表面积,在磁场中可定向移动等优势,在吸附和分离方面引起国内外研究者的广泛关注[3]。目前对磁性吸附剂研究主要有对含油微藻、腐殖酸等的去除[4]。虽然功能化磁性纳米材料已被广泛应用于废水处理中,但主要集中于大分子有机物,而对酚类等难以去除的小分子有机物研究较少。本文主要研究表面苯基改性磁性介孔纳米材料的制备及对焦化废水中酚类有机物(以双酚A为例)的去除性能。材料以磁性Fe3O4纳米颗粒为基底,为其分离和重复利用提供了可能;经过特定官能团表面改性后,可以选择性吸附酚类污染物,为酚类有机物的去除提供了新思路。
1 实验部分
1.1 试剂与仪器
无水乙酸钠(99.9%)、苯基三乙氧基硅烷(PhTES,99%)、正硅酸乙酯(98%)、双酚 A(98%)、十六烷基三甲基溴化铵(99%)、氨水(25%)、丙酮(99.5%)、六水合三氯化铁(99%)、乙二醇(99%);试验中用水均为Milli-Q水(电阻率为18.2 MΩ·cm)。
JEM-1011透射电子显微镜;Antaris IGS傅里叶红外光谱仪;ASAP2460型N2吸脱附等温仪;Setsys Evalution综合热重分析仪;UV-1601紫外-可见分光光度计;Quantax70能量色散X射线光谱仪。
1.2 材料的制备
1)Fe3O4纳米颗粒的制备: 称取2.5gFeCl3·6H2O和5.4 g无水乙酸钠分散到75 mL乙二醇中,磁力搅拌至完全溶解,将得到的黄色黏稠液体转移到水热反应釜中,200 ℃加热 8 h[5]。 冷却,磁场分离,用超纯水和无水乙醇清洗至少6次。60℃真空干燥12 h得到球形Fe3O4纳米颗粒。
2)核壳磁性介孔SiO2纳米颗粒的制备:取上述方法制备的材料0.1g分散到由1.8g十六烷基三甲基溴化铵、480mL超纯水、360mL无水乙醇和6mL氨水组成的溶液中,超声分散后,在高速搅拌(500 r/min)下滴加正硅酸乙酯2.4 g,搅拌6 h后,磁场分离Fe3O4@CTAB/SiO2纳米颗粒。清洗后脱除模板剂CTAB,将得到的产物分散到60 mL丙酮中,85℃加热回流,强力搅拌48 h[4]。磁场分离后用无水乙醇清洗,60℃真空干燥12 h得到Fe3O4@mSiO2。
3)Fe3O4@mSiO2表面苯基改性:将0.5 g Fe3O4@mSiO2纳米颗粒分散到150 mL无水乙醇和1 mL超纯水溶液中,超声,搅拌的同时加入1 mL的PhTES,70 ℃加热回流 7 h[6]。 无水乙醇清洗后在60℃下真空干燥12 h,得到Fe3O4@mSiO2@PhTES。
1.3 材料分析表征
用透射电镜观察纳米颗粒的形貌和尺寸;用N2吸脱附等温仪测定材料的比表面积和孔径;采用傅里叶红外光谱仪检测苯基改性前后Fe3O4@mSiO2的表面官能团;用能量色散X射线光谱仪(EDX)测定苯基改性后Fe3O4@mSiO2@PhTES的元素组成;用热重分析仪测定 Fe3O4、Fe3O4@mSiO2和 Fe3O4@mSiO2@PhTES的质量损失。
1.4 吸附实验
1.4.1 吸附时间的影响
将0.05 g Fe3O4@mSiO2或Fe3O4@mSiO2@PhTES纳米颗粒粉末加入盛有100 mL双酚A(100 mg/L)[7]的锥形瓶中,在25℃下以20 r/min的速度分别搅拌0.5、1、3、5、10、20、40、70、90、120 min 后用磁场将吸附剂沉淀,取上清液10 mL,采用紫外-可见分光光度计在特征波长λ=278 nm处测定溶液中双酚A的质量浓度(mg/L)[8]。 吸附剂的吸附量可通过式(1)进行计算:

式中:qt为 t时刻的吸附量,mg/g;c0和 ce分别为双酚A的初始质量浓度和经过吸附后溶液中剩余的质量浓度,mg/L;V是溶液体积,L;m是吸附剂用量,g。
1.4.2 吸附质初始浓度的影响
固定吸附时间为60 min,除将双酚A初始质量浓度改变为 5、10、20、50、100、150、200 mg/L 外,其余操作条件均同1.4.1节中描述。
2 结果和讨论
2.1 吸附材料的表征
所得纳米颗粒透射电镜图如图1所示。由图1a可知,制备的Fe3O4纳米颗粒大小均匀,直径约为200 nm。由图1b可知Fe3O4@mSiO2颗粒为核壳结构,外层 SiO2厚度约为 20 nm。图 1c显示的Fe3O4@mSiO2@PhTES纳米颗粒尺寸大小与Fe3O4@mSiO2近似,主要是由于硅层上接枝的PhTES分子太小,电镜方法无法区别。
表征PhTES对Fe3O4@mSiO2颗粒表面的改性,分别测定了 PhTES、Fe3O4@mSiO2和 Fe3O4@mSiO2@PhTES的红外光谱图,结果见图2。通过对峰位分析可知,3 000~3 600 cm-1的波峰主要是O—H键的伸缩振动,可能是样品中的水分或Fe3O4表面的羟基引起的[9]。 Fe3O4@mSiO2@PhTES 与 PhTES 的谱图在2 970 cm-1处峰位相对应,而Fe3O4@mSiO2在此位置没有出现相应的峰,该峰位归属于苯基中C—H键的伸缩振动,说明Fe3O4@mSiO2表面已经与PhTES成功接枝。2 920 cm-1和2 850 cm-1处有CH2—键的吸收峰[7],可能是 Fe3O4@mSiO2中残留的正硅酸乙酯或者是PhTES中的亚甲基。1 110 cm-1处峰对应于SiO2中的Si—O—Si键的伸缩振动,同样说明纳米Fe3O4外层成功包裹了SiO2。1 080 cm-1处峰对应于Si—O—C键的伸缩振动,说明 PhTES接枝在Fe3O4@mSiO2表面,此外,586 cm-1处峰对应于Fe—O键的伸缩振动[10]。

图1 Fe3O4(a)、Fe3O4@mSiO2(b)和Fe3O4@mSiO2@PhTES(c)透射电镜图

图2 PhTES、Fe3O4@mSiO2和Fe3O4@mSiO2@PhTES红外光谱图
图3 为 Fe3O4、Fe3O4@mSiO2和 Fe3O4@mSiO2@PhTES纳米颗粒的热重曲线。Fe3O4的曲线在50~250℃的温度范围内约5%的质量损失是由于样品中水分的蒸发。Fe3O4@mSiO2和Fe3O4@mSiO2@PhTES在50~200℃显示较慢的质量损失,是由于样品中低相对分子质量物质的分解。在200~600℃,热分解较为明显,这与Fe3O4@mSiO2中残留的CTAB模板剂和Fe3O4@mSiO2@PhTES中PhTES的分解有关。Fe3O4@mSiO2@PhTES比Fe3O4@mSiO2最终质量损失率高大约5%,主要归因于Fe3O4@mSiO2@PhTES中PhTES 的分解[8]。

图3 Fe3O4、Fe3O4@mSiO2和Fe3O4@mSiO2@PhTES热重曲线

表1 EDX对3种纳米材料的元素分析
为进一步表征Fe3O4纳米粒子外层氧化硅的包裹及其表面苯基改性情况,用能谱测量仪(EDX)来确定3种材料的元素组成,结果见表1。由表1可知,Fe3O4@mSiO2的元素相比Fe3O4的多一种Si元素,且Si元素质量分数达到13.32%,充分说明Fe3O4纳米粒子外层SiO2的存在。另外Fe3O4@mSiO2@PhTES相比Fe3O4@mSiO2的元素组成多了一种C元素,主要是PhTES中苯基中的碳。
图4 为 Fe3O4、Fe3O4@mSiO2和 Fe3O4@mSiO2@PhTES的氮气吸附-脱附等温线和孔径分布曲线,相应参数均列于表2。由图4a可知,Fe3O4纳米颗粒具有Ⅲ型吸附等温线的特征,无单分子层饱和吸附点,说明吸附剂与吸附质(氮气)之间的作用力很弱[11],与表2中显示的Fe3O4纳米颗粒比表面积较小以及表面没有孔径相对应。Fe3O4@mSiO2和Fe3O4@mSiO2@PhTES的吸附等温线具有典型Ⅳ型特征,说明有介孔结构的存在[12]。其中 Fe3O4@mSiO2@PhTES的比表面积和孔容大小分别为215.91 cm2/g、0.118 cm3/g,相比Fe3O4@mSiO2均有增大,孔道直径略有减小,主要是PhTES在Fe3O4@mSiO2的表面存在空间位阻效应减小了孔道直径[13]。

图4 Fe3O4、Fe3O4@mSiO2和 Fe3O4@mSiO2@PhTES 的氮气吸附-脱附等温线图(a)及孔径分布曲线图(b)

表2 3种纳米材料的孔径和比表面积的分析
2.2 吸附实验
2.2.1 吸附平衡时间
Fe3O4@mSiO2和Fe3O4@mSiO2@PhTES纳米颗粒对双酚A的吸附量与吸附时间的关系见图5。对两种不同吸附材料,吸附量随时间的增长先是增加直至达到一定程度后趋于平缓。吸附量趋于平缓的点对应吸附平衡时间。虽然Fe3O4@mSiO2@PhTES作为吸附剂时的吸附平衡时间(60 min)比Fe3O4@mSiO2的(40min)稍长。但是Fe3O4@mSiO2@PhTES的饱和吸附量(109.0mg/g)明显大于 Fe3O4@mSiO2的(87mg/g)。说明苯基能够促进Fe3O4@mSiO2对双酚A的吸附,这是由于接入的苯环能够以π-π共轭形式与溶液中双酚 A 发生作用[14]。

图5 Fe3O4@mSiO2和Fe3O4@mSiO2@PhTES吸附量与时间关系图
2.2.2 吸附动力学模型
为进一步研究双酚A在Fe3O4@mSiO2和Fe3O4@mSiO2@PhTES表面的吸附动力学,分别采用拟一级和拟二级动力学模型对吸附量随吸附时间的变化关系进行拟合[15]。对于拟一级动力学模型,吸附速率表示为:

式中:qe是平衡时的吸附量,mg/g;k1是拟一级吸附动力学的平衡速率常数。将式(2)在 t>0和 0≤qt<qe边界条件下两边同时积分得:
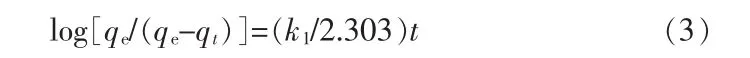
将式(3)进行形式转化得:

图6a为采用式(4)进行拟一级动力学模型拟合所得曲线,相应吸附动力学参数列于表3。由图6a可知,无论是Fe3O4@mSiO2还是Fe3O4@mSiO2@PhTES作为吸附剂,采用拟一级动力学模型拟合所得相关系数(R2)数值均比较小,拟合度较差。
对于拟二级动力学模型,其吸附速率为:

其中k2是拟二级吸附动力学平衡速率常数。对式(5)同样在t>0和0≤qt<qe边界条件下两边同时积分得:

对式(6)进行转换得:
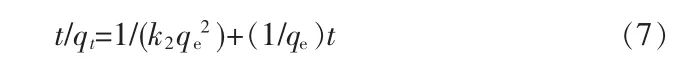
由式(7)可知,t/qt对t呈直线关系。图 6b为采用式(7)进行拟合所得曲线,相应参数列于表3。由图6b可知,Fe3O4@mSiO2和Fe3O4@mSiO2@PhTES作为吸附剂相关系数R2均接近1,相比拟一级动力学模型拟合度要高。另外,根据表3,拟二级动力学模型得到的平衡吸附量qe比拟一级动力学模型的更接近实际实验数据。综上所述,Fe3O4@mSiO2和Fe3O4@mSiO2@PhTES对双酚A的吸附动力学均属于拟二级动力学模型。
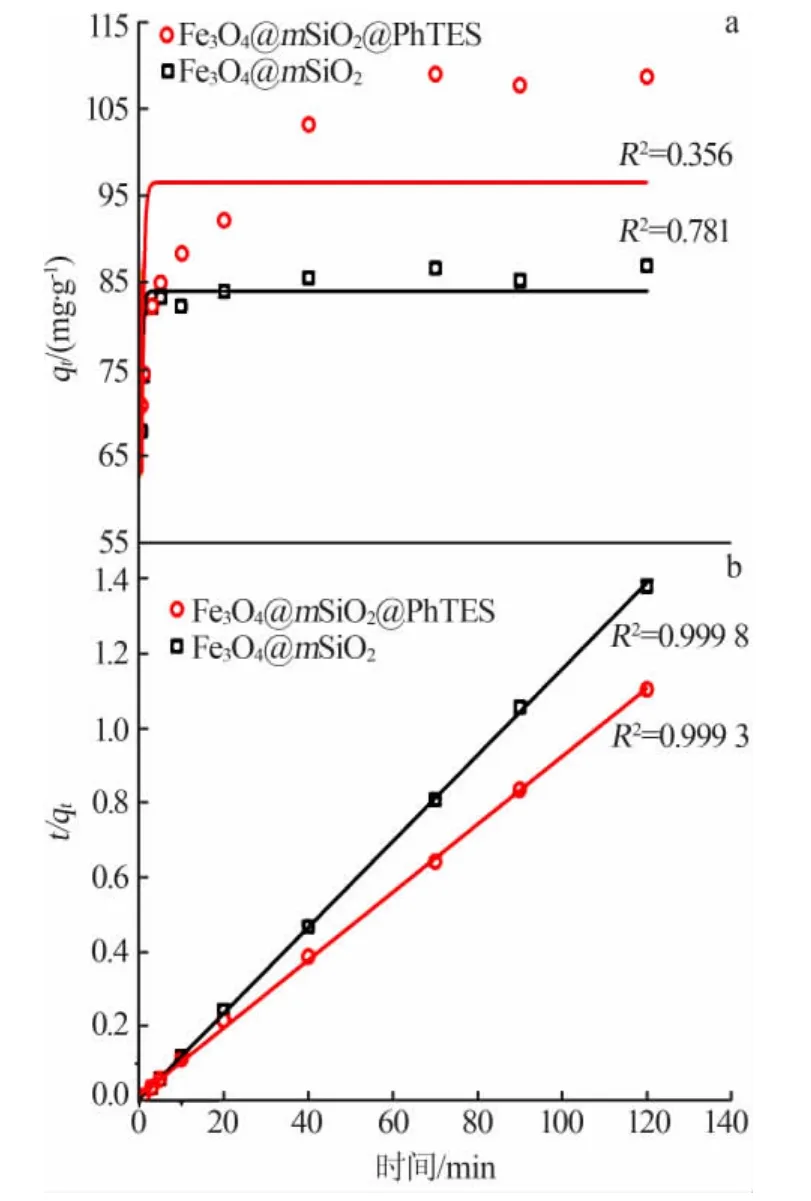
图6 Fe3O4@mSiO2和Fe3O4@mSiO2@PhTES拟一级动力学模型(a)、拟二级动力学模型(b)
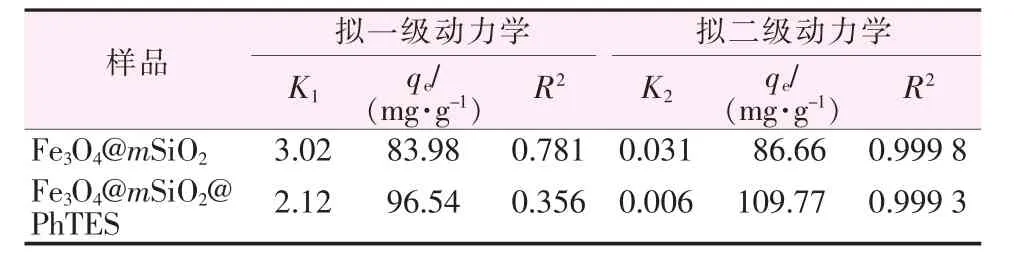
表3 双酚A在两种吸附剂表面的吸附动力学参数
3 结论
本文成功制备了Fe3O4@mSiO2和Fe3O4@mSiO2@PhTES两种新型吸附剂并探究了其对双酚A的吸附机理。通过对材料的形貌和孔径表征可知,制备的Fe3O4纳米颗粒大小均匀,直径约为 200 nm。Fe3O4@mSiO2为核壳结构,其中外层包裹的介孔SiO2厚度约为20 nm,孔径约为2 nm,比表面积约为160 cm2/g。红外和热重分析结果表明,PhTES成功接枝在Fe3O4@mSiO2表面。由两种吸附剂对双酚A的吸附动力学拟合可知,对双酚A的吸附过程均符合拟二级动力学。
