H2O2对白木香细胞生长和挥发性次生产物的影响
2019-04-11李敬辉
蔡 淼,李 明,董 闪,李敬辉
(1.广东药科大学中药学院,广东 广州 510006;2.国家中医药管理局 岭南药材生产与开发重点研究室,广东 广州 510006)
【研究意义】白木香[Aquilariasinensis(Lour.)Gilg]为国产沉香的唯一正品来源[1],由于其自然繁殖率低, 森林资源、生态环境遭受自然灾害和人为破坏, 加上掠夺式的砍伐,其野生资源几乎已经枯竭[2]。白木香含树脂的心材部分称为沉香,具行气止痛、纳气平喘、温中止呕的功效,主要治疗胸腹胀痛、畏寒呃逆、肾虚气喘症[3]。白木香的重要价值体现在结香产物上,白木香结香过程是复杂的防御胁迫反应,诱导子诱导白木香结香是方法之一,本实验研究H2O2对白木香细胞生长及其次生代谢产物的影响,为揭示白木香结香机制提供依据。【前人研究进展】茉莉酸甲酯、水杨酸、乙烯利等化学诱导子能诱导白木香细胞沉香类成分的产生[4]。H2O2是一种活性氧,也是植物响应逆境胁迫的重要信号分子,在调控细胞生长、植保素的合成中发挥重要作用[5],其在大豆、白苜蓿、番茄等其他植物上的研究中有证实[6]。【本研究切入点】本研究开展对白木香悬浮细胞施用不同浓度的H2O2的实验。【拟解决的关键问题】在本实验室之前关于白木香细胞愈伤组织诱导的基础上对白木香细胞进行悬浮培养后[7],在培养基中添加H2O2溶液,通过检测生长指标和化学成分,探究不同浓度的H2O2白木香细胞生长及挥发性成分的影响,为白木香结香机制提供科学依据。
1 材料与方法
1.1 供试材料
本实验采用的白木香[Aquilariasinensis(Lour.)Gilg]悬浮细胞来源于实验室前期培养获得。
1.2 试验方法
1.2.1 诱导子的制备 配置不同浓度的H2O2溶液,过0.45 μm过滤膜过滤后取适量的H2O2溶液加入第1天的白木香悬浮细胞培养液中,加入H2O2溶液的浓度分别为1、5、10、30、50 mmol/L,以无菌水作为空白对照。
1.2.2 细胞培养 参照董闪等[7]的方法,选取白木香无菌苗的茎段为外植体在培养基(MS+1.0 mg/L 6-BA+3.0 %蔗糖+0.6 %琼脂,pH=5.8)中诱导出的愈伤组织作为继代材料,先接种于不添加激素的MS培养基(3.0 %蔗糖+0.6 %琼脂,pH=5.8)中生长7 d,再取长势稳定、颜色正常的愈伤组织接种于培养基(MS+1.0 mg/L 6-BA+2.0 mg/L 2,4-D+3.0 %蔗糖+0.6 %琼脂,pH=5.8)中继代45 d得淡黄色疏松型愈伤组织。将该愈伤组织悬浮培养于培养液(1/2MS+1.0 mg/L 6-BA)中,再置于恒温摇床上25℃暗培养,转速110 r/min条件下培养。
1.2.3 细胞鲜重的检测 在悬浮细胞培养液中加入不同浓度的H2O2,培养3 d后取出愈伤组织,用滤纸吸干表面水分,用万分之一天平称量其质量并记录数据。
1.2.4 细胞活力的检测 参照Miku和王跃华等[8-9]的方法,采用TTC法,取0.25 g愈伤组织,加0.4 %TTC溶液2.5 mL和pH为7的磷酸缓冲溶液2.5 mL染色4 h,取出染色液,蒸馏水洗3次,加5 mL甲醇溶解,60 ℃水浴30 min后取溶液检测其吸光度。
1.2.5 细胞沉降体积的测定 参照史昆[10]等的方法并加以修改,用移液器吸取10 mL悬浮液于精密刻度试管中,静置30 min后读取沉降细胞的体积即为SCV值。
1.2.6 白木香细胞POD活性的测定 参照李玲[11]的方法,取样品0.2 g,加入预冷的磷酸缓冲液5 mL,于10 mL EP管中捣碎,静置20 min,4000 r/min离心10 min,收集上清液即为酶液,测定470 nm处的OD值的变化,酶活性的大小以每克样品每分钟OD值的变化值表示。
1.2.7 白木香细胞MDA含量的测定 参照李玲等[11]的方法,取样品0.2 g,加入TCA溶液5 mL,于10 mLEP管中捣碎,静置20 min,4000 r/min离心10 min,收集上清液即为MDA提取液。测定532 和450 nm处的OD值,计算MDA的含量。
1.2.8 DNA琼脂糖凝胶电泳检测 在添加不同浓度H2O2后的第3天取样检测,按照植物组织DNA提取试剂盒说明书操作提取DNA,将提取后的DNA样品于1.0 %的琼脂糖凝胶上进行电泳,电压110 V,时间30 min,电泳完毕后在凝胶成像系统中观察拍照。
1.2.9 白木香细胞挥发性次生代谢产物的提取及检测 参照张娟芳等[12]的方法制备白木香悬浮培养物供试品溶液,取10 g悬浮培养物,滤纸吸干表面水份倒入研钵中简单研磨,转移至100 mL具塞锥形瓶中,加30 mL三氯甲烷溶液,密封,冰浴超声30 min,冷浸过夜;摇匀过滤,滤渣反复过滤3次,收集滤液,65 ℃水浴蒸干,残渣加1 mL三氯甲烷溶液溶解,微孔滤膜过滤,滤液转移值1 mL容量瓶中定溶,密封冷藏,再采用GC-MS方法检测所配置溶液中的成分。
2 结果与分析
2.1 不同浓度H2O2对白木香悬浮细胞鲜重和活力的影响
如表1所示,白木香悬浮体系的鲜重随H2O2处理浓度的增加呈降低的变化,当H2O2浓度高于1 mmol/L时,其鲜重与对照组相比出现明显降低的变化(P<0.05),在高浓度(30 和50 mmol/L)H2O2处理下,生长后的鲜重低于初始接种量。采用TTC法测定样品活力后发现,白木香细胞活力随着H2O2处理浓度的升高呈显著下降的变化趋势(P<0.05),当浓度达到50 mmol/L时其细胞活力与对照组相比降低了约93.3 %。

表1 不同浓度H2O2对白木香悬浮细胞鲜重和活力的影响
注:增殖倍数=培养后的鲜重/培养前的鲜重,表中标有相同字母的数据表示同列之间比较没有显著性差异(P>0.05),标有不同字母的数据表示表示同列之间比较有显著性差异(P<0.05)。
Note: Proliferation rate = fresh weight after culture / fresh weight before culture. The data with the same letters in the table indicated that there was no significant difference between the same columns (P>0.05),data marked with different letters showed significant difference between the same columns (P<0.05).
2.2 不同浓度对白木香悬浮细胞沉淀体积(SCV)的影响
SCV能够反应悬浮细胞液实际存在的细胞数量,其数值越大说明培养液中的细胞数量越多[13];如图1所示,各培养的时间内,SCV均随H2O2浓度的升高而下降(P<0.05),其中与对照组比较,10、30和50 mmol/L 3个组的SCV值在第1天就出现明显下降的变化,培养第3天时,10、30和50 mmol/L H2O2处理的细胞的SCV分别较对照降幅值相近。
2.3 不同浓度H2O2对白木香细胞POD活性的影响
过氧化物酶(POD)是一种广泛存在于植物体内的氧化还原类酶,其主要作用是催化H2O2氧化分解,清除H2O2对细胞的破坏作用[14]。如图2所示,在培养12 h前,0~5 mmol/LH2O2处理下,POD活性均较对照均显著升高,各处理均在培养6 h时POD活性最高,随后POD活性随时间的延长呈降低的变化,低浓度组(1 mmol/L)和中浓度组(5 和10mmol/L)POD活性在6 h达到最大值,高浓度组(30 和50 mmol/L)POD活性在4 h达到最大值,其中5 mmol/L处理组的POD最大活性明显高于其它组;当处理时间超过2 d时,低中浓度组(1、5和10 mmol/L)的POD活性恢复到了初始状态,而高浓度组(30 和50 mmol/L)的POD活性已基本丧失。
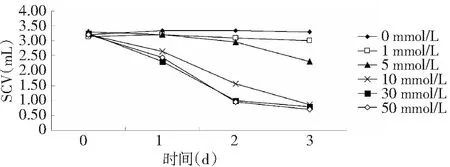
图1 不同浓度H2O2对白木香悬浮细胞SCV的影响Fig.1 Effects of different concentration of H2O2 on cell SCV of Aquilaria sinensis
2.4 不同浓度H2O2对白木香细胞MDA含量的影响
丙二醛(MDA)是细胞膜脂质过氧化的产物,其含量大小可间接反应植物细胞组织受损伤的大小[15]。不同浓度H2O2对白木细胞MDA含量的影响结果如图3,不同浓度处理组的MDA含量在培养时间内,均随浓度的升高呈升高的变化,在4 h达到第1次高峰,而后降低,在8 h达到最低值,随后各浓度培养均随时间的延长MDA含量升高。在培养第3天时,高浓度处理组(30 和50 mmol/L)的MDA含量显著高于对照组。
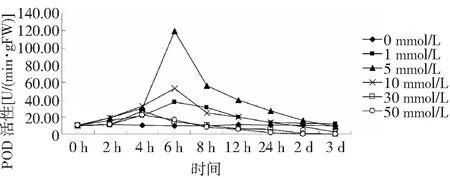
图2 不同浓度H2O2对白木香细胞POD活性的影响Fig.2 Effects of different concentration of H2O2 on cell POD activities of Aquilaria sinensis
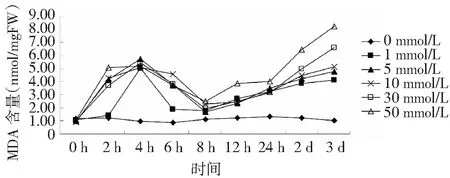
图3 不同浓度H2O2对白木细胞MDA含量的影响Fig.3 Effects of different concentration of H2O2 on MDA of Aquilaria sinensis

M:DNA marker;A:对照;B:1 mmol/L;C:5 mmol/L;D:10 mmol/L;E:30 mmol/L;F:50 mmol/L图4 不同浓度H2O2处理后的白木香细胞DNA琼脂糖凝胶电泳图Fig.4 Cellular DNA agarose gel electrophoresis of Aquilaria sinensis under different concentrations of H2O2
2.5 DNA琼脂糖凝胶电泳
DNA琼脂糖凝胶电泳技术已广泛应用在动植物细胞的PCD检测当中,当细胞发生PCD时,细胞核内DNA会降解成100~200 bp及其整数倍的片段,通过琼脂糖凝胶电泳可观察到“DNA Ladder”图谱[15]。经过不同浓度H2O2处理后,白木香细胞中的DNA均发生了不同程度的降解,其中,低浓度(1 和5 mmol/L)组降解条带明显,中浓度组(10 mmol/L)出现梯形条带的出现,说明添加不同浓度H2O2后,白木香细胞中的DNA均出现降解。图4为经过不同浓度H2O2处理后的白木香细胞DNA电泳图,从图中可看出,5个处理组均出现不同程度降解带,其中,1 和5 mmol/L H2O2组(图4,B和图4,C),在100~500 bp之间出现DNA降解带较明显;10 mmol/L H2O2组(图4,D),在100~1200之间出现梯状DNA降解带;30 和50 mmol/L H2O2组(图4,E和图4,F),在100~500 bp之间出现较淡降解带;而对照组(图4,A)无降解条带。
2.6 不同浓度H2O2对白木香细胞次生产物的影响
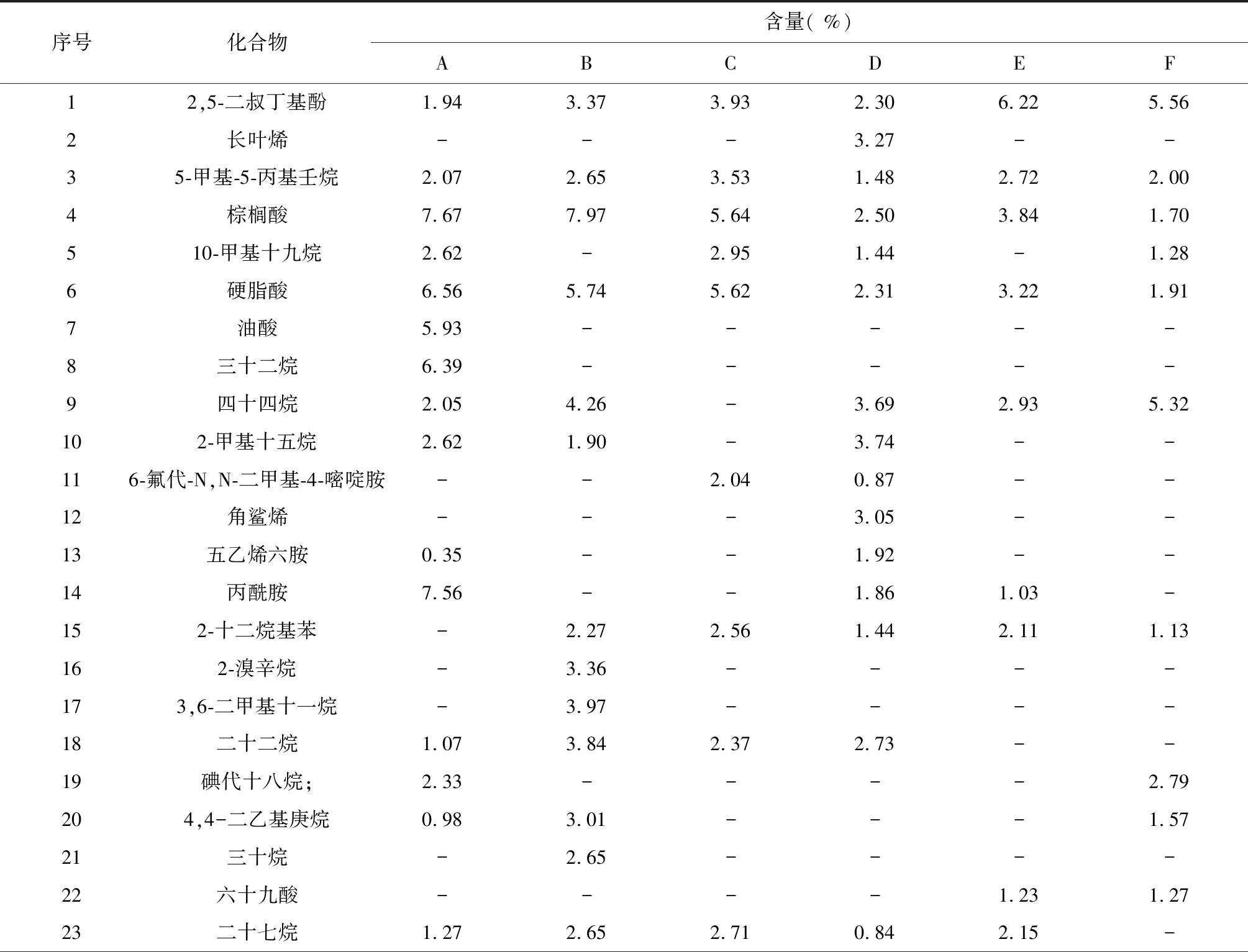
表2 不同浓度H2O2对白木香细胞次生代谢产物的影响
续表2 Continued table 2

序号化合物含量( %)ABCDEF24高瓜氨酸-1.943.702.461.46-25癸醛---2.50--261,4-双(1-甲基乙基)苯--1.342.52--272,4,6-三甲基辛烷1.761.68----282-脱氧-D-半乳糖----2.14-294-甲基庚烷1.380.72----302-甲基十五烷2.62-----311-(4-叔丁基甲基)丙-2-酮----1.37-32硫酸--2.340.74-1.12332,4,6-三甲基辛烷1.761.683.64---344-乙酰氨基丁酸-0.722.13---355-茚醇-13.88---0.51361-(苄氧基)8-萘酚14.12-----37氨基甲酸-1.48----38十六烷基磺酰氯---1.79--39肉桂酸---5.04--40十二烷基乙二醇-1.49-3.09-1.14413,5-二甲基苯丙胺-1.551.104.971.882.33萜类化合物( %)0006.3200芳香族化合物( %)16.0621.078.9013.0210.219.53有机酸类化合物( %)20.1618.5713.3912.319.754.88烷烃类化合物( %)26.5928.2915.2013.927.8010.17其它化合物( %)10.246.865.4810.986.656.11
注:表中A、B、C、D、E、F分别代表对照组、1 mmol/L H2O2处理组、5 mmol/L H2O2处理组、10 mmol/L H2O2处理组、30 mmol/L H2O2处理组和50 mmol/L H2O2处理组。
Note: A, B, C, D, E and F in the table represent control group, 1 mmol/L H2O2treatment group, 5 mmol/L H2O2treatment group, 10 mmol/L H2O2treatment group, 30 mmol/L H2O2treatment group and 50 mmol/L H2O2treatment group respectively.
如表2所示,在对照组和5个不同浓度H2O2处理组中,检出成分主要有烷烃类化合物、有机酸类化合物和芳香族类化合物。低浓度处理组(1 mmol/L)的芳香族化合物含量和烷烃类化合物含量最高,分别达到了21.07 %和28.29 %,对照组的有机酸类化合物含量最高,达到了20.16 %。所有实验组均检测出芳香族类化合物2,5-二叔丁基酚,脂肪酸类化合物棕榈酸和硬脂酸,而萜类化合物仅在10 mmol/L处理组中被检测出。
对照组与处理组比较发现,对照组检测出1-(苄氧基)8-萘酚、油酸、三十二烷、2-甲基十五烷等特殊成份,处理组则检测出2-十二烷基苯、3,5-二甲基苯丙胺、高瓜氨酸、4-乙酰氨基丁酸、氨基甲酸等特殊成分;5个处理组之间比较发现,低浓度处理组(1 mmol/L)芳香族类化合物和烷烃类化合物含量要明显高于其它组,10 mmol/L处理组检测出长叶烯(3.27 %)、角鲨烯(3.05 %)、十六烷基磺酰氯(1.79 %)、肉桂酸(5.04 %)等多种沉香类成分[16],而高浓度处理组(30 和50 mmol/L)有机酸和芳香族类化合物的种类和含量均显著下降。
3 讨 论
研究表明,H2O2作为一种活性氧(ROS),也是一种重要的信号分子,在调控植物抵御逆境中发挥重要的作用,并参与调节植物生理生化代谢、相关酶与基因激活、细胞死亡及植保素类的形成和积累方面都发挥重要的作用[17-18]。H2O2是植物中最稳定的活性氧分子之一,ROS机制在植物的防御反应中起重要的作用,在许多研究中被证实。用H2O2处理培养的细胞可以诱导保护反应和细胞死亡[19],ROS 的产生与植保素的合成也有密切的关系,在菜豆、大豆、白苜蓿、番茄和其他植物上的研究中均有证实, ROS 和植保素之间确实存在高度的相关性[20]。研究发现,外源 H2O2对水稻幼苗生长、细胞死亡和生长素分布有影响[21], 一定浓度的H2O2能增加燕麦苗中可溶性糖、蛋白质、脯氨酸等渗透性调节物质的含量,提高SOD、CAT、POD等抗氧化酶活性,减轻膜脂氧化伤害与燕麦苗生长受抑制程度,增强燕麦的耐盐性[22]。外源喷施H2O2能够增加苦菜幼苗可溶性糖、可溶性蛋白质和脯氨酸渗透调节物质的含量,提高抗氧化酶SOD、POD、CAT 和 APS 酶的活性[23]。本实验表明,白木香细胞的生长、活力、SCV均随H2O2浓度的升高而显著降低,高浓度H2O2处理可以导致白木香细胞死亡。
MDA是表示膜质过氧化的指标,其值越高,表示膜质过氧化程度越高,细胞损伤越严重[14]。本研究表明,白木香细胞的MDA含量随H2O2浓度的升高而升高,表明高浓度的H2O2能够导致白木香细胞产生氧化胁迫。POD是植物体内的重要的抗氧化酶之一,低浓度处理的白木香细胞POD活性在生长前期呈显著升高的变化,在生长后期呈急剧降低的变化;高浓度处理的细胞POD活性在培养期内均显著低于低、中浓度处理的,在生长后期,高浓度处理的细胞POD活性已基本丧失,可能与高浓度H2O2处理下的白木香细胞发生了大量死亡有关。通过GC-MS技术检测H2O2对白木香细胞的挥发油成分的影响,结果表明,经过H2O2处理,白木香细胞次生产物的种类和含量都发生了一定的变化。低浓度处理组(1 mmol/L)的芳香族化合物含量和烷烃类化合物含量最高,而仅在10 mmol/L处理组检测出长叶烯(3.27 %)和角鲨烯(3.05 %)2种萜类化合物,高浓度处理组中有机酸和芳香族类化合物的种类和含量均呈降低的变化,有关H2O2对白木香细胞次生产物的组分及含量影响的相关机制仍需深入开展。
4 结 论
外源H2O2对白木香细胞的生长、活力产生影响,随浓度的升高而降低,至一定浓度时,导致细胞死亡,一定浓度的H2O2能够诱导白木香细胞的长叶烯(3.27 %)和角鲨烯(3.05 %)、十六烷基磺酰氯(1.79 %)、肉桂酸(5.04 %)等多种沉香类成分的形成。
