基于SSR 标记的初烤烟叶品种快速鉴别
2019-04-09孙九喆杨金初苏东嬴王二彬王君婷张顺峰
孙九喆,杨金初,苏东嬴,王二彬,王君婷,张顺峰,李 萌,马 林*
1. 河南中烟工业有限责任公司技术中心,郑州市陇海东路72 号 450000
2. 郑州轻工业学院食品与生物工程学院,郑州高新技术产业开发区科学大道136 号 450001
烟叶品种的真实性是叶组配方稳定的基础,同时也是产品质量和风格稳定的保障。近年来随着分子标记技术的日益成熟和完善,AFLP、RAPD、SCAR、SSR 和SNP 等分子标记技术已广泛应用于烟草指纹图谱构建和品种区分[1-2]。肖炳光等[3]利用18 条RAPD 引物成功建立29 个烤烟品种的指纹图谱,为烤烟品种的真实性检测提供了依据;马林等[4]筛选出6 个SCAR 标记引物,成功制定出12 个烟草品种的快速鉴定技术路线;陈婷婷等[5]利用4 对品种鉴别效率高的SSR 引物构建了与云烟87 亲缘关系较近的9 个烟草品种指纹图谱。与其他分子标记相比,SSR 具有操作简单、快速、多态性高和重复性好等优点,已广泛应用于烟草种质资源的多样性分析、分子辅助育种和品种区分[6-7]。刘国祥等[8]利用25 对SSR 引物对33 个晒烟品种进行了遗传多样性分析,并成功构建出33 个晒烟品种指纹图谱;徐军等[9]筛选出8 对多态性较好的SSR 引物,将80 份烟草种质完全区分;黄莉莎等[10]利用已知烟草序列,设计62 对SSR引物,并筛选出21 对稳定性好、多态性高的SSR引物用于烟草品种鉴别;尹国英等[11]从278 对SSR引物中筛选出14 对核心引物用于烟草种质资源鉴定。但卷烟工业企业使用的是烤后烟叶,已报道的烟草品种分子鉴定方法多以鲜烟叶为实验材料,对烤后烟叶的品种鉴别则鲜见报道[4,12]。而烤后烟叶基因组DNA 降解严重[13],以鲜烟叶基因组DNA 为基础构建的指纹图谱可能不适于区分烤后烟叶品种。此外,目前多应用非变性聚丙烯酰胺凝胶电泳分析SSR 结果[8-11],该操作复杂、耗时且成本较高[14]。为此,以卷烟工业企业常用的11 个烤烟品种初烤烟叶为研究材料,选择产物在200 bp 左右的SSR 引物作为候选引物,应用操作简单的琼脂糖凝胶电泳对扩增产物进行分离,筛选多态性好、重复性高的SSR 鉴定引物,构建烟草品种指纹图谱库,旨在建立基于SSR 的初烤烟叶品种快速鉴别方法,为烟叶收购和烟叶配方选择等环节中区分烟草品种提供依据。
1 材料与方法
1.1 材料、试剂与仪器
1.1.1 材料
以郑州轻工业学院烟草生物技术研究室保存的卷烟企业常用的11 个品种初烤烟叶(2017 年生产)为试验材料,品种信息见表1。
1.1.2 试剂
磁珠法植物基因组DNA 提取试剂盒购自洛阳吉恩特生物科技有限公司;2×Taq Plus Master Mix 购自南京诺唯赞生物科技有限公司;24 对SSR 引物选自Bindler 等[15]公布的SSR 遗传图谱中多态性较好的SSR 标记(表2),由生工生物工程(上海)有限公司合成。

表2 24对SSR 引物序列Tab.2 24 SSR primer pairs
1.1.3 仪器
JXSF TPRP-24 组织研磨仪(上海净信实业发展有限公司);NanoDrop ND-2000C 超微量分光光度计(美国Thermal Scientific 公司);DYY-6C 型电泳仪(北京市六一仪器厂);Vetiti 型梯度PCR仪(美国ABI 公司);Mini Bis Pro 型凝胶成像分析系统(以色列DNR 凝胶成像系统有限公司)。
1.2 方法
1.2.1 基因组DNA 提取
取15 mg 烟叶置于1.5 mL 离心管中,应用组织研磨仪磨成粉末(65 Hz, 2 min),然后采用磁珠法提取烟草基因组DNA,操作过程及试剂用量均按试剂盒说明书进行。用1.5%的琼脂糖凝胶电泳和超微量分光光度计检测DNA 的质量和浓度,将DNA 稀释至50 ng/µL,置于-20 ℃保存。
1.2.2 SSR-PCR 扩增
SSR-PCR 反应体系:20 µL 体系,含50 ng/µL模板DNA 2 µL,2×Taq Plus Master Mix 10 µL,10µmol/L 上 、下 游 引 物 各1 µL,ddH2O 补 充 至20µL。SSR-PCR 反 应 程 序 :94 ℃ 预 变 性5 min;94 ℃变性30 s,50 ℃退火30 s,72 ℃延伸45 s;35个循环,最后72 ℃延伸10 min。取5 µL 扩增产物上样于3%琼脂糖凝胶,85 V 恒压电泳55 min 后应用凝胶成像系统拍照。
1.2.3 核心引物筛选及退火温度优化
根据电泳结果,对特异性较好的引物进行退火温度优化,最终选出特异性强、能产生稳定条带的核心SSR 引物用于初烤后烟叶品种鉴定。
1.2.4 SSR 电泳图谱分析
根据标记位点每个品种特异性条带的“有”或“无”对凝胶电泳结果进行分析。“有”记为“1”;“无”记为“0”,以构建11 个初烤后烟叶品种的指纹谱库,得到每个烟叶品种的分子ID。根据分子ID 建立11 个初烤后烟叶品种SSR 鉴定技术路线图。
2 结果与分析
2.1 初烤烟叶基因组DNA 提取结果
由凝胶电泳结果(图1)可知,利用磁珠法提取的基因组DNA 主条带清晰,无明显杂带,胶孔周围无明显发亮物质出现;由基因组纯度检测结果(表3)可知,提取的基因组DNA OD260/OD280的值在1.8 左右,纯度较高。因此,利用磁珠法提取的基因组DNA 符合后续实验要求。
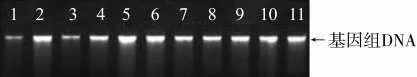
图1 烟草基因组DNA 凝胶电泳图谱Fig.1 Electrophoregram of tobacco genomic DNA

表3 烟草基因组DNA 浓度和纯度检测结果Tab.3 Test results of concentration and purity of tobacco genomic DNA
2.2 引物筛选及退火温度优化
利用24 对候选SSR 引物分别进行PCR 扩增,均出现清晰条带,但PT20021、PT1037、PT30021、PT30230、PT30259 和PT40024 引物特异性较弱(图2),不 适 用 于 品 种 鉴 定 。PT20189、PT40021、PT20306、PT30021、PT30470 和PT20213 等19 对SSR 引物均能产生特异性条带,可用于品种鉴定。对其进行退火温度优化,其中PT20165、PT20172、PT20213、PT30380 和PT40021 等5 对SSR引物能产生稳定清晰的特异性条带,可将供试的11 个初烤后烟草品种完全区分开(图3),5 对SSR引物及退火温度见表4。
2.3 SSR 凝胶电泳图谱分析
PT20213、PT40021、PT20172、PT30380 和PT20165 在最适退火温度条件下,分别对11 个供试品种进行扩增。5 个SSR 引物共扩增出15 条稳定清晰的特异性谱带,主要集中在100~300 bp 之间,可通过3%琼脂糖电泳完全区分(图3)。
2.4 烟草品种指纹谱库的构建
根据PT20213、PT40021、PT20172、PT30380 和PT20165 等5 条引物扩增出特异性条带情况,“0”代表未扩增出特异性条带,“1”代表扩增出特异性条带。利用二元表法对5 张电泳图进行分析,最终建立11 个烟草指纹品种指纹谱库(表5)和分子ID(表6)。

图2 6 对特异性较弱SSR 引物的PCR 扩增结果Fig.2 Amplification results of six SSR primer pairs with low specificity
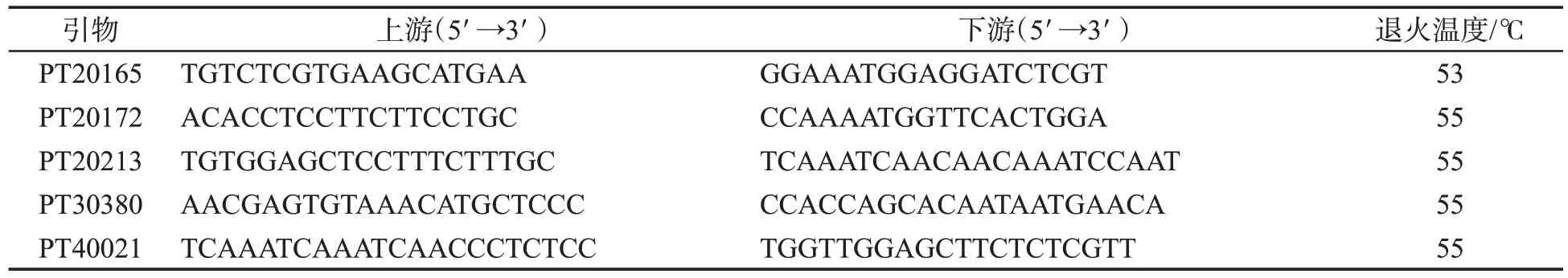
表4 5 对核心引物及其退火温度Tab.4 Five core SSR primer pairs and their annealing temperatures

图3 5 对特异性SSR 引物的PCR 扩增结果Fig.3 Amplification results of five specific SSR primer pairs
2.5 烟草品种鉴别路线的建立
根据11 个烟草品种引物PT20213 的电泳图谱(图3),将11 个烟草品种分为4 组。第1 组包含1、7、8、9 号品种;第2 组仅包含10 号品种,即豫烟10号被鉴定出;第3 组包含3 和4 号品种;第4 组包含2、5、6 和11 号品种。
对第1 组而 言,引物PT40021 将第1 组的4 个品种分为两个亚组,第1 亚组包含1 和9 号品种,第2 亚组包含7 和8 号品种;最后利用引物PT20172 将两个亚组中的两个品种区分开。同理依次类推,第3 组中的两个品种可用引物PT20172鉴别。第4 组中的4 个品种可通过PT30380 和PT20165 两轮PCR 完全区分开。经过上述鉴别流程,11 个烟草品种被完全区分(图4)。

表5 11 个烟草品种的指纹谱库Tab.5 Fingerprint spectrum library of 11 tobacco varieties

表6 11 个烟草品种分子IDTab.6 Molecular ID of 11 tobacco varieties
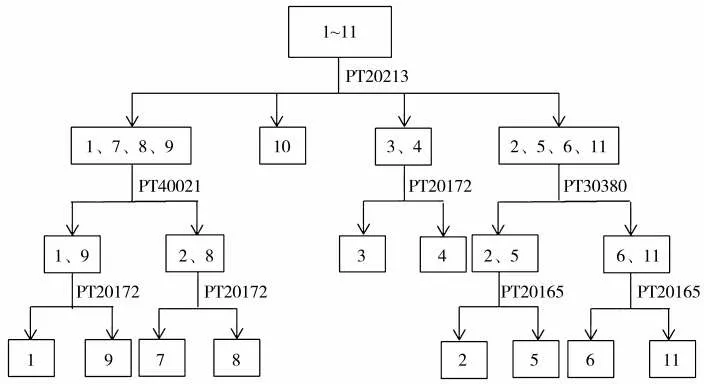
图4 11 个初烤烟叶品种SSR 鉴定技术路线Fig.4 Technical route for SSR identification of varieties of 11 cured tobacco leaf samples
3 讨论
高质量基因组DNA 的获取是开展分子标记研究的基础,目前烟草基因组DNA 提取方法多为改良CTAB 法[16-18]。本研究中应用磁珠法对实验室保存多年的初烤烟叶样品进行了DNA 提取,该方法不需液氮研磨,提取过程不需要添加酚、氯仿等有机溶剂,可从15 mg 的烟叶样品中提取纯度和浓度均符合下游实验需求的基因组DNA,具有简便、安全、高效等诸多优点,可替代CTAB 法用于烟叶基因组提取。
本研究中从24 对SSR 引物中筛选出5 对重复性和多态性均较好的鉴定引物,共扩增出15 个多态性位点,平均每个引物3 个,多态性位点数量显著少于前人的研究结果[9-11]。DNA 模板对PCR 扩增结果有重要影响,以往研究所用模板均为新鲜烟叶基因组DNA,而本研究中PCR 扩增所用模板为初烤后烟叶基因组DNA,推测初烤后烟叶基因组DNA 降解和碎片化导致的引物结合位点的减少可能是造成本研究鉴定引物扩增得到多态性位点较少的重要原因。此外,聚丙烯酰胺凝胶电泳和琼脂糖电泳分析灵敏度的差异也可能是SSR 引物扩增位点差异明显的原因之一[14]。
栽培烟草品种繁多且品种间亲缘关系较近,找到有效鉴定引物是品种区分的关键。由于初烤后烟叶基因组DNA 与新鲜烟叶差异较大,以新鲜烟叶为实验材料筛选出的鉴定引物可能不适合区分烤后烟叶品种。本研究中发现尹国英等[11]以新鲜烟叶为材料筛选的SSR 核心鉴定引物PT30021、PT30259 和PT40024 在11 个初烤烟叶品种间无多态性,不能有效区分烟草品种。本研究中筛选出的5 对SSR 引物可有效区分包括红花大金元、云烟85、云烟87 及云烟97 等亲缘关系近的11 个烤烟品种,为烟草企业提供了一种区分初烤后烟叶品种的有效方法。在生产实际中随着鉴别品种范围的扩大,原有鉴定引物可能不能有效区分新增和原有烟草品种,需要进一步筛选加入新的鉴定引物。
4 结论
以初烤烟叶为研究对象,利用磁珠法提取了卷烟企业常用的11 个烟草品种基因组DNA。从24 对候选SSR 引物中筛选出5 对稳定性高、辨识度好的SSR 引物,根据琼脂糖凝胶电泳结果成功构建了11 个核心烟草品种的指纹图谱,并建立了基于SSR 的11 个烟草品种的快速鉴别方法。本研究中建立的初烤后烟叶品种的鉴别方法具有成本低廉、简单高效、可操作性强、安全性好等特点,可用于11 个品种初烤烟叶的区分和品种真实一致性的快速判定。
